Расшифрована структура каталитического центра нитрогеназы — фермента, расщепляющего атмосферный азот

После многолетних усилий американским и германским ученым удалось расшифровать структуру «железо-молибденового кофактора», образующего каталитический центр фермента нитрогеназы и играющего ключевую роль в фиксации атмосферного азота. Открытие должно помочь в разработке новых эффективных технологий производства жизненно необходимых человечеству азотных удобрений.
Азотфиксация — важнейший биологический процесс, в ходе которого атмосферный азот (N2) превращается в пригодный для использования живыми организмами аммоний (NH4+). Далеко не все живые существа умеют осуществлять азотфиксацию. Лишь некоторые прокариоты, в том числе цианобактерии, справляются с этой технически очень непростой задачей. Всё живое на Земле до недавних пор существовало исключительно за счет азота, связанного азотфиксирующими микробами (см.: Азот в океане связывается там, где он теряется, «Элементы», 06.02.2007). Лишь недавно на планете появился еще один важный источник связанного азота — производимые человеком искусственные азотные удобрения.
Чтобы разорвать прочную тройную связь в молекуле N2, нужны либо высокие давление и температура, либо невероятно эффективный катализатор. По первому пути идет наша химическая промышленность, производящая аммиак из азота при помощи чрезвычайно энергоемкого «процесса Хабера». По имеющимся оценкам, сегодня около половины всего азота, входящего в состав человеческих тел, — это азот, зафиксированный при помощи процесса Хабера (и попавший сначала в азотные удобрения, синтезируемые из аммиака, а затем в культурные растения).
Азотфиксирующие прокариоты, чьими трудами фиксирована вторая половина азота в наших телах, естественно, избрали второй путь. Они расщепляют азот при помощи специальных ферментов — нитрогеназ, эффективно справляющихся с этой задачей при нормальной температуре и давлении. Неудивительно, что люди с давних пор хотели понять, как устроены нитрогеназы и как они работают.
Для этого оказалось недостаточно расшифровать аминокислотную последовательность нитрогеназы и реконструировать трехмерную структуру белка. Дело в том, что функцию каталитического центра в молекуле нитрогеназы выполняют не аминокислоты, а особый кофактор, состоящий из железа, серы и молибдена. У некоторых прокариот вместо атома молибдена в активном центре нитрогеназы находится атом ванадия или железа, но такие нитрогеназы менее эффективны и хуже изучены.
Железо-молибденовый кофактор (сокращенно FeMoco) — самый большой и сложный из известных на сегодняшний день биологических катализаторов на основе металлов. Этот шедевр биологических нанотехнологий изготавливается специальными ферментами (см. Nif gene) и прикрепляется к белковой основе нитрогеназы. Многие детали синтеза FeMoco до сих пор не выяснены. Именно этот кофактор играет ключевую роль в процессе азотфиксации: к нему присоединяется молекула азота, и здесь же происходит ее расщепление (см.: Эффективная азотфиксация появилась после становления кислородной атмосферы на планете, «Элементы», 25.05.2011). Поэтому для того, чтобы понять принцип работы нитрогеназы, необходимо в первую очередь расшифровать структуру железо-молибденового кофактора.
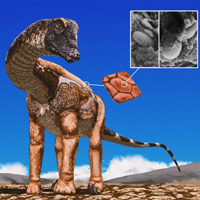
Это оказалось не так-то просто сделать. В 1992 году, когда была предпринята первая серьезная попытка проникнуть в эту тайну, разрешающая способность методов, имевшихся в распоряжении ученых, оказалась недостаточной, чтобы обнаружить атом, находящийся в самом центре FeMoco (см. левое изображение на рисунке). В 2002 году было показано, что центральный атом существует, но установить его природу еще долго не удавалось. Формулу кофактора с тех пор записывали так: [Mo:7Fe:9S:X], что означает «один атом молибдена, 7 атомов железа, 9 атомов серы и еще один атом неизвестно чего». Это мог быть кислород, углерод или азот, причем последний вариант казался наиболее вероятным (среднее изображение).

И вот сразу две команды ученых из Германии и США одновременно и независимо друг от друга показали, что в центре кофактора FeMoco на самом деле находится атом углерода (правое изображение). Первый коллектив — тот самый, который в 2002 году предположил, что это азот, — воспользовался для расшифровки структуры кофактора усовершенствованным методом импульсного электронного парамагнитного резонанса (см.: Pulsed electron paramagnetic resonance). Второй коллектив пришел к выводу о том, что в центре кофактора находится атом углерода, при помощи рентгеновской эмиссионной спектроскопии (см.: X-ray emission spectroscopy).
Таким образом, почти два десятилетия усилий увенчались успехом: структура одного из самых важных для поддержания жизни на нашей планете биологических катализаторов окончательно расшифрована. Это открытие имеет не только теоретическое, но и практическое значение. Зная структуру FeMoco, химикам будет легче разработать новые технологии промышленной фиксации атмосферного азота — более эффективные и менее энергоемкие, чем процесс Хабера.
Источники:
1) Thomas Spatzal, Müge Aksoyoglu, Limei Zhang, Susana L. A. Andrade, Erik Schleicher, Stefan Weber, Douglas C. Rees, Oliver Einsle. Evidence for Interstitial Carbon in Nitrogenase FeMo Cofactor // Science. 2011. V. 334. P. 940.
2) Kyle M. Lancaster, Michael Roemelt, Patrick Ettenhuber, Yilin Hu, Markus W. Ribbe, Frank Neese, Uwe Bergmann, Serena DeBeer. X-ray Emission Spectroscopy Evidences a Central Carbon in the Nitrogenase Iron-Molybdenum Cofactor // Science. 2011. V. 334. P. 974–977.
3) S. Ramaswamy. One Atom Makes All the Difference // Science. 2011. V. 334. P. 914–915.
См. также:
1) Эффективная азотфиксация появилась после становления кислородной атмосферы на планете, «Элементы», 25.05.2011.
2) Азот в океане связывается там, где он теряется, «Элементы», 06.02.2007.
-
Из ссылки на "Проце́сс Хабе́ра"
"Любопытно, что биофиксация атмосферного азота микрорганизмами - еще более энергоёмкий процесс: для ассимиляции 1 молекулы азота требуется не менее 12 молекул АТФ, что эквивалентно 5000 кВт*ч на 1 тонну аммиака."
Интересно, конечно, как прокариоты это делают, но с точки зрения технологий - скорее всего увы.-
А зачем катализатору, который создадут на базе такого активного центра, поставлять водород именно в виде АТФ? Можно и поэкономичнее что-нибудь придумать.
-
Там скорее не водород, а его ионы поставляются, не?
А в целом, еще не известно сколько энергии будет уходить на создание такого катализатора. Сам-то он будет мало энергии тратить, но его создание...-
Думаю катализатор копироваться не будет, будет создан лишь активный центр причем он может радикально отличаться от исходного. По сути молибден сам по себе обладает сродством к азоту, остается только создать пространственную структуру атомов с определенным распределение зарядов. Скорее всего получится что-нибудь вроде модифицированного молибденом пирита. Уверен он будет стоить копейки а эффективность повысится.
-
-
-
Да но азотфиксация у прокариот протекает при нормальных условиях, используя только широкодоступный источник энергии, не накладывающий никакой нагрузки на окружающую среду - в виде энергии солнца ( если рассматривать всю симбиотическую цепочку). А для фиксации азота человечеством в настоящих условиях требуются разработка месторождения исчепаемых месторождений метана. Поэтому КПД процесса далеко не самый важный показатель
-
Думаю, тут теперь хотя бы есть поле для разумных гипотез. Можно попытаться синтезировать этого монстра без белкового орнамента для начала. Посмотреть, как там что фиксируется. Опять же можно посчитать квантами молекулу катализатора и его переходные состояния с зафиксированным азотом и восстановителем.
Интересно как синтезируется такой кластер в природе?
-
Вот-вот. Ни разу не видел, чтоб, скажем карбораны (там трехцентровые двуэлектронные связи С-С, С-В объединены в ароматический ансамбль) в природе встречались. А тут - просто песня! Центральный атом углерода придаёт всему архитектурному комплексу особое очарование; следует также отметить, что он был построен много-много-много лет назад в водной среде. И, ведь, этакую-то да красоту белки собирают!
А ещё хотелось бы знать электронное строение. Здаётся мне, атомы железа там тоже слегка "не от мира сего" :)-
Из чего делается вывод про водную среду? Вобщем то в клетке воды нет, связанная оболочковая вода вокруг органических молекул является веществом, но никак не фазой воды в клетке, при этом Н2О адсорбционно связанная в виде гидрационных молекул органической молекулы имеют совсем другую химическую активность. Это большое заблуждение думать что в клетке есть вода, там нет воды в физикохимическом смысле, кроме вакуолей и то там раствор.
А если вы про опаринский бульон, так вообще нет никаких оснований думать, что жизнь возникла в воде.-
Пожалуй, Ваше утверждение ближе к истине, чем моё (но там даже у меня не столько утверждение, а так, голая эмоция без гидратной шубы). Но вот какие мысли в голову приходят. Я думаю дело должно обстоять так в живой клетке, что центр, сильно боящийся воды, должен быть заэкранирован объёмными подвижными частями молекулы, а когда подходит нужный субстрат, геометрия вокруг этого центра меняется под его действием, и субстрат этот атакует такой вот центр. Другой вариант, скажем АТФ, у него небольшое время полураспада; АТФ постоянно производят и постоянно используют, только малая часть бесполезно разваливается водой. Конечно, я понимаю, что активность молекул воды в клетке играет более заметную роль, чем формальная концентрация воды.
Возьмём соль паратолуолсульфакислоты Ca(TsO)2*6H2O и растворим её в безводном хлористом метилене (ДХМ), это р-р А. Обмен лигандированной воды на молекулы ДХМ не возможен. (В ДХМ эта соль не будет диссоциировать на анион и катион, а будет существовать в виде тесной ионной пары) Сделаем ещё р-р Б: это р-р в том же ДХМ, но уже [Bu4N]AlH4 (тоже ионная пара). Смешаем растворы - начнёт выделяться водород. Вуаля, вода там не присутствует в виде отдельной фазы или р-ра вообще, а процесс идёт. Ca(TsO)2*6H2O + 2[Bu4N]AlH4 <--> 2[Bu4N](TsO) + Ca(AlH4)2*6H2O; Ca(AlH4)2*6H2O --> некий алюмосиликат кальция + Н2. То, что вода была во внутренней координационной сфере иона кальция, не спасает её от алюмогидридного беспредела :)
...Чудесный атом углерода в нитрогеназном центре хорошо экранирован...
-
-
Предположение появилось такое. Не так давно на этом же сайте описывали "водородную карусель" http://elementy.ru/lib/431394
Там тоже молекула имеет симметричный каркас. А "лишние" связи внутри неё гуляют по кругу с немаленькой скоростью (по идее пропорциональной температуре).
Вот и в данном случае допустим что центральный атом углерода в некотором роде быстро вертится в середине "полости" по очереди отцепляясь от каждой из трех "стоек". И чем быстрее он вертится, тем больше его энергия, которая в нужный момент может разбить случайно пролетавшую через этот самый центр нейтральную молекулу N2.
А дальше совсем уже аналогия из макромира. Понятно что не хорошо с ньютоновской механикой - да в квантовый ряд. Но вдруг на уровне молекул - еще немножко можно? ;)
Так вот есть у меня дома симпатичная такая игрушечка, кистевой тренажер PowerBall (не сочтите за рекламу!). Принцип работы такой http://ru.wikipedia.org/wiki/Гироскопический_тренажёр. Раскрученный шарик внутри другого, полого шарика. При наличии одной человеческой силы, меняющей плоскость вращения, при попадании в резонанс и наличии вязкого трения может разгоняться до неожиданно громкого жужжания (быстрее среднего ДВС).
Мне вот представилось, что при определенной упругости стоек "корзины" (а иначе зачем понадобился в основании именно редкий микроэлемент молибден?) вся система при комнатной температуре приобретает свойства PowerBall-а, раскручивая за счет случайных тепловых ударов центральный атом C до скоростей (т.е. температур) подходящих для разрыва азотной связи.
Я просто гипотезу рассказал, ни на чем не настаиваю и с удовольствием послушаю мнение биохимиков.
-
Еще один комментарий, вдогонку. Случайные тепловые удары для раскручивания скорее всего не катят. Что если существует другой белковый комплекс (тоже с "каруселью" связей) который крутит эту штуку за несимметричную верхушку? И именно в сумме образуется резонанс разгоняющий центральный атом С до необходимой скорости?
-
== обобществление электронов бывает, см. например бензольное кольцо, но там получается валентность 3 вместо 4, то есть меньше нормальной. ==
Валентность у углерода в бензоле 4. Шесть атомов углерода обобществляют свои атомные орбитали, давая результирующую шестицентровую шестиэлектронную ароматическую связывающую орбиталь (вкупе с ещё двумя - несвязывающей и разрыхляющей молекулярными орбиталями). Все связи С-С в бензоле имеют одинаковую длину и одинаковый порядок. Формально даже, наверное, нельзя сказать, что там углерод имеет sp2 гибридизацию. Строение бензола хорошо и давно описано квантовой механикой.
== допустим что центральный атом углерода в некотором роде быстро вертится в середине "полости" по очереди отцепляясь от каждой из трех "стоек". И чем быстрее он вертится, тем больше его энергия, которая в нужный момент может разбить случайно пролетавшую через этот самый центр нейтральную молекулу N2. ==
Думаю, он там не вертится, хоть и "круглый", ибо не колобок, а суть атом - объект микромира. Окружение углерода (атомы железа) заставляют принимать его экзотическую гибридизацию (я её даже правильно не назову, но это не значит, что имени у неё нет ;)), видимо, вовлекаются в это состояние слишком высоко лежащий по энергиям d орбитали углерода (которых "у него как бы нет", но институтские учебники пишут не обо всём; нужен спецкурс по такой вот элементооргание).
Молекула азота фиксируется на атоме молибдена (и, может, ещё на близлежащих железках. Конструкцию накачивают электронами и протонами - вуаля - имеем 2NH4+.
Собственно движение электронов происходит при молекулярных перестройках промежуточных переходных состояний, а в той же молекуле бензола при тихой погоде в бутылке при отсутствии реакции бензола с чем либо электроны на ароматической орбитали представляют собой стоячую волну. Тем не менее, по этому кольцу можно пустить самый настоящий ток, для этого надо подвести переменное магнитное поле - и тогда можно зафиксировать кольцевой ток в молекуле бензола.
Водородная карусель - не совсем, думается, подходящая аналогия.
PS У меня есть подозрение, что этот чудесный 6-и координированный углерод - остаток от жизни былой, когда донором протонов для восстановления N2 служил метан. В докислородную эпоху.
-
Теперь с этого монстра с живого не слезут. Выяснят, как такая штука мастерится-то!
А мы, обезьянки, посмотрим (с) советский фильм, название не помню :(
Там, в нитрогеназе (а это комплекс нескольких белков) есть ещё неорганические вставки из серы и железа. Они своими очертаниями напоминают собственно этот самый каталитический центр и служат для чего-то, связанного, с перекачкой электронов (если я правильно понял).
Последние новости