Слабое взаимодействие и хиральность биологических молекул
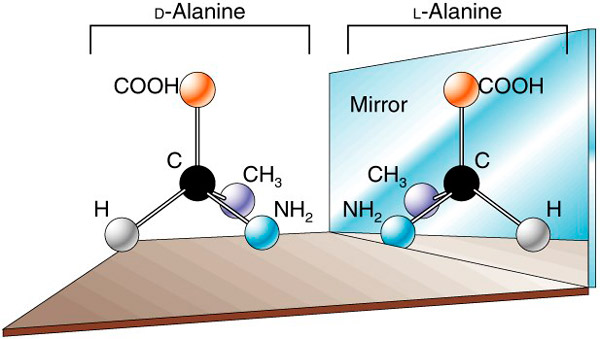
В вопросе о происхождении жизни есть, среди прочих, одна загадка, которая мучает исследователей уже полтора века: почему, за редчайшими исключениями, все биологические молекулы лево-, а не правоориентированные? Если взять не слишком симметричную молекулу, состоящую из нескольких разных атомов, то она может существовать в виде двух энантиомеров — пространственных конфигураций, отличающихся друг от друга зеркальным отражением и не переводимых друг в друга никаким поворотом (рис. 1). Казалось бы, с точки зрения химии энантиомеры совершенно равноправны — и энергии этих молекул должны быть одинаковыми, и химические реакции с их участием должны идти с одинаковой скоростью, если, конечно, все остальные молекулы тоже зеркально отражены. И действительно, в реакциях синтеза несимметричных молекул из симметричных энантиомеры возникают в виде рацемической смеси, то есть в ней поровну и тех, и других. Однако белки в живых организмах построены исключительно из аминокислот строго определенной хиральности. Как возникла такая хиральная чистота живого? Стоит ли за этим чистая случайность или же существует какая-то фундаментальная физическая причина, отдающая предпочтение одному из энантиомеров над другим?
До середины XX века считалось, что все фундаментальные физические взаимодействия не меняются при зеркальном отражении. В середине 1950-х годов ситуация резко изменилась: было понято сначала теоретически, а потом экспериментально, что одна из сил — слабое взаимодействие — очень несимметрична относительно замены правого на левое. Хоть слабое взаимодействие действует только на масштабах ядра и отдельных элементарных частиц, оно может аукнуться и на свойствах атомов и молекул. В результате энергия лево- и правоориентированных молекул будет слегка отличаться, что могло бы в конечном итоге дать преимущество одному из энантиомеров.
В этой задаче мы попытаемся оценить хотя бы в некотором приближении разницу энергий, вызванную слабым взаимодействием. В тонкости описания слабого взаимодействия мы, конечно, влезать не будем, а сформулируем набор очень простых «рабочих правил» и будем их придерживаться.
Прежде всего, неравноправие между правыми и левыми молекулами возникает потому, что в каждом атоме между электроном и ядром действует не только электрическое притяжение, но и дополнительная сила, возникающая из-за слабого взаимодействия. Эту дополнительную силу мы будем описывать с помощью потенциальной энергии
![]() .
.
Здесь r — расстояние между электроном и ядром, q1, q2 — их электрические заряды, rw — это константа, характеризующая радиус действия слабого взаимодействия и равная примерно 10−18 м. Эта потенциальная энергия напоминает обычное электростатическое притяжение между электроном и атомным ядром
![]()
и отличается от него только лишним экспоненциальным множителем. Еще раз подчеркнем, что это приближение очень грубое, в нем мы опустили многие зависимости и оставили только самую основную — очень маленький радиус действия слабого взаимодействия. Наконец, последнее правило такое: мы считаем, что зеркально отраженные молекулы отличаются только тем, что в левых молекулах полная потенциальная энергия в каждом атоме записывается как V + Vw, а в правых — как V − Vw. Таким образом, разница между энергиями этих молекул возникает только из-за добавочной потенциальной энергии.
Задача
Опираясь на этот набор правил, оцените по порядку величины разницу энергий правых и левых молекул.
Подсказка
Формула для потенциальной энергии — будь то обычное электрическое притяжение или дополнительная сила — это именно формула, а не ответ, поскольку это выражение зависит от r — расстояния между ядром и электроном. Чтобы получить из нее ответ (хотя бы по порядку величины), требуется правильно оценить типичные расстояния, характеризующие электроны в атоме, и подставить их в формулу. (Чуть более аккуратная формулировка: мы должны сосчитать среднее значение этой энергии в определенном электронном состоянии.)
Представьте себе, как выглядит типичное электронное облако, нарисуйте график дополнительной потенциальной энергии и попробуйте оценить ее усредненное значение в этом электронном облаке. Подставьте затем известные размеры атомов и радиуса слабого взаимодействия и оцените относительную добавку к энергии электрона в атоме. Для простоты можно считать, что заряд ядра небольшой.
Решение
Основное состояние электрона в атоме представляет собой более-менее однородное облачко с размером порядка a ≈ 10−10 м. Поэтому при оценке средней потенциальной энергии электростатического взаимодействия достаточно подставить r ≈ a. Энергия при этом получится E ≈ q1q2 /a, и это и есть типичная энергия электрона в атоме.
Для оценки дополнительной энергии, вызванной слабым взаимодействием, обратите внимание на сильную разницу масштабов rw и a. Если в формулу для Vw подставить r = a, то экспоненциальный множитель станет безумно маленьким, e−100 000 000, то есть ни в каких экспериментах его нельзя будет отличить от нуля. Экспоненциальный множитель e−r/rw заметно отличен от нуля только на расстояниях порядка r ~ rw ≪ a. Иными словами на масштабах порядка атомных размеров новая сила фактически отсутствует.
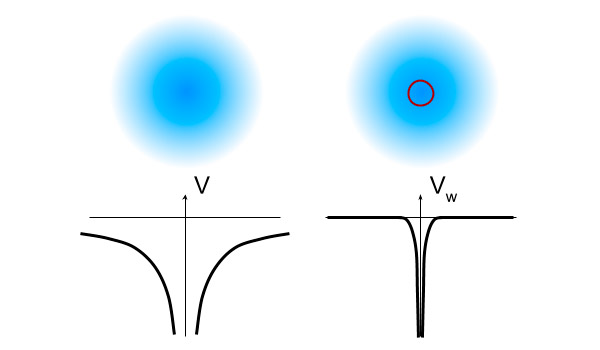
Рис. 2. Графики потенциальной энергии электростатического притяжения (слева) и дополнительной силы, вызванной слабым взаимодействием (справа). Над каждым графиком схематично изображено электронное облако; дополнительную силу чувствует только очень маленькая доля электронного облака, отмеченная кружочком
Однако это не значит, что она отсутствует вообще. Электрон — это размазанное облако, и какая-то очень небольшая часть его находится очень близко к ядру, в том числе и на расстояниях порядка rw (см. рис. 2). Для s-электронов эту долю можно оценить просто по объему: rw3 против объема самого атома a3. Слабое взаимодействие на таких близких расстояниях усиливается примерно до q1q2 /rw, однако вероятность найти электрон так близко очень мала: (rw /a)3. Поэтому общий эффект этой новой силы окажется во столько же раз слабее: ΔE ≈ q1q2 rw2/a3.
Для того чтобы получить некоторое число, запишем относительное значение этой энергии: ΔE/E = (rw /a)2 = 10−16. Типичные энергии электронных уровней составляют электронвольты, поэтому само значение ΔE лежит в районе 10−16 эВ, что, конечно, совершенно мизерная величина. В рамках наших упрощенных «рабочих правил» ΔE, увеличенная в несколько раз, и будет разницей энергий правой и левой молекул.
Послесловие
Наша модель расщепления молекулярных уровней из-за слабого взаимодействия, конечно, очень примитивна. Мы не учли разницу между слабым и электрическим зарядом ядра, зависимость слабого взаимодействия от числа протонов и нейтронов, не пояснили, как силы внутри атомов влияют на свойства правых и левых молекул и откуда взялось число rw ≈ 10−18 м. Всё это требует как минимум изучения основ квантовой механики. Однако одна ключевая мысль была проиллюстрирована: слабое взаимодействие может влиять на свойства атомов и молекул за счет очень близкого, практически контактного взаимодействия между электроном и ядром. Из-за того что оно короткодействующее, вызванные им энергетические сдвиги получаются на много порядков меньше электростатической энергии.
Для справки скажем, что реальные вычисления того, как слабое взаимодействие влияет на свойства атомов и молекул, заметно отличаются от нашей оценки. Во-первых, дополнительная сила очень резко зависит от заряда ядра. Внутри отдельных атомов эффекты слабого взаимодействия (например, смешивание уровней энергии с разной симметрией) могут достигать значений порядка 10−10 от самих энергий. Во-вторых, в молекулярных явлениях, по сравнению с атомными, эти эффекты еще более ослаблены, и им даже не слишком помогает усиление от большого заряда ядра. Реалистичные расчеты показывают, что типичное расщепление между настоящими правыми и левыми молекулами составляет порядка 10−18 эВ и меньше. Тем не менее эти эффекты были обнаружены экспериментально: в 1978 году для отдельных атомов, в 1999 году для молекул-энантиомеров.
Вооружившись этими числами, вернемся к исходному вопросу: так может ли слабое взаимодействие быть причиной того, что жизнь основывается исключительно на левых аминокислотах? На первый взгляд, это кажется совершенно неправдоподобным. Конечно, в тепловом равновесии всегда есть некоторое преимущество состояний с более низкой энергией, так как число частиц с энергией E обычно пропорционально e−E/kT. Однако для комнатной температуры значение kT = 0,026 эВ, поэтому при разнице энергий в 10−18 эВ левые молекулы будут преобладать над правыми в среднем в одном случае из десятка квадриллионов. Такое отличие совершенно потеряется на фоне обычных флуктуаций числа частиц. Чтобы оно стало заметно, нужно синтезировать как минимум 1032 молекул, то есть многие тысячи тонн вещества.
Однако более тщательное изучение показывает, что даже мизерное преобладание одного энантиомера над другим может постепенно накапливаться, если в большом объеме в течение долгого времени идут непрерывные реакции с участием хиральных молекул. Тогда уже кажется правдоподобным, что рано или поздно одна из пространственных ориентаций возьмет верх над другой, а затем и вовсе ее вытеснит. Теоретические оценки показывают, что для этого может хватить и десятков тысяч лет. Однако между «может хватить» и «реально происходит» — большая дистанция. Кроме того, остается вопрос, в самом ли деле наблюдаемая хиральная чистота аминокислот в земной жизни была вызвана именно этой причиной — ведь существуют и другие возможности. Вот этот вопрос пока что не поддается ответу, несмотря на всю его притягательность и несмотря на множество экспериментальных и теоретических исследований. Обзор ситуации по состоянию на 2008 год можно найти в книжке The Origin of Chirality in the Molecules of Life. Таким образом, предположение о роли слабого взаимодействия в гомохиральности живого остается очень интересной, но всё же пока гипотетической возможностью.
-
Слабое взаимодействие является причиной бета-распада. Наверное, можно оценить насколько быстрее распадаются одни ядра по сравнению с другими?
Вообще, выглядит логичным, что жизнь зародилась локально. В каком-то месте собрались нужные вещества и в реакцию вступила одна молекула, которая оказалась левоспиральной (именно вокруг неё сложились болкк подходящие для реакции условия). Так что разность энергий тут может быть и не причём.
Последние задачи













Рис. 1. Несимметричные молекулы с разными атомами, как, например, изображенная здесь аминокислота аланин, могут существовать в двух пространственных конфигурациях, являющихся зеркальным отражением друг друга (два энантиомера). Все действующие в них атомные силы одинаковы, за исключением слабого взаимодействия, которое и приводит к небольшому различию энергий энантиомеров относительно друг друга. Было бы очень заманчиво объяснить этим тот факт, что биологические молекулы построены на энантиомерах одного сорта. Изображение с сайта worldofbiochemistry.blogspot.com