Разработаны пептидные ингибиторы вируса гриппа
Международная группа исследователей из США, Бельгии и Нидерландов разработала искусственные пептиды, способные нейтрализовать широкий спектр вирусов гриппа, включая штамм H1N1, вызвавший пандемию 2009 года, и штамм высокопатогенного птичьего гриппа H5N1. Эти пептиды могут стать новым оружием в борьбе человечества с гриппом, только сезонные эпидемии которого, по оценкам Всемирной организации здравоохранения, ежегодно приводят к 3–5 миллионам случаев тяжелой болезни и госпитализации и 250 000–500 000 случаев смерти во всем мире.
Существующие в настоящее время способы лекарственной терапии гриппа основаны на воздействии на два белка вируса — канал M2 и нейраминидазу (NA). Оба эти белка важны для нормальной организации жизненного цикла вируса. Белковый канал M2 бывает задействован на ранней и поздней стадиях репликации вируса, а нейраминидаза участвует в высвобождении дочернего поколения вирионов. Но мутации вирусов гриппа приводят (и уже привели) к появлению резистентных штаммов, против которых существующие противовирусные препараты (даже самый эффективный из существующих на настоящий момент — осельтамивир) оказываются малоэффективными. Эти обстоятельства приводят к необходимости разработки новых способов борьбы с вирусами гриппа. Предполагается, что более эффективными могут оказаться стратегии, опирающиеся на применение препаратов, молекулярной мишенью которых будут белки-гемагглютинины (НА) вируса гриппа.
Гемагглютинины — поверхностные белки вируса гриппа, обеспечивающие способность вируса присоединяться к инфицируемой клетке. Возможно, неспособность вируса внедриться в клетку-хозяина снизит вероятность образования устойчивых к противовирусным препаратам мутирующих вирусов: вирусы способны размножаться, только паразитируя в клетках, и не попавший в живую клетку вирус будет лишен возможности воспроизводить себя.
Инфицирование вирусом гриппа начинается с того, что гемагглютинины вируса связываются с поверхностью клетки-хозяина. Вирусный гемагглютинин представляет собой гликопротеид (сложный белок, в котором с цепью, состоящей из аминокислотных остатков, связан углеводный фрагмент). После контакта с клеткой гемагглютинин изменяет свое пространственное строение, фактически внедряясь в клеточную мембрану, что, в свою очередь, обеспечивает проникновение вируса внутрь клетки, где он и начинает свой цикл размножения
В начале 2010-х годов при изучении чрезвычайно патогенного штамма вируса гриппа H1N1, вызвавшего пандемию 2009 года, были выделены и изучены белковые антитела человека, способные нарушать функции вирусного гемагглютинина, которые получили обозначения FI6v3 (D. Corti et al., 2011. A Neutralizing Antibody Selected from Plasma Cells That Binds to Group 1 and Group 2 Influenza A Hemagglutinins) и CR9114 (C. Dreyfus et al., 2012. Highly Conserved Protective Epitopes on Influenza B Viruses). Полученная в ходе исследований свойств этих антител информация об их связывании с гемагглютинином позволила биохимикам спроектировать структуру синтетических пептидов, которые, как предполагалось, должны поражать те же самые молекулярные мишени на структуре этого белка, ингибируя при этом размножение вируса. Нужно отметить, что проектирование пептидов — это чуть ли не самая важная и сложная часть работы. Дело в том, что, хотя ученые и имели образцы для подражания в виде человеческих антител, они не могли просто скопировать нужные их фрагменты: функционирование сложных белков во многом определяется их третичной структурой и даже небольшое изменение в составе аминокислотных остатков может привести к тому, что белок изменит свою форму и станет неэффективным. Что уж говорить о том, чтобы «с нуля» спроектировать короткие пептиды, которые повторяли бы форму и часть функций этих белков.
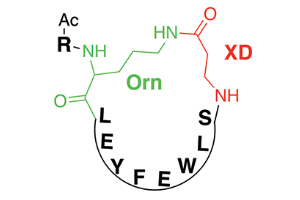
Рис. 2. Общий мотив строения синтезированных циклических пептидов. Цепь пептида состоит из протеиногенных аминокислот — лейцин (L), глутаминовая кислота (Е), тирозин (Y), фенилаланин (F), триптофан (W), серин (S), а также аминокислоты, не входящие в состав белковых молекул: орнитин (диаминовалениановая кислота, Orn) и β-аланин (XD), R — алкильный остаток. Черным цветом обозначена цепь, состоящая из протеиногенных аминокислот, зеленым и красным — участки цепи синтезированного циклического пептида, не характерные для обычных пептидных цепей. С гемагглютинином вируса гриппа циклический пептид связывается преимущественно за счет остатка фенилаланина. Рисунок из обсуждаемой статьи в Science
Ряд спроектированных структур был синтезирован, и после определения их пространственного строения и испытаний на предмет связывания с вирусами исследователи остановились на четырех циклических (обладающих замкнутой цепью, рис. 2) пептидах, каждый из которых обладает свойствами, которые позволяют говорить о его потенциальном применении в качестве блокаторов функций вирусов. Выбранная четверка пептидов демонстрирует прочное связывание с гемагглютининами широкого набора штаммов вирусов гриппа типа А. Синтетические пептиды, как и антитела человека, по образу и подобию которых они были созданы, связываются с остатком аминокислоты триптофана в структуре гемагглютинина вируса. Примечательно, что структура участка, на котором расположен этот триптофановый фрагмент практически не различается для разных штаммов гриппа, поскольку именно этот участок играет ключевую роль в проникновении вируса через оболочку клетки-хозяина.
Все эти эксперименты проводились «в пробирке»: ученые наблюдали за культурами клеток человека в отсутствие пептидов и при их добавлении. Пептиды показали способность блокировать инфицирующую способность наиболее распространенных штаммов вирусов гриппа группы А, включая H5N1 — вирус высокопатогенного птичьего гриппа и H1N1 — штамм гриппа, вызвавший пандемию 2009–10 годов.
Основное преимущество разработанных в ходе исследования пептидов по сравнению со ставшими для них образом и подобием антителами заключается в гораздо меньших размерах. Это обеспечивает и дешевизну их получения по сравнению с антителами, и сделает более эффективной усвояемость лекарства при пероральном и инъекционном приеме. Чтобы синтезированные пептиды были устойчивы к действию ферментов, способных ускорять гидролитическое расщепление веществ с аналогичной структурой в крови, в них были введены остатки β-аланина и диаминовалериановой кислоты (орнитина) — аминокислот, не кодируемых в ходе синтеза белковых цепей на рибосоме. Циклическая структура синтезированных пептидов, отсутствие у них характерных для линейных и разветвленных белковых молекул C- и N-конца также способствует устойчивости к гидролизу.
Эксперименты показали, что как минимум один из новых пептидов не разрушается в плазме крови мыши или человека в течение нескольких часов. Это позволяет говорить о том, что устойчивость новых пептидов сравнима с устойчивостью лекарственных препаратов. А это необходимо для проведения дальнейших испытаний новых препаратов уже не «в пробирке», а на лабораторных животных.
Источник: Rameshwar U. Kadam, Jarek Juraszek, Boerries Brandenburg, Christophe Buyck, Wim B. G. Schepens, Bart Kesteleyn, Bart Stoops, Rob Vreeken, Jan Vermond, Wouter Goutier, Chan Tang, Ronald Vogels, Robert H. E. Friesen, Jaap Goudsmit, Maria J. P. van Dongen, Ian A. Wilson. Potent peptidic fusion inhibitors of influenza virus // Science. 2017. DOI: 10.1126/science.aan0516.
Аркадий Курамшин
-
== Эксперименты показали, что как минимум один из новых пептидов не разрушается в плазме крови мыши или человека в течение нескольких часов. ==
Напоминает по форме заявления дипломатов... Что значит эта формулировка в переводе на наш, на рабоче-крестьянский? Что в максимуме? Что в середине?
Ещё один вопрос есть. Что из себя представляет R?-
R может быть всяко разно. У наиболее успешно действующего циклического пептида - так вообще бензильны радикал.
Насчет максимума и середины - тяжело делать выводы, поскольку товарищи приводят в статье результаты по устойчивости в плазме при 37 градусах лишь для одного своего продукта - или они очень торопились с публикацией и не успели проверить остальные или там что-то пошло не так (тм).
Тот, который изучен, они пишут, живет в плазме и мышиной и человеческой крови 4 часа, но,поскольку на картинке в статье никакой особой тенденции к уменьшению концентрации вещества в плазме крови после 250 минут нет, возможно, живет и большее. Всё же скорее они второпях делали этот анализ (может быть даже в рамках дополнения материала по рекомендации ревьюера, и раздел In vitro stability and in vivo pharmacokinetic profiling сильно отличается от всей остальной статьи (не в сторону большей информативности)
== Эксперименты показали, что как минимум один из новых пептидов не разрушается в плазме крови мыши или человека в течение нескольких часов. ==
Напоминает по форме заявления дипломатов... Что значит эта формулировка в переводе на наш, на рабоче-крестьянский? Что в максимуме? Что в середине?
Ещё один вопрос есть. Что из себя представляет R?
PS Иногда сажают метильную группу на тот или иной амидный азот - это тоже повышает сопротивляемость к гидролизу. Но это можно только если такой метил не мешает связыванию. (Не обязательно что берут именно метил, может быть и другая группа, it depends.)
-
Ваше мнение о неопасности гриппа - следствие целенаправленного сокрытия статистики. От гриппа и его прямых последствий людей гибнет больше, чем в ДТП. К сожалению, в век провозглашенной информатизации последствия главных опасностей скрываются. Так, число жертв вооруженных конфликтов можно оценить лишь по порядку величины. Стороны конфликта перевирают данные в десятки раз, каждый в свою сторону. То же и с гриппом или, скажем, СПИДом. В США с их обамакерой смертность от гриппа около 20-35 тысяч в год. У нас, с нашей разваленной собственно медициной и боязнью работников выходить на больничные, недолеченностью, что особенно опасно при гриппе, чиновники от здравоохранения называют мизерные цифры.
Последние новости












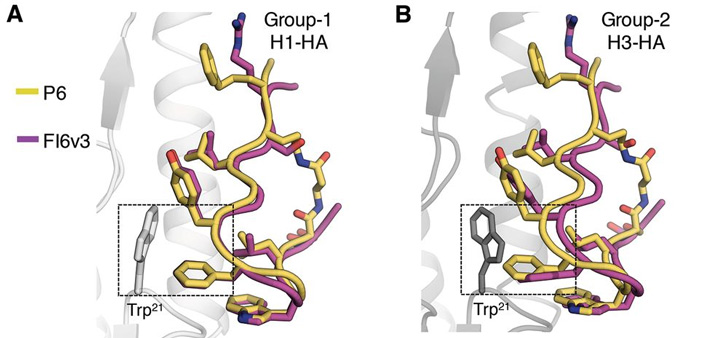
Рис. 1. Сравнение взаимодействия ранее изученного антитела человека FI6v3 и разработанного пептида с частицами вирусов гриппа. Совмещение молекул демонстрирует сходство и различия в том, как антитело (лиловое) и синтезированный пептид (желтый) связываются с гемагглютининовым рецептором вирусов H1 (А) и H3 (B). Оба типа рецепторов, характерные для различных штаммов вируса, связываются с антителом и синтетическим пептидом за счет остатка аминокислоты триптофана (Trp21), положение которого в первичной структуре геммагглютининов Н1 и Н3 одинаково. Рисунок из обсуждаемой статьи в Science