Дарвиновская эволюция без участия генов
Прионы — инфекционные агенты белковой природы, вызывающие смертельные заболевания у животных и человека. Прионы представляют собой неправильно свернутые молекулы прионного белка PrP, способные «размножаться», превращая нормальные молекулы PrP в подобие самих себя. Оказалось, что у прионов есть нечто похожее на наследственную изменчивость, что позволяет им эволюционировать под действием естественного отбора. Они могут приспосабливаться к разным типам клеток и даже вырабатывать устойчивость к лекарствам.
Земная жизнь основана на размножении репликаторов определенного типа — полинуклеотидов РНК и ДНК. Но это далеко не единственный тип репликаторов, который в принципе может существовать в природе. Многие философы и социологи считают, что в культурной эволюции большую роль играют мемы — единицы культурной информации, которые используют человеческий разум для собственного выживания и размножения примерно так же, как гены используют клетку. Предполагается (хотя и не доказано окончательно), что мемы, как и гены, обладают двумя ключевыми свойствами, необходимыми для «дарвиновской» эволюции. Первое из них — способность мутировать и передавать мутации по наследству («наследственная изменчивость»). Второе — способность возникающих мутаций влиять на эффективность размножения репликатора («дифференциальное размножение»). Если репликатор обладает двумя этими свойствами, он автоматически начинает эволюционировать, приспосабливаясь к среде своего обитания. Сочетание наследственной изменчивости с дифференциальным размножением называют «естественным отбором».
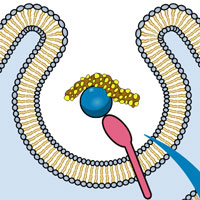
Прионы — «нестандартные» биологические репликаторы, представляющие собой особым образом свернутые молекулы прионного белка PrP. Этот белок в норме присутствует на мембранах нейронов и выполняет какие-то полезные функции, связанные с передачей сигналов. Какие именно — пока еще не совсем ясно (Chiesa R., Harris D.A., 2009. Fishing for Prion Protein Function // PLoS Biol 7(3): e1000075). Безобидный прионный белок превращается в смертоносный прион в результате «неправильного сворачивания» (см. рисунок).
Прион обладает двумя удивительными свойствами. Во-первых, он заставляет нормальные прионные белки сворачиваться неправильно, превращая их в свои копии. Так прион «размножается». Во-вторых, он устойчив к действию протеолитических ферментов, задача которых состоит в уничтожении отслуживших белковых молекул. По-видимому, оба свойства связаны со способностью прионов слипаться в большие комки из множества молекул. Первые несколько слипшихся прионов становятся «центром кристаллизации», к которому затем прилипают всё новые и новые молекулы. В конце концов это приводит к нарушению работы нервной клетки.
Самое неприятное, что нейрон, в котором «завелись» прионы, заражает ими соседние нейроны, и в результате прионная инфекция распространяется по нервной системе. Способность к размножению, устойчивость к протеолитическим ферментам и заразность делают прионы опасными инфекционными агентами, похожими по своим свойствам на вирусы. Как и вирусы, прионы могут размножаться только за счет ресурсов, предоставляемых хозяйской клеткой. Вирусу необходимо, чтобы клетка синтезировала для него вирусные белки согласно инструкциям, записанным в вирусной ДНК или РНК. Приону необходимо, чтобы клетка синтезировала для него нормальные молекулы прионного белка, а прион уже сам превращает их в свои копии. Разница между вирусом и прионом весьма существенна для молекулярного биолога, но совсем не так заметна для эпидемиолога или, тем более, заболевшего животного. Прионы вызывают ряд смертельных нейродегенеративных заболеваний у человека и других млекопитающих, в том числе коровье бешенство и куру.
То, что прионы являются самыми настоящими репликаторами, сомнений не вызывает. Но до сих пор было неясно, есть ли у них весь необходимый «джентльменский набор» для дарвиновской эволюции. Способны ли прионы мутировать и передавать мутации по наследству, и если да, то могут ли эти мутации влиять на эффективность размножения прионов? Иными словами, действует ли на прионы естественный отбор? Способны ли они приспосабливаться к меняющимся условиям — например, к лекарственным препаратам, предназначенным для борьбы с прионными инфекциями?
Статья американских ученых, опубликованная в последнем номере журнала Science, позволяет ответить на эти вопросы положительно.
Ранее было замечено, что встречаются разные «штаммы» (разновидности) прионов, которые могут развиваться в нейронах одного и того же вида животных или в одной и той же клеточной культуре. Например, у мышей из одной и той же лабораторной линии, имеющих одинаковые прионные белки PrP, может встречаться 15 или даже более разных прионных инфекций, различающихся по скорости развития болезни и неврологическим симптомам. Было также замечено, что если взять штамм прионов у одного вида животных, заразить им другой вид, а потом взять прионы у второго вида и снова заразить ими первый, то симптомы в некоторых случаях оказываются уже другими.
Это позволило предположить, что у белка PrP есть несколько разных вариантов неправильного сворачивания и превращения в прион, причем каждый из вариантов устойчиво наследуется, то есть сохраняется в ряду «поколений» прионов. Возможно, прионы могут «мутировать» и передавать свои мутации по наследству. Мутации прионов, очевидно, не связаны с изменениями аминокислотной последовательности белка, а представляют собой изменения вторичной или третичной структуры (то есть способа сворачивания) белковой молекулы.
Чтобы проверить эти предположения, авторы провели множество экспериментов с разными штаммами прионов и разными клеточными культурами. Они обнаружили, что свойства прионов закономерным образом меняются, когда их пересаживают из одних клеток в другие, причем изменения происходят не сразу, а постепенно.
Для начала авторы заразили клеточную культуру PK1 прионами штамма 22L из мозга больной мыши. Оказалось, что чем дольше прионы живут и размножаются в клетках PK1, тем сильнее они отличаются по своим свойствам от исходных, «диких» прионов из мозга мыши. Исходные прионы 22L успешно заражают другую клеточную культуру, использовавшуюся в экспериментах (R33). Кроме того, эти прионы нечувствительны к действию вещества SWA (swainsonine). Авторы ранее установили, что SWA замедляет размножение некоторых разновидностей прионов в некоторых клеточных культурах. Однако по мере жизни прионов в клетках PK1 они постепенно утрачивали способность инфицировать клетки R33 и становились всё более чувствительными к SWA.
По-видимому, это означает, что популяция прионов в мозге больной мыши исходно была гетерогенной (разнородной), и в ней преобладали прионы, устойчивые к SWA и заразные по отношению к R33. Однако жизнь в клетках PK1 приводит к тому, что в популяции постепенно растет доля прионов, чувствительных к SWA и не способных заражать R33. Можно предположить, что прионы с этими свойствами быстрее размножаются в клетках PK1, то есть налицо эволюция под действием естественного отбора (если пользоваться «минималистским» определением, согласно которому эволюция — это изменение численного соотношения наследственных вариантов в популяции).
Способны ли прионы восстанавливать утраченную устойчивость к лекарственному препарату? Чтобы выяснить это, авторы пересаживали прионы, чувствительные к SWA, из клеток PK1 в мозг мышей. К тому времени, когда заболевание у зараженных мышей достигло терминальной стадии (через 147 дней после заражения), прионы полностью восстановили устойчивость к SWA.
Еще более наглядные результаты были получены в экспериментах с клеточными культурами, в которых «жили» прионы, чувствительные к SWA. Оказалось, что если выращивать зараженные клетки в присутствии небольших концентраций SWA, то прионы довольно быстро вырабатывают устойчивость к этому препарату. Таким образом, эти необычные репликаторы приспосабливаются к меняющимся условиям совсем как какие-нибудь вирусы или бактерии.
Выработка устойчивости в этих экспериментах могла происходить либо за счет преимущественного размножения устойчивых разновидностей прионов, которые уже существовали в исходной популяции (хоть и в малом количестве), либо за счет появления новых мутаций в ходе эксперимента. При помощи очень сложных дополнительных опытов авторы показали, что прионы-мутанты, устойчивые к SWA, спонтанно возникают в популяции, на 100% состоящей из неустойчивых прионов, даже в отсутствии SWA, то есть когда в такой мутации нет необходимости. Частота таких мутаций — примерно один случай на миллион клеточных делений.
Таким образом, прионы мутируют, передают мутации по наследству, и эти мутации влияют на эффективность размножения прионов в разных условиях. Иными словами, у прионов есть всё необходимое, чтобы эволюционировать под действием естественного отбора. Правда, пока не ясно, как далеко может зайти такая эволюция. По идее, у прионов должно быть гораздо меньше эволюционных возможностей, чем у тех же вирусов, потому что число возможных пространственных конфигураций белка PrP вряд ли может сравниться с невообразимо громадным числом возможных последовательностей нуклеотидов в геноме. Не ясно также, может ли естественный отбор у прионов быть «накопительным», то есть создавать новые свойства путем последовательного закрепления множества небольших наследственных изменений. Скорее, отбор у прионов всё-таки «одноразовый», работающий с единичными мутациями, причем набор возможных мутаций невелик.
Авторы исследовали эволюцию только двух «фенотипических признаков» прионов — устойчивости к SWA и способности заражать клетки R33. Не исключено, что естественный полиморфизм у прионов затрагивает также и многие другие их свойства, влияющие на эффективность размножения прионов в разных условиях. В этом случае реальная частота мутирования прионов может быть существенно выше. Возможно, к популяциям прионов приложимо даже понятие «квазивид», которое до сих пор применяли только к вирусам (см.: Вирусы-мутанты помогают друг другу в борьбе за выживание, «Элементы», 14.12.2005).
Авторы отмечают, что обнаруженная у прионов способность к «дарвиновской» эволюции хорошо объясняет некоторые странные особенности прионных инфекций, которые ранее не имели четкого объяснения. Например, было замечено, что при переходе инфекции от одного вида животных к другому сначала, как правило, наблюдается очень медленное развитие болезни и низкая инфекционность. Но уже после нескольких циклов внутривидового перезаражения прион становится более заразным, и болезнь развивается стремительнее. Очевидно, это объясняется тем, что прионам требуется время, чтобы приспособиться к новому хозяину.
Данная работа показала, что при разработке лекарств от прионных болезней лучше бороться не с конкретными штаммами прионов — к таким лекарствам прионы могут приспособиться, — а пытаться повысить устойчивость пространственной конфигурации нормального прионного белка, чтобы он всегда сворачивался правильно. Самым радикальным средством борьбы с этими болезнями является полное отключение гена, кодирующего белок PrP. Правда, пока не ясно, к каким побочным последствиям это может привести. Мыши с отключенным геном прионного белка выживают и даже не имеют каких-то особо тяжелых дефектов, но у них наблюдается множество мелких странностей: от нарушенного суточного ритма до склонности к ишемии и судорогам.
Источник: Jiali Li et al. Darwinian Evolution of Prions in Cell Culture // Science. 2010. V. 327. P. 869–872.
-
Как известно, прионы есть и у дрожжей, у которых нет нейронов. Прионы, вероятно, могут образоваться практически из любого белка с нарушенной третичной структурой и не разрушающегося с помощью специфических протеаз - убиквитинов. Не являясь специалистом в области прионов, тем не менее, читала, что в ЦИНе (СПб) получены прионы (у дрожжей), из белков-ферментов основного углеводного обмена в результате мутации по убиквитинам. Прионы размножаются с помощью фермента протеинсинтетазы, использующей прион как матрицу в зеркальном синтезе. Что касается мемов, то непонятно, зачем они в данном сообщении? Белковые рецепторы нейронов в синапсах образуют кластеры, что является основой проведения возбуждения с помощью нейромедиаторов. Зачем мемы для памяти - основы формирования понятий и сознания?
-
Про мемы ИМХО автор хотел показать, что автокаталитические реакции очень разноообразны и существуют в самых неожиданных категориях объектов. Это и размножение материальных объектов: живых организмов и вирусов, и неметериальных: компьютерных вирусов и мемов в сознании. Ещё стоит добавить реакцию Бутлерова - она чертовски простая, там сахар размножается на растворе формальдегида; реакцию Бутлерова некоторые люди считают первоосновой зарождения жизни (добиологический этап эволюции). Во всех этих реакциях чисто теоретически возможна эволюция (развитие).
-
Автокаталитические химические реакции конечно разнообразны. Но эволю-ция - передача генетической информации в ряду многих поколений. Автор имел в виду, насколько я поняла, с помощью мемов обосновать вертикаль-ную и горизонтальную передачу интеллектуальной информации. По М. Е. Лобашову - сигнальной наследственности. Кстати, наш выдающийся ученый М.Е.Лобашев был первым, высказавшима идею вертикального переноса интеллектуальной информации. Однако материальная основа этого мало изучена и мемы тут не помагают, пока. Может быть в дальнейшем. Тут стык нескольких когнитивных наук. Кстати, компьютерные вирусы вполне материальны.
-
-
-
" Прионы размножаются с помощью фермента протеинсинтетазы, использующей прион как матрицу в зеркальном синтезе."
А с этого места поподробнее. Вы действительно такое читали?-
Ключевые слова в англоязычном Интеренете "non-ribosomal protein synthesis". Нерибосомальный синтез белка. Это давно известно для белковых токсинов нитчатых грибов. Например, для белкового циклического пептида тентоксина у Alternaria spp. Скорее всего, это тупик эволюции.
-
Спасибо, очень интересно.
Но там идёт речь о нерибосомальных олигопептидах, таких как элемент пептидогликанов некоторых бактерий. А Вы говорите фактически о матричном безрибосомном синтезе. Вот такого я не слышал, хотя прионами интересуюсь. Есть ли более точная ссылка?-
В молекулярной биологии эйфория по поводу прионов, т.к. они 1) отвер-гают 'центральную догму', т.е., что информация движется только от ге-на к белку. 2) отвергают то, что первичная структура белков опреде-ляет их четвертичную структуру (Bussard, 2003). 3) подтверждают тео-рию Ламарка о том, что окружающая среда запускает адаптивные структур-ные и физиологические изменения в организме. (True & Lindquist, 2000) показали, что супрессор кодона терминатора трансляции - sup35 - пере-ключается в прионное состояние [PS1+], когда условия окружающей среды для дрожжей ухудшаются, что заставляет рибосомы синтезировать белок дальше нонсенс кодонов. Это способствует экспрессии ранее молчащих генов и генных вариантов и создает новые фенотипы. [PS1+] передается дочерним клеткам, в которых он самореплицируется, изменяя конформацию нормального sup35 белка, пока не появится новый фенотип, лучше адаптированный к новым условиям. Т.е. прионы неменделевские генетические элементы, играющие важную эволю-ционную роль, давая новые фенотипы. Далее (Li & Lindquist, 2000) показали общность этого механизма контроля активности белков, слиянием прионного домена дрожжей с белком крысы.
На основе работ Eric Kandel по молекулярной основе долговременной памяти у Aplysia считается, что прионы участвуют в долговременной памяти. Они изучали как нейроны поддерживают связанный с обучением рост и стабильность синапсов и нашли, что белок цитоплазматического полиаденилирования (СРЕВ), активирующий покоящиеся иРНК через удлинение их поли(А) хвостов, усиливает долговременную стабильность си-напсов. Нейронная изоформа СРЕВ имеет сходство с прионоподобными белками (Si et al, 2003). Она существует в двух функционально различных и стабильных формах и способна самопревращаться в доминантный эпигенетический признак, находясь в состоянии приона. СРЕВ активна в этом состоянии и способна активировать покоющуюся мРНК (Bailey et al, 2004). Недавний обзор в Nature (Krishnan & Lindquist, 2005) по структуре прионов дрожжей и их существовании как 'только белковых' наследуемых элементов подтверждает неменделевский механизм наследования, что может оказать огромное влияние на биологию.
Все это конечно замечательно, но все же прионы передаются инфекционным путем, а не через половые клетки. Прионы - пока это инфекция. Но может быть грядет революция.
Что касается нерибосомного синтеза пептидов, то конечно он меркнет перед прионами. Тем не менее, огромный и разнообразный класс пептидов микрорганизмов синтезируется без рибосом на матрице предшествующего пептида. Хотя сам фермент специфичен, естественно, контролируется генетически, но позволяет существование разнообразных физиологически активных пептидов, что тоже может служить материалом для эволюции.
-
-
-
Рекомендую вот эту посмотреть, свежачок, в февральском Cell: Aplysia CPEB Can Form Prion-like Multimers in Sensory Neurons that
Contribute to Long-Term Facilitation.
Память построена на прионном переходе белка СРЕВ. Думаю, в десятку года эта работа точно попадет.
-
Пардон, поторопился. Рекомендованная мною статья Kandel хороша только на первый взгляд. При тщательном прочтении создается обратное впечатление: прионы там не очень-то при чем, прионоподобная структура, в лучшем случае, играет вспомогательную роль. Удивительный промах для столь солидного автора и солидного журнала. Также, это обесценивает предыдущие статьи этого втора, которые цитирует Bomg.
-
Тем не менее, статья очень надёжно связывает прионообразный белок с возможным механизмом памяти - долговременной синаптической потенциацией. В связи с неясностью физиологической функции нормального предшественника инфекционного белка, это может быть прорывом в совсем другую сторону - понимания сути памяти.
Кстати, спасибо за интересную ссылку.-
Ключевая роль белка СРЕВ в запоминании опубликована в 2003 (Si et al. - 2 статьи в Cell). СРЕВ специфически контролирует экспрессию белков на уровне трансляции, и тем определяет свойства синапсов. В дрожжевой модели прионная форма была более функциональна, чем неприонная (там же). Однако красивая гипотеза о переключении синапса через прионное превращение скорее провалена, чем подтверждена последней статьей.
-
-
Последние новости