Прокариотическая система иммунитета поможет редактировать геном
Хотя прокариоты — это одни из самых просто организованных существ на Земле (проще устроены только вирусы), их устройство поражает своим изяществом и совершенством. Например, недавно в научном мире буквально совершило переворот открытие прокариотических CRISPR-систем, которые обеспечивают приобретенный иммунитет к вирусам и плазмидам. О работе этих систем и о том, что их изучение может дать человечеству, рассказал в своей лекции на проходящей при поддержке РВК, Фонда «Династия» и РФФИ Зимней школе FutureBiotech доктор биологических наук Константин Викторович Северинов.
Загадочные участки генома
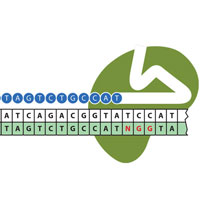
В конце 1980-х годов в ходе первых попыток секвенирования генома кишечной палочки японские исследователи обнаружили нечто удивительное — участки ДНК, содержащие множественные идентичные повторы, разделенные неидентичными, уникальными участками — спейсерами (рис. 1, 2). Подобные участки стали обнаруживать и в других прокариотах. После череды промежуточных имен их в конце концов назвали CRISPR — Clustered Regularly Interspaced Short Palindromic Repeats, сгруппированные регуляторные разделенные промежутками короткие палиндромные повторы. Они есть примерно у 40% бактерий и почти у всех архей.

Рис. 2. Созревание crРНК в CRISPR-системе II типа. Длинный незрелый предшественник (пре-crРНК) состоит из чередующихся повторов (показаны черным) и спейсеров (показаны зеленым). Отдельно синтезируемая некодирующая РНК (tracrРНК) комплементарна участку повтора. К повторам она и присоединяется, что приводит к разрезанию области повтора с помощью РНКазы III в присутствии белка Csn1. Это первый этап процессинга. На следующем этапе не до конца выясненным пока образом от получившихся обрезков отрезаются еще кусочки, в результате чего и получается полностью созревшая crРНК. Изображение из статьи Elitza Deltcheva et al., 2011. CRISPR RNA maturation by trans-encoded small RNA and host factor RNase III
Функция CRISPR долгое время оставалась неясной. Однако практическая польза от CRISPR была получена и без понимания их роли: поскольку набор спейсеров уникален для каждого штамма, то с их помощью можно идентифицировать штаммы; на этом, например, основан метод сполиготипирования микобактерий туберкулеза, широко применяемый в эпидемиологии для идентификации источника возбудителя и определения очага инфекции.
Но для чего нужны эти загадочные CRISPR самим клеткам? То, что они так широко распространены в прокариотическом мире, означало, что они делают что-то очень важное, что необходимо почти всем прокариотам. Но что? Этого никто не знал.
Разгадка могла таиться в нуклеотидной последовательности CRISPR, и особенно в последовательности уникальных, не повторяющихся участков — спейсеров. Увы, до определенного времени исследования этих коротких нуклеотидных последовательностей не давали никаких результатов. Казалось, что спейсеры кодируют какую-то абракадабру, которая ничему не соответствует, ничего не определяет и ни для чего не нужна.
И вот около десяти лет назад обнаружилась одна любопытная и странная вещь. Оказалось, что последовательности спейсеров данного вида прокариот подозрительно часто совпадают с последовательностями геномов вирусов, которые поражают этот вид. Такое удивительное совпадение говорило о том, что CRISPR-система — это что-то вроде прокариотического приобретенного иммунитета, который позволяет запомнить врага и справиться с ним при повторном заражении. Приятно отметить, что важную роль в разгадке функции CRISPR сыграл наш бывший соотечественник Евгений Кунин.
CRISPR-система: приобретенный иммунитет прокариот
В настоящее время известно несколько типов CRISPR-систем. Рассмотрим вначале работу CRISPR системы, характерную для кишечной палочки Esherichia сoli.
При транскрипции CRISPR-кассеты получаются короткие некодирующие РНК — crРНК, каждая из которых состоит из спейсера, окруженного двумя участками повтора (рис. 1). Если клетку заражает вирус, последовательность ДНК которого комплементарна последовательности спейсера одной из crРНК, то клетка сможет пережить инфекцию.
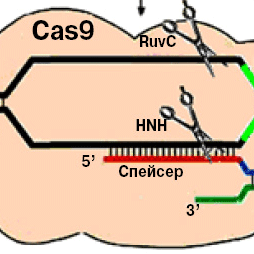
Спейсер crРНК с помощью комплекса особых Cas-белков, который называется Cascade, присоединяется к комплементарному участку вирусной ДНК — протоспейсеру (для этого необходимо еще, чтобы перед протоспейсером в чужеродной ДНК находилась коротенькая нуклеотидная последовательность — PAM, protospacer associated motif). После этого к образовавшемуся комплексу подплывает еще один cas-белок — Cas3, эндонуклеаза/хеликаза, которая вносит в ДНК вируса двуцепочечный разрыв (рис. 3, B). В результате чужеродная ДНК оказывается повреждена, вирусная инфекция прекращается, а клетка «одерживает победу» и остается в живых.

Рис. 3. Механизм работы CRISPR-системы I и II типа. В системе I типа (внизу) в процесс разрезания вовлечено большое количество компонентов. crРНК связывается с крупным вспомогательным белковым комплексом под названием Cascade, который образован некоторыми из cas-белков (гены белков, образующих этот комплекс, на рис. 1 показаны желтым). Обнаружив комплементарную ДНК-последовательность (протоспейсер), crРНК с помощью Cascade присоединяется к ней; это вызывает активацию фермента Cas3 (кодирующий его ген на рис. 1 показан оранжевым), который разрезает чужеродную ДНК и этим спасает клетку. В системе II типа (вверху) компонентов меньше: комплекс tracrРНК-crРНК соединяется с протоспейсерным участком чужеродной ДНК, а фермент Cas9 разрезает обе нити этой ДНК с помощью своих доменов HNH и RuvC. Отметим, что в обоих случаях для того, чтобы crРНК могла присоединиться к протоспейсеру, перед этим протоспейсером должен находиться коротенький участок под названием PAM (protospaser adjancent motif; на данном рисунке назван просто motif). Изображение из синопсиса Stan J. J. Brouns, 2012. A Swiss Army Knife of Immunity
Примерно так же устроена и работа CRISPR-системы другого типа, характерной, например, для бактерии Streptococcus thermophilus, используемой для производства многих молочнокислых продуктов, однако компонентов в ней меньше и устроена она проще. Созревание crРНК обеспечивается короткой некодирующей РНК (trans-activating crRNA или tracrРНК), комплементарной участку повтора, и широко распространенным клеточным ферментом РНКазой III (см. Ribonuclease III), а также вспомогательным белком Csn1 (рис. 2). Атака на чужеродную ДНК производится с помощью той же tracrРНК и эндонуклеазы Cas9 (рис. 3, А).
Прокариотическая CRISPR-система защиты от вирусов очень похожа на эукариотическую систему РНК-интерференции, которая также участвует в антивирусной защите и использует для этого примерно тот же прием — присоединение к нежелательной мРНК короткого комплементарного РНК-участка и последующее выключение этой ненужной мРНК тем или иным способом (например, ее можно просто разрезать на кусочки).
Часто crРНК ухитряются связаться даже с не полностью комплементарной последовательностью ДНК вируса, при условии что имеется подходящий PAM-участок и начало протоспейсера полностью комплементарно последовательности спейсера (рис. 4). Таким образом, один спейсер может одновременно обеспечивать защиту против нескольких сходных вирусов. Это удобно и позволяет сэкономить место в маленьком прокариотическом геноме.

Рис. 4. Схема связывания crРНК с чужеродной ДНК. Для этого связывания достаточно, чтобы комплементарным был только начальный участок протоспейсера (он называется seed) и чтобы перед протоспейсером находился «правильный» PAM. Изображение из статьи Semenova et al., 2011. Interference by clustered regularly interspaced short palindromic repeat (CRISPR) RNA is governed by a seed sequence
Однако что же делать, если клетка никогда прежде не встречалась с данным вирусом и не имеет crРНК с узнающим его спейсером? Неужели она обречена? Неужели вирус в этом случае одержит победу?
Не совсем так. Конечно, большая часть «наивных» бактерий будет уничтожена вирусом. Однако некоторые клетки ухитрятся с ним справиться — и вот каким образом (рис. 5): зараженные вирусом бактериальные клетки начинают лихорадочно вырезать все попавшиеся под руку (точнее — под фермент) участки ДНК и вставлять их в CRISPR-кассету в качестве спейсеров (важную роль в этом процессе играют еще два Cas-белка — Cas1 и Cas2).

Рис. 5. Итоговая схема работы CRISPR-системы на примере инфекции бактерии E. coli фагом М13.
1. Всё начинается с того, что фаг нападает на неопытную, не встречавшуюся прежде с данным возбудителем бактерию и впрыскивает в нее свою ДНК. (На рисунке показан только один нападающий фаг и только одно колечко его ДНК, оказавшееся в клетке, однако на самом деле нападающих фагов и впрыснутых ими ДНК гораздо больше.) В ответ бактерия с помощью Cas1/Cas2-белков начинает лихорадочно вырезать все попавшиеся участки ДНК — как фаговые, так и свои собственные, хозяйские — и вставлять их в качестве спейсеров в CRISPR. Если бактерии повезло и она вырезала правильный кусочек из фаговой ДНК, то...
2. Инфекция вызовет реакцию соответствующей crРНК, Cascade-комплекса и Cas3 (подробно показанную на рис. 2 и 3), в результате чего фаговая ДНК будет уничтожена. Однако фаги тоже не лыком шиты, они тоже хотят выиграть эту войну. Стоит фагу мутировать (мутация показана красной точкой), как crРНК перестанет их распознавать, и они невидимыми проникнут в клетку и начнут делать свои черные дела. Казалось бы, клетка обречена, но...
3. Даже недостаточно комплементарный кусочек фаговой ДНК активирует CRISPR-систему, причем вырезание ДНК-фрагментов будет производиться уже именно из фаговой ДНК. Судя по всему, обеспечивается это тем, что Cas1/Cas2-комплекс даже при некрепком, недостаточно комплементарном присоединении crРНК к ДНК фага начинает скользить по этой враждебной ДНК, вырезая из нее один кусочек за другим, пока не попадется участок, подходящий на роль «правильного» спейсера. Этот спейсер и спасет клетку от заражения.
Изображение из статьи Kirill A. Datsenko et al., 2012. Molecular memory of prior infections activates the CRISPR/Cas adaptive bacterial immunity system
Большая часть вставленных участков окажется бесполезной или даже вредной (например, вставка в качестве «портрета врага» участка бактериальной ДНК приведет к гибели клетки за счет раскуса собственной ДНК); однако некоторые «счастливчики» случайно вставляют в качестве CRISPR-спейсера фрагмент вирусной ДНК, что дает возможность синтезировать защитную crРНК и победить вирус. Этот новый спейсер они передадут всем своим потомкам, и поэтому от данного вируса их потомки будут защищены. Вообще, набор спейсеров в данной клетке — это, в каком-то смысле, ее история, память о прежних, выигранных, боях с вирусами.
Но это еще не всё. Оказывается, вставка спейсеров происходит по принципу положительной обратной связи, то есть вставка одного спейсера резко стимулирует вставку последующих спейсеров из ДНК донора. Так, эксперименты, проведенные в лаборатории К. В. Северинова, показали, что если у данной бактерии есть спейсер к данному вирусу, повторное заражение этим вирусом вызывает направленную вставку дополнительных спейсеров из ДНК вируса. Иными словами, если бактерия уже атаковалась раньше вирусами, то следующие атаки она перенесет легче, потому что у нее будет способность идентифицировать чужеродную ДНК и вставлять новые спейсеры. Чем-то похоже на вакцинацию, правда?
Практическое применение
Какую же практическую пользу можно извлечь из знаний о работе CRISPR-системы? Огромную, и во множестве областей.
Начнем с того, что прокариотические клетки активно используются людьми для самых разных вещей — возьмем хотя бы всем известные кисломолочные бактерии. Понятно, что одна из самых ужасных вещей, которая может случиться при производстве кисломолочных продуктов, — это атака бактериофагов, уничтожающих бактериальную культуру. Однако если мы знаем, как защитить бактерии от этой атаки, то проблем с производством кисломолочных продуктов не будет.
В то же время, другие бактерии, наоборот, могут нанести человеку, животным или растениям серьезный вред. Однако если мы знаем, как они защищаются от атак бактериофагов, то можем помешать им это делать — и так спастись от бактериальной инфекции.
Наконец, есть еще третье, на редкость перспективное, применение CRISPR-системы. С ее помощью можно с невиданной доселе аккуратностью редактировать геномы высших организмов, включая человека. Об этом недавно вышли две статьи в Science (Le Cong et al., 2013. Multiplex Genome Engineering Using CRISPR/Cas Systems; Prashant Mali et al., 2013. RNA-Guided Human Genome Engineering via Cas9), и на этом я остановлюсь поподробней.
Самые точные ножницы для генома
Для того чтобы «отредактировать» какое-то место в ДНК, например исправить мутацию, приводящую к генетическому заболеванию, надо сначала это место разрезать. При этом разрезающий фермент — эндонуклеаза — должен обладать высочайшей специфичностью, то есть резать ДНК в нужном месте и только в нем (потому что разрезание ДНК в ненужном месте может привести к совершенно ненужным последствиям). А значит, участок ДНК, по которому распознается это нужное место, должен быть как можно длиннее — ведь чем он длинней, тем меньше вероятность, что такой же участок встретится где-то еще на просторах генома и что там тоже пройдутся «ножницы» эндонуклеазы.
И вот так как защитный комплекс CRISPR-систем связывается с относительно длинными (не меньше 20 нуклеотидов) участками ДНК, соответствующими спейсерам, то возникает возможность достичь высокой специфичности редактирования.
За основу своей разработки обе группы авторов опубликованных в Science статей взяли просто устроенную систему из Streptococcus thermophilus, состоящую всего из четырех обязательных элементов — tracrРНК, crРНК, РНКазы III и Cas9 (рис. 3, А). Чем меньше компонентов, тем проще работать с системой и тем выше шанс, что система заработает в нестандартных для себя условиях работы в эукариотической клетке. Исследователям удалось еще более упростить систему. Во-первых, они создали «химерную» tracr-crРНК, которая работала ничуть не хуже, чем tracrРНК и crРНК, синтезируемые по отдельности (рис. 6). Во-вторых, они обнаружили, что бактериальная РНКаза III для работы системы не обязательна, поскольку ее функцию могут выполняют «местные» РНКазы, синтезируемые в эукариотической клетке.

Рис. 6. «Химерная» РНК имеет все ключевые фрагменты crРНК и tracrРНК, необходимые для правильного функционирования в клетке: направляющую последовательность (самый значимый участок спейсера, связывающийся с ДНК) и участок повтора, связанный с кусочком tracrРНК. Такая «химера» гораздо проще по структуре, чем две отдельные молекулы crРНК и tracrРНК, а работает примерно с той же эффективностью. Изображение из статьи Le Cong et al., 2013. Multiplex Genome Engineering Using CRISPR/Cas Systems. Сходную структуру получили и исследователи из второй группы (Prashant Mali et al., 2013. RNA-Guided Human Genome Engineering via Cas9)
Таким образом, для того чтобы разрезать в клетке ДНК в нужном месте, нужно было сделать совсем немного:
1) Поставить последовательность, комплементарную этому «нужному месту», в качестве спейсера в CRISPR-кассету и получить химерную tracr-crРНК.
2) Запустить экспрессию этой CRISPR-кассеты и белка Cas9 в соответствующей клетке, снабдив их сигналом ядерной локализации (NLS), чтобы они не «слонялись без толку» по цитоплазме, а плыли прямо в ядро, где, собственно, и находится разрезаемая ДНК.
Получившаяся система в работе на клеточных культурах показала отличные результаты: с ее помощью можно как удалять из ДНК какие-то участки, так и вставлять туда новые области. CRISPR-система показала лучшую эффективность, чем предыдущие «фавориты» в этой области — цинковопальцевые нуклеазы (см. Zinc finger nuclease) и TALEN. Нельзя, конечно, говорить о том, что CRISPR-система позволит делать с геномом всё, что только захочется исследователю, но, пожалуй, из всех существующих методик она наиболее близка к этому.
Источники:
1) Лекция К. В. Северинова на Зимней школе FutureBiotech.
2) Le Cong, F. Ann Ran, David Cox et al. Multiplex Genome Engineering Using CRISPR/Cas Systems // Science. V. 339. P. 819–823.
3) Prashant Mali, Luhan Yang, Kevin M. Esvelt. RNA-Guided Human Genome Engineering via Cas9 // Science. V. 339. P. 823–826.
4) John van der Oost. New Tool for Genome Surgery // Science. V. 339. P. 768–770 (синопсис к двум вышеуказанным статьям).
5) Kirill A. Datsenko, Ksenia Pougach, Anton Tikhonov et al. Molecular memory of prior infections activates the CRISPR/Cas adaptive bacterial immunity system // Nature Communications. V. 3. Article number: 945. Published 10 July 2012.
6) Ksenia Pougach, Ekaterina Semenova, Ekaterina Bogdanova et al. Transcription, Processing, and Function of CRISPR Cassettes in Escherichia coli // Mol Microbiol. V. 77. P. 1367–1379.
Вера Башмакова
-
А как лечить-то? Правильно ли я понимаю, что если лечить каким-то таким методом, как в сабже, то можно воздействовать на эмбрион, состоящий из малого количества клеток (модифицируя их всех). А взрослый организм: как в нём дойти до всех клеток (а, может, и не надо совсем уж до всех)? Должен быть сконструирован для второго случая некий специальный вирус, который доставит машинерию в нужные места?
-
Вы правильно все понимаете. Про доставку ДНК в клетки написано, например, вот тут http://elementy.ru/lib/431719
А если клетку поразит вирус, у которого будут участки, совпадающие с участками ДНК прокариоты? Бактерия тогда в попытке выработать иммунитет будет всегда себя убивать?
А разве может быть иначе? Разве могут несовершенные организмы выжить в агрессивной среде? Определенно, нет, и это относится не только к системе защиты от вирусов.
Так откуда же взялось это совершенство? Из несовершенства? Но несовершенные организмы обречены на гибель. Следовательно совершенство может произойти только от совершенства и никак иначе. А это противоречит общепринятому сценарию происхождения жизни.
-
>А разве может быть иначе?
Может. У эукариот геномы полны вирусного и прочего мусора (который, однако, является важным источником новых генов).
>Так откуда же взялось это совершенство?
Из отсутствия системы сплайсинга белок-кодирующих генов бактерий, сравнительно примитивной оперонной системы регуляции экспрессии генов и довольно жесткого верхнего предела на размер генома (~13 мегабаз), который для эукариот фактически нижний предел. А верхний уходит за 4 порядка от нижнего, позволяя сделать из ядра "файлопомойку".
Но все это не идет ни в какое сравнение с совершенством (эффективностью использования наследственного аппарата) вирусных геномов, у которых ограничения на размер генома, налагаемые жестким капсидом просто драконовские, что приводит к двух- и иногда даже трехкратным наложениям генов со сдвигом рамок считывания на один нуклеотид. Нудык - жыть захочешь - не так раскорячишься. Вон программисты микрокода в чипах разнообразных контроллеров в стародавние времена тоже проявляли чудеса оптимизации и кодерского совершенства.
>Следовательно совершенство может произойти только от совершенства и никак иначе. А это противоречит общепринятому сценарию происхождения жизни.
А веревка есть вервие простое. Фаллософ, проследуйте в открытый метантенкъ и не позорьте имя великого Циника своим кретиноцианизмом. Ну или хотя бы почитайте ужэ современные учебники по молекулярной микробиологии.-
>Может. У эукариот геномы полны вирусного и прочего мусора (который, однако, является важным источником новых генов)
Спасибо, насмешили :-)От этой инфы что-то настойчиво тянет нафталином.
> Из отсутствия системы сплайсинга белок-кодирующих генов бактерий, сравнительно примитивной оперонной системы регуляции экспрессии генов и довольно жесткого верхнего предела на размер генома (~13 мегабаз), который для эукариот фактически нижний предел. А верхний уходит за 4 порядка от нижнего, позволяя сделать из ядра "файлопомойку".
То есть вы считаете, что простое перечисление генетических механизмов бактерий обьясняет откуда взялось совершенство? И что значит "файлопомойка"? На чем основано такое пренебрежительное отношение к геному?
> Вон программисты микрокода в чипах разнообразных контроллеров в стародавние времена тоже проявляли чудеса оптимизации и кодерского совершенства.
Услышать от вас сравнение программистов, которые проявляли чудеса оптимизации и кодерского совершенства, и генома - это просто ЛОЛ!
А что же вы, товарищ мудрец, проигнорировали главный вопрос: "Могут ли несовершенные организмы выжить в агрессивной среде?"
>А веревка есть вервие простое.
Видимо это что-то из молекулярной микробиологии...
>Фаллософ, проследуйте в открытый метантенкъ и не позорьте имя великого Циника своим кретиноцианизмом.
Ай-яй-яй, как нэхорошо, товарищ муд..рец! Хамите, обзываетесь. Может у вас запор?-
>От этой инфы что-то настойчиво тянет нафталином.
От 2*2=4 - тоже. От этого данное равенство становится менее верным?
За модой - в бутик (и потом в Биореактор), а не в сюда.
>То есть вы считаете, что простое перечисление генетических механизмов бактерий обьясняет откуда взялось совершенство?
Оно представляется Нам наиболее подходящим объяснением на основе известных данных.
За ответами от Абсолютной Ыстены - в свинагогу или в цирковь (и потом - опять таки - в Биореактор), а не в сюда.
>На чем основано такое пренебрежительное отношение к геному?
На ежедневной практической с ними (геномами) работе.
>это просто ЛОЛ!
Ну, если Вас удивляет сходство решений сходных задач и явление конвергенции - чем Мы Вам могу помочь кроме как послать в библиотеку, гугель или опять таки... да-да.
>Могут ли несовершенные организмы выжить в агрессивной среде?
Могут конечно. Все зависит от множества количественных параметров. "Агрессивные среды" - они кагбе столь же разнообразны, сколь сама Вселенная.
>Видимо это что-то из молекулярной микробиологии...
Нет - это из безсмертной Классики. Но, йожелли Вас в Гугеле зобанилле - Вы уже в курсе куда следует обращяця.
>Хамите, обзываетесь.
Лишь даю рекомендации того, как Вам лучше всего помочь Человечеству.
>Может у вас запор?
Наше пищеварение много лет работаетъ как атомные часы.-
Ну что вы хотите от Диогена, весна, у крео обострение. Тем более пост на дворе, от редьки живот успучило, вот на запоры и жалуется, проецирует свои проблемы на собеседников.
А по делу Rattus, если вы работаете с геномами, может подскажите насколько можно упростить указанную систему иммунитета, чтобы посмотреть ее происхождение?-
Происхождение "вирусной базы" или "антивирусного движка"?
Мы, тащемта, не то, чтобы на поиске гомологов собаку съелъ, но если бы задачу такую бы поставили, сделал бы так:
Сперва забил бы интересующие куски в BLAST с нестрогими параметрами, а потом, по результатам, стал бы постепенно сужать область интереса. А детальнее - это биоинформатиков надо спрашивать. Для того можно например изловить вот этого страшного человека: http://www.iitp.ru/ru/users/149.htm или его коллег. Мы же - пока простой сермяжный бионаноинженерио-пипеткомашецъ (http://images.cpcache.com/image/23263371.png).
-
-
-
Ой, сколько презрения! Спокойнее, товарищ, спокойнее, соблюдайте орфографию.
>Оно представляется Нам наиболее подходящим объяснением на основе известных данных. За ответами от Абсолютной Ыстены...
Понятно. Истины у Нас вы не найдете - ложь, одна сплошная ложь...
>На ежедневной практической с ними (геномами) работе.
Понятно. Профессиональная деформация, отсюда цинизм и мудрячество. А вы типо учОный или кагбэ учОный, а может чиста канкретна? И, если вы геномы препарируете, как же вы не в курсе, что понятие "мусорная днк" устарело не потому что не модно, а потому что основано не на знании, а на незнании?
>Ну, если Вас удивляет сходство решений сходных задач...
Меня удивляет не сходство задач, а то, что вы это сходство видите.
>Могут конечно.
Не могут. Поскольку несовершенство предполагает отсутствие либо неэффективность жизненно важных систем и механизмов.
>Лишь даю рекомендации того, как Вам лучше всего помочь Человечеству.
Ну что вы, разве я могу помочь человечеству. То ли дело Вы!-
>Ой, сколько презрения!
Это - то немногое, что Мы можем предоставить в нагрузку за бесплатное просвещение массъ.
>Спокойнее, товарищ, спокойнее
"Мне эмоции недоступны, даже ярость приходится имитировать." (В.С. Луговский)
>соблюдайте орфографию.
Это новая громатека и арфа-графия.
Тоpа'гой, Мы можем писать на идиш... Hо Вы же не поймете?
>Истины у Нас вы не найдете - ложь, одна сплошная ложь...
Однобитная логика детектедъ.
>Профессиональная деформация, отсюда цинизм и мудрячество.
Вы так говорите, будто это что-то плохое и опять таки позорите великого Циника.
>И, если вы геномы препарируете, как же вы не в курсе, что понятие "мусорная днк" устарело не потому что не модно, а потому что основано не на знании, а на незнании?
Щяс ещё всякая креошелупонь будет Нас учить терминологии и контекстам её применения.
>Меня удивляет не сходство задач, а то, что вы это сходство видите.
А нас наобормот - ниразу не удивляет неспособность кретиноцианистов к обобщению, абстрагированию и экстраполяции.
Вообще полагаю, что отсутствие фантазии - это, по большей части, наследуемый дефектъ.
>Не могут. Поскольку несовершенство предполагает отсутствие либо неэффективность жизненно важных систем и механизмов.
Думаю, если Вы поставите зеркало вместо монитора - Вы гораздо быстрее найдете общий язык с Умным Человеком по ту сторону на основе своего "тезауруса", который с общепринятым имеет очень немного общего.
>Ну что вы, разве я могу помочь человечеству.
Вы не поверите - но внести свою лепту (если нет даже кодранта или халкунта, не говоря уж о таланте соотв.сплава) может каждый:
http://antigreen.org/bioreactor/-
>Истины у Нас вы не найдете - ложь, одна сплошная ложь... Однобитная логика детектедъ.
Признаю, ошибся. Не сплошная ложь, а полуправда-полуложь. Чтобы пипл вместе с кашей схавал и дермецо.
>Вы так говорите, будто это что-то плохое и опять таки позорите великого Циника.
Простая констатация факта.
>Щяс ещё всякая креошелупонь будет Нас учить терминологии и контекстам её применения.
Гы гы)) а кто ж еще вас, товарищъ пепедкомашець, будет учить. Эвошелупонь ваще тупаки, способны тока лизать жопу своим эво-гуру, цитировать их тексты и посылать на... еволбиол.ру.
>Думаю, если Вы поставите зеркало вместо монитора - Вы гораздо быстрее найдете общий язык с Умным Человеком по ту сторону на основе своего "тезауруса", который с общепринятым имеет очень немного общего.
Ну еще бы. Ведь для вас несовершенство - это "файлопомойка" в геноме. А несогласных на костёр, то бишь в биореактор.-
>Чтобы пипл вместе с кашей схавал и дермецо.
Такая уж у него судьба. Еще великий А.С.ПушкинЪ о томъ пейсалл: " К чему стадам дары свободы? Их должно резать или стричь. Наследство их из рода в роды Ярмо с гремушками да бич."
>Эвошелупонь ваще тупаки, способны тока лизать жопу своим эво-гуру, цитировать их тексты и посылать на... еволбиол.ру.
Девствительно неумно посылать учиться того, кто к этому оченьвидно не способен, тогда как гораздо практичнее посылать сразу в Биореактор.
>Гы гы)) а кто ж еще вас, товарищъ пепедкомашець, будет учить.
Явно не Вы. У Вас только веселить получается допрежъ.
>Ведь для вас несовершенство - это "файлопомойка" в геноме.
И для всех, кто имеет отношение к изучению систем хранения и обработки информации (коей геном, несомненно, является) совершенство = плотность размещения информации в рамках рассматриваемой архитектуры.
>А несогласных на костёр, то бишь в биореактор.
Именно такЪ. Необучаемые индивиды должны быть элиминированы из популяции.
-
-
-
-
-
Факт! Был такой "трактор" PDP-11 (http://ru.wikipedia.org/wiki/PDP-11),
у него была отличная от айбиэмовской система комманд процессора. Она позволяла именно что творить чудеса. Но св. Писание (не говоря уже о св. Придании) учит нас, что чудеса бывают хорошие и разные. Например, самый короткий вирус мог быть написан именно под архитектуру PDP-11:
MOV -(PС), -(PС)
Да, да: именно одна комманда процессора - вирус, причём, совершенно легальная! 16 бит чистого волшебства. Попав на этот шедевр, процессор копировал содерживое ячейки с данной коммандой в адрес, расположенный аккурат над ячейкой с вирусом - и передавал туда управление!!! Усё. В результате все младшие адреса оказывались забиты этим магическим кодом, и, дойдя до адреса 0, процессор говорил: "Ой!". Я лично это проверял.
А ещё я видел чудесный код для сохранения содержимого регистров (5 штук) в стек, вызова подпрограммы, а потом - восстановления из стека содержимого регистров; в том коде вообще к шестнадцатибитному слову с коммандной прибавлялось по 1, а потом - отнималось.
Романтика!
== == Следовательно совершенство может произойти только от совершенства и никак иначе. == ==
Метантек - это не слишком? :( А за пожелание "почитайте ужэ современные учебники по молекулярной микробиологии" гореть Вам в адъу, 146% инфа.
Ха! Прям-таки на 1 нуклеотид?! И что же в итоге получается? Ведь совершенно другой белок получается! И ему тоже дело находится? А что со стоп-кодоном тогда? И как разбирается организм с "лишними" двумя нуклеотидами? И если на 1 можно, то - бей посуду, Дарвин платит - и на 2 можно? Меня как-то посетил вопрос, что может происходить при сдвиге на 1 (2) нуклеотид, но я химик, и решил, что этот вопрос - бредовый, и забыл о нём... А тут - Ваш пост; совсем душу мне растревожили!
Ну, и чтобы 2 раза не вставать. Не делал ли кто такого "мысленного" эксперимента? Берём БД генов (строго, скажем, по вирусам); это БД1 будет. На её основе генерируем БД белков; это БД2 будет. Берём очередной ген из БД1. Сдвигаемся на 1 нуклеотид (для простоты с другого конца гена 2 нуклеотида не учитываем). Генерируем белок по этой усечённой ДНК. Ищем похожие на полученный белок по БД2 (что значит похожие? критериев похожести, как понимаю, может существовать не один (т.е. это отдельный вопрос)). Смотрим, за что отвечает найденный похожий белок? какому организму принадлежит? состоят ли в родстве два организма (один белок, который сгенерирован на основе усечённого гена (от первого организма); второй белок, который похож на первый белок (второй белок от второго организма))? Перебираем все гены в БД1.
Потом можно сдвинуться на 2 нуклеотида (похерив один в конце гена) и повторить процесс.
Потом можно взять не строго вирусы, а расширить БД1 за счёт бактериальных генов. Потом можно ещё организмов понабрать в сет.
У Вас уже, наверное, возник здоровый вопрос "зачем?". На это я должен честно заявить, что я не читатель (биохимик/биолог), а писатель (химик), как тот твой житель крайнего Севера из анегдота. НЕ ЗНАЮ, короче. Но чуйка мне подсказывает, что идея моя не совсем безумная. Может быть, она должна быть переформатирована, чтобы обрести не метафизический смысл, а вполне себе конструктивный (какой, не знаю). Если всё же затея бредовая "по жизни", то не взыщите :) Но: "а вдруг?!"
PS Вы взяли термин "файлопомойка" в кавычки. Почему? Я слышал, что в этой "помойке" интересные штуки попадаются.
CRISPR-Cas
-
 29.07.2025«Генетические ножницы»: прорыв или нет?Ирина Якутенко • Библиотека • «Троицкий вариант» №11(430), 2025
29.07.2025«Генетические ножницы»: прорыв или нет?Ирина Якутенко • Библиотека • «Троицкий вариант» №11(430), 2025 -
 18.06.2019Систему CRISPR можно использовать для аккуратного встраивания генов в нужное местоАлександр Марков • Новости науки
18.06.2019Систему CRISPR можно использовать для аккуратного встраивания генов в нужное местоАлександр Марков • Новости науки -
 13.07.2017Подведены итоги первого десятилетия изучения CRISPRЕлена Наймарк • Новости науки
13.07.2017Подведены итоги первого десятилетия изучения CRISPRЕлена Наймарк • Новости науки -
 22.07.2016Homo sapiens: работа над ошибкамиАлександр Панчин • Библиотека • «Популярная механика» №5, 2016
22.07.2016Homo sapiens: работа над ошибкамиАлександр Панчин • Библиотека • «Популярная механика» №5, 2016
-
 30.06.2016CRISPR/Cas-системыВера Мухина • Картинки дня
30.06.2016CRISPR/Cas-системыВера Мухина • Картинки дня
-
 18.04.2016Ученые выяснили, почему бактериофагам трудно бороться с иммунной системой бактерийАлександр Марков • Новости науки
18.04.2016Ученые выяснили, почему бактериофагам трудно бороться с иммунной системой бактерийАлександр Марков • Новости науки
-
 22.05.2015Мир победивших биотехнологийДенис Тулинов • Библиотека • «Популярная механика» №12, 2014
22.05.2015Мир победивших биотехнологийДенис Тулинов • Библиотека • «Популярная механика» №12, 2014
-
 07.12.2014Умные ножницы для ДНКДмитрий Джагаров • Библиотека • «Химия и жизнь» №7, 2014
07.12.2014Умные ножницы для ДНКДмитрий Джагаров • Библиотека • «Химия и жизнь» №7, 2014
-
 12.03.2013Прокариотическая система иммунитета поможет редактировать геномВера Башмакова • Новости науки
12.03.2013Прокариотическая система иммунитета поможет редактировать геномВера Башмакова • Новости науки
-
 06.04.2011Приобретенный иммунитет у бактерий может быть связан с механизмами РНК-интерференцииЕлена Наймарк • Новости науки
06.04.2011Приобретенный иммунитет у бактерий может быть связан с механизмами РНК-интерференцииЕлена Наймарк • Новости науки
Последние новости















Рис. 1. Созревание crРНК в CRISPR-системе I типа. CRISPR-участок состоит из одинаковых последовательностей длиной примерно 30 нуклеотидов (повторов), разделенных разными последовательностями длиной тоже примерно 30 нуклеотидов (спейсерами). CRISPR-участки собраны в группы (кассеты); количество CRISPR в кассете и количество кассет очень разнится у разных видов бактерий и архей: у архей в одной кассете может быть аж 300–500 CRISPR. Повторы отличаются у разных видов прокариот; что касается спейсеров, то их набор вообще уникален для каждого штамма. CRISPR-кассеты соседствуют с так называемыми Cas-генами, вносящими серьезный вклад в работу CRISPR-системы (подробнее о них рассказано в подписи к рис. 2). После транскрипции CRISPR-кассеты один из Cas-белков, эндонуклеаза CasE, разрезает получившийся длинный незрелый РНК-предшественник на короткие зрелые crРНК; у получившихся crРНК фланкирующие (крайние) участки одинаковы и происходят из повторов, а середина уникальна и образована спейсером. Изображение из слайдов к лекции К. В. Северинова на Зимней школе, с изменениями