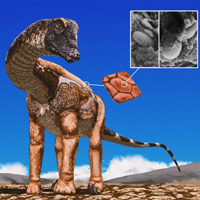
LIM-киназа помогает клеткам опухоли прокладывать путь в межклеточном матриксе

Метастазирование опухоли — комплексное явление, для которого важна не только способность клетки передвигаться, но и ее умение прокладывать себе путь, разрушая межклеточный матрикс (сложное вещество, заполняющее пространство между клетками). Подавление этих процессов может использоваться для борьбы с онкологическими заболеваниями. В работе группы исследователей из Великобритании, опубликованной в The Journal of Cell Biology, ученые сообщают об открытии роли белка LIMK в регуляции образования инвадоподии — характерной для раковых клеток структуры, ответственной за разрушение межклеточного матрикса.
Движение клеток лежит в основе таких процессов как иммунный ответ, эмбриональное развитие, регенерация и заживление ран. Потеря контроля над подвижностью часто сопровождает развитие онкологических заболеваний. Приобретая способность двигаться и теряя контакты с окружающими клетками, раковые клетки могут мигрировать из места возникновения опухоли и давать начало метастазам. Для метастазирования клеткам, кроме способности двигаться, необходимо уметь прокладывать себе путь, разрушая межклеточный матрикс. В этом клеткам помогают специальные структуры — инвадоподии (Invadopodia), выросты, в которых локализуются протеолитические ферменты, расщепляющие внеклеточный матрикс (рис. 1). И при движении клеток, и при образовании раковыми клетками инвадоподий решающую роль играют перестройки клеточного каркаса (цитоскелета).
Один из основных цитоскелетных белков — актин, небольшой глобулярный белок, способный полимеризоваться и образовывать длинные нити — актиновые микрофиламенты (рис. 2). У каждого такого микрофиламента есть два конца, которые различаются по своим свойствам: к одному (он называется плюс-конец) мономеры актина присоединяются, а от другого (минус-конец) — отваливаются (диссоциируют). Соотношение скоростей присоединения и диссоциации мономеров актина определяет, удлиняется филамент или укорачивается. Рост микрофиламентов лежит в основе образования плоских выростов клетки — ламеллоподий (Lamellipodia), которые клетка выбрасывает по направлению своего движения. Вновь образованная ламеллоподия создает клеточные контакты с поверхностью, по которой движется клетка. После этого она разрушает старые контакты с субстратом и подтягивает вперед свой задний край. Сокращение клетки происходит за счет стресс-фибрилл, которые образованы актиновыми филаментами и сократительным белком миозином. По своему принципу этот процесс схож с сокращением мышцы.

Движение клетки и образование инвадоподий связано с динамическим равновесием между разрушением и сборкой актиновых микрофиламентов, и эти процессы в клетке находятся под жестким контролем регуляторных белков. Один из них — кофилин. Он связывается с актиновым микрофиламентом, после чего в месте связывания микрофиламент разламывается на две части. В результате появляется два новых микрофиламента, у каждого из которых есть плюс- и минус-конец. То есть кофилин может способствовать образованию новых филаментов. С другой стороны, кофилин связывается с мономерами актина и не дает им стать частью актинового филамента, препятствуя его удлинению. Следовательно, кофилин выполняет в клетке две противоположные функции: способствует как удлинению, так и укорачиванию актиновых филаментов.
Выбор между этими двумя эффектами зависит от других белков, взаимодействующих с актином. Если кофилин фосфорилирован, он теряет свою активность (рис. 3). Фосфорилирование — это введение в молекулу белка остатка фосфорной кислоты (фосфата), которое происходит под действием ферментов киназ. Такая модификация придает белку дополнительный отрицательный заряд, что сказывается на его свойствах и возможности взаимодействовать с другими белками. Фосфорилирование — одна из самых распространенных регуляторных модификаций белков. Разные киназы различаются по структуре и набору белков, которые они могут фосфорилировать. Они контролируют все метаболические превращения веществ в клетке, ее деление и движение, мышечное сокращение, реакцию клетки на внешние стимулы (гормоны, факторы роста).
Одна из киназ, фосфорилирующих кофилин, — LIM-киназа (LIMK; киназа, содержащая LIM-домен, который позволяет разным белкам взаимодействовать между собой; рис. 3). Она интересна тем, что фосфорилирует только кофилин и еще несколько родственных ему белков. В то же время активность самой киназы контролируется многими сигнальными каскадами, и это обеспечивает возможность регуляции перестроек актинового цитоскелета в ответ на множество внешних и внутренних факторов.

Таким образом, клетка с помощью LIMK и кофилина может регулировать длину и количество актиновых микрофиламентов: увеличение количества активного (дефосфорилированного) кофилина приводит к дестабилизации актинового цитоскелета, а неактивного (фосфорилированного) — к стабилизации. Сбалансированная активация кофилина регулирует подвижность клеток и их способность к инвазии.
Группа исследователей из Великобритании изучила молекулярные механизмы коллективной инвазии опухолевых клеток. При таком типе инвазии клетки движутся согласованной группой. Те, что идут впереди, выполняют особую функцию — они прокладывают путь в межклеточном матриксе, по которому следуют все остальные клетки опухоли. Ранее было известно, что LIMK принимает участие в метастазировании. Однако не было ясно, за какой процесс ответственна LIMK — за регуляцию подвижности клеток опухоли или за разрушение межклеточного матрикса.
Для ответа на этот вопрос исследователи применили ингибитор LIM-киназы, а также короткие интерферирующие РНК (siRNA), которые «выключают» ген, ответственный за синтез этого белка в клетке (подавляют экспрессию гена LIMK).
Сначала ученые проверили необходимость LIMK для успешной инвазии. Они подавили экспрессию гена киназы в клетках опухоли молочной железы (линии клеток MDA-MB-231) с помощью siRNA, а затем наблюдали, как они будут внедряться в матрикс, имитирующий межклеточное вещество. Оказалось, что такие клетки теряют способность к инвазии. В клетке встречаются две изоформы LIMK — LIMK1 и LIMK2. Для подавления инвазии требовалось выключить обе изоформы одновременно. Выключение LIMK с помощью siRNA сопровождалось уменьшением количества фосфорилированного кофилина и полимеризованного актина в клетках. Это хорошо согласуется с тем, какую роль киназа LIMK играет в клетке (рис. 3).
Так как инвазия может зависеть как от способности клеток передвигаться, так и от способности разрушать межклеточный матрикс, то было интересно узнать, каким из этих процессов управляет LIMK. Для проверки влияния LIMK на способность клеток передвигаться ученые использовали тест на клеточную подвижность (рис. 4): клетки сажали на чашку Петри, а когда они заполняли всё дно чашки, клетки из центра убирали, освобождая круг стандартного диаметра. При этом со временем клетки мигрируют в пустое пространство, постепенно занимая его. Контрольные клетки (в которых есть LIMK) и клетки, в которых была подавлена экспрессия LIMK, мигрировали в центр с одинаковой скоростью. Поэтому исследователи сделали вывод, что LIMK не ответственна за движение клеток. Дополнительные эксперименты показали, что подавление экспрессии LIMK не нарушало способности клеток регулировать направление своего движения. Таким образом, исследователи исключили возможность того, что LIMK влияет на передвижение клеток.

Теперь логично было предположить, что LIMK участвует в деградации внеклеточного матрикса. Оказалось, что если клетки обработать ингибитором LIMK, то они значительно хуже разрушают внеклеточный матрикс (по сравнению с контрольными клетками). Ученые заметили, что у клеток, в которых была ингибирована LIMK, нарушено образование инвадоподий, с помощью которых происходит разрушение внеклеточного матрикса. Причиной этого, вероятно, была недостаточная стабилизация актиновых филаментов, формирующих каркас инвадоподий, в отсутствие LIMK. При подавлении экспрессии LIMK кофилин не фосфорилирован и способствует разрушению актиновых микрофиламентов, дестабилизируя инвадоподии.
Для метастазирования раковым клеткам необходимо уметь разрушать межклеточный матрикс. Однако такой способностью достаточно обладать только некоторым клеткам, а остальные последуют за ними по проложенным путям. Для продолжения выяснения функции LIMK в условиях, приближенных к реальным, ученые смоделировали такую опухоль следующим образом (рис. 5). На трехмерный матрикс они сажали культуру, состоящую из клеток двух типов — стромальных опухолевых фибробластов (CAF, cancer-associated fibroblast, опухоль-ассоциированные фибробласты) и сквамозной карциномы (SCC; этот тип опухоли возникает из клеток эпителия, например кожи). Сами по себе SCC не могут разрушать клеточный матрикс, однако способны мигрировать по путям, проложенным CAF. Если в такую систему добавляли ингибитор LIMK, модельная опухоль не внедрялась в матрикс, на котором росла.
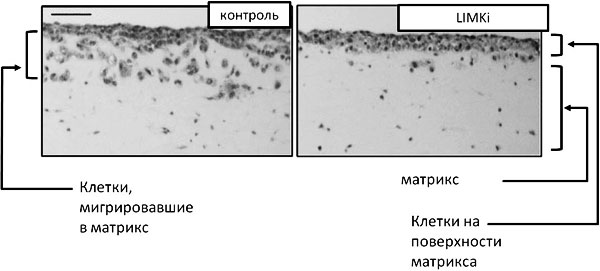
Чтобы выяснить, какой из процессов, приводящих к метастазированию, — подвижность или способность разрушать внеклеточный матрикс — был нарушен ингибитором LIMK, исследователи модифицировали систему. Сначала на матриксе они выращивали клетки CAF, позволяя им проделать в нём ходы. Затем CAF убивали и удаляли, а на тот же матрикс сажали клетки SCC и давали им возможность мигрировать в матрикс. В контрольном эксперименте клетки SCC мигрировали в матрикс по путям, проложенным CAF. Если в среду при выращивании SCC добавляли ингибитор LIMK, то это не нарушало миграцию клеток SCC в матрикс. Из этого следует, что LIMK не управляет процессом движения клеток в такой модели опухоли. Если же ингибитор LIMK добавляли в среду при выращивании CAF на матриксе, то инвазии SCC не происходило. Следовательно, LIMK ответственна за разрушение матрикса лидирующими клетками опухоли. Однако она никак не влияет на способность раковых клеток следовать по уже проложенным путям.
На основании своих экспериментов авторы выдвигают модель, в соответствии с которой LIMK участвует в образовании инвадоподий — специальных выростов клетки, отвечающих за разрушение внеклеточного матрикса. Актиновые микрофиламенты образуют каркас, поддерживающий инвадоподию. LIMK обеспечивает наличие такого количества активного кофилина, при котором клетка может сделать достаточно стабильный актиновый каркас. Если с помощью ингибитора LIMK подавить ее активность, то увеличится количество нефосфорилированного кофилина, который будет разрушать актиновые микрофиламенты и препятствовать образованию инвадоподии. Следовательно, будет блокироваться и инвазия.
Конечно, процесс образования инвадоподий и клеточного движения сложен и зависит от многих факторов. Баланс между фосфорилированной и дефософорилированной формами кофилина, который поддерживается LIM-киназой, — только один из них.
Рак не является заболеванием, вызываемым какой-либо одной мутацией: для раковых клеток характерно большое количество нарушений, которые могут быть разными даже для клеток одной и той же опухоли, не говоря уже об опухолях у разных больных. Сегодня известно, что чрезмерная активация LIMK обнаруживается при некоторых видах злокачественных образований (рак груди, меланома, рак простаты). Следовательно, исследования LIMK могут привести к открытию новых способов предотвращения метастазирования опухолей.
Источники:
1) Rebecca W. Scott, Steven Hooper, Diane Crighton, Ang Li, Ireen König, June Munro, Elisabeth Trivier, Grant Wickman, Pierre Morin, Daniel R. Croft, John Dawson, Laura Machesky, Kurt I. Anderson, Erik A. Sahai, Michael F. Olson. LIM kinases are required for invasive path generation by tumor and tumor-associated stromal cells // The journal of cell biology. 2010. V. 191 (1). P. 169– 185.
2) Н. Б. Гусев. Движение немышечных клеток и реорганизация актиновых микрофиламентов (PDF, 403,5 Кб) // Соросовский образовательный журнал. 2001. Том 7. №7. Стр. 9–16.
3) Rebecca W. Scott, Michael F. Olson. LIM kinases: function, regulation and association with human disease // Journal of Molecular Medicine. 2007. V. 85. P. 555–568.
Дмитрий Кирюхин
Последние новости