Транспозоны необходимы для нормального развития эмбриона

Открытая недавно молекулярная система, контролирующая активность мобильных генетических элементов (МГЭ) у животных, как выяснилось, выполняет еще одну важную функцию: на ранних этапах развития эмбриона она руководит уничтожением матричных РНК, доставшихся эмбриону от матери. Отключение этой системы, состоящей из нескольких белков и особых маленьких молекул РНК (так называемых пиРНК), ведет к грубым нарушениям развития зародыша дрозофилы. Поскольку пиРНК синтезируются на матрице МГЭ, можно заключить, что МГЭ необходимы для нормального развития эмбриона.
Исследование французских и американских ученых, результаты которого опубликованы на сайте журнала Nature, свело воедино две истории с недописанными концами, рассказанные ранее на «Элементах».
Первая история — об удивительном молекулярном механизме, который позволяет животным обуздывать активность МГЭ (транспозонов и ретротранспозонов) во время созревания половых клеток. В основе этого механизма лежит особый класс малых регуляторных РНК — так называемые пиРНК — и несколько специализированных белков (Piwi, Aub, Ago3 и ряд других). Эти белки образуют комплекс с пиРНК, который затем атакует молекулы матричной РНК (мРНК), считанные с МГЭ, и не дает им транслироваться (то есть служить матрицей для синтеза белка) или стимулирует их разрушение. Матрицей для синтеза пиРНК служат фрагменты самих МГЭ. Об этом рассказано в заметке У млекопитающих найдена система управления мобильными генетическими элементами, «Элементы», 11.05.2007. Там же говорилось и о том, что у пиРНК, очевидно, есть и какие-то другие, пока неизвестные функции.
Вторая история, рассказанная в заметке Нужны ли эмбрионам гены («Элементы», 08.05.2007), связана с загадочным переломным моментом в развитии эмбрионов животных — так называемым «материнско-зиготическим переходом» (maternal-zygotic transition, MZT). На ранних этапах развития эмбриона его собственные гены еще не работают, а белки синтезируются на матрице молекул РНК, считанных заранее с генов матери. В определенный момент эти материнские мРНК уничтожаются, и эмбрион начинает производить свои мРНК и синтезировать на их основе белки, закодированные в его собственных генах. Этот переход с материнских мРНК на свои собственные и называется MZT. Его механизмы остаются во многом неясными.
Ранее было показано, что в уничтожении материнских мРНК принимают участие микро-РНК (миРНК), кодируемые геномом эмбриона. Что касается пиРНК, то они, как было известно, активно синтезируются в половых клетках и потому в большом количестве достаются эмбриону от матери. Авторы решили проверить, не играют ли эти «материнские» пиРНК, считанные с генов матери, какой-то роли в уничтожении материнских мРНК. Работа проводилась на дрозофилах.
Исследователи сосредоточили свои усилия на материнских мРНК, считанных с гена nanos. Это важнейший морфоген, участвующий в «разметке» зародыша и определении его передне-задней полярности. Изначально мРНК nanos распределяются равномерно по всему эмбриону, но уже в первые часы развития они уничтожаются везде, кроме заднего полюса зародыша. Тем самым создается передне-задний градиент концентрации белка Nanos, который синтезируется на матрице этих материнских мРНК. Там, где этого белка меньше всего, у зародыша формируется голова.
Процесс деградации мРНК nanos начинается очень рано, когда геном зародыша еще не заработал и миРНК еще не начали синтезироваться. А пиРНК присутствуют в зародыше с самого начала (ведь они достаются ему от матери). Может быть, именно они и отвечают за самые ранние этапы уничтожения материнских мРНК?
Было известно, что в уничтожении материнских мРНК, в том числе мРНК nanos, участвуют белки CCR4, Smaug и некоторые другие. Соединившись в так называемый деаденилазный комплекс (deadenylase complex), эти белки присоединяются к мРНК и разрушают ее полиадениловый «хвост» — последовательность из нескольких сотен нуклеотидов А (аденозинов), которая имеется почти у всех нормальных молекул мРНК (см. Polyadenylation). Разрушение хвоста является первым этапом уничтожения молекулы мРНК.
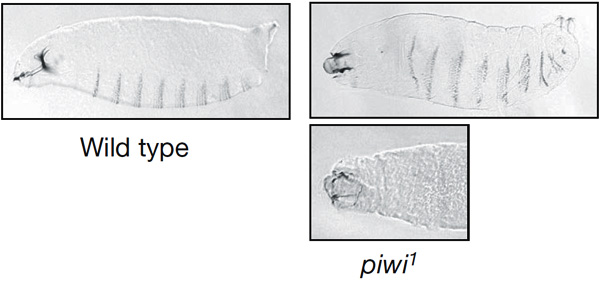
При помощи множества генно-инженерных и иных экспериментов авторам удалось показать, что пиРНК и взаимодействующие с ними белки Piwi, Aub и Ago3 действительно необходимы для своевременного уничтожения мРНК nanos. Если у мухи отключить систему пиРНК (например, путем выведения из строя гена, кодирующего один из ключевых белков этой системы — Aub или Piwi), то в яйцах, отложенных такой мухой, развитие эмбрионов будет нарушено. У таких эмбрионов не происходит своевременного уничтожения мРНК nanos в передней и средней части тела, и белок Nanos начинает синтезироваться равномерно по всему эмбриону (а не только на его заднем конце, как должно быть в норме). В конечном итоге это приводит к тому, что у эмбриона на том месте, где должна быть голова, либо вообще ничего не развивается, либо развивается нечто причудливое и на голову мало похожее. Разумеется, такие эмбрионы не выживают.
Дальнейшие исследования показали, что в нетранслируемой (регуляторной) части мРНК nanos имеются два участка, комплементарные двум известным пиРНК, которые считываются с ретротранспозонов roo и 412. Если удалить эти маленькие участки из гена nanos, процесс уничтожения мРНК nanos в эмбрионе нарушается. Выяснилось, что эти две пиРНК, присоединенные к белкам Aub, прикрепляются к двум вышеупомянутым маленьким участкам мРНК nanos и тем самым указывают деаденилазному комплексу, что эту мРНК нужно уничтожить (см. рисунок).
Авторы получили также менее детальные, но достаточно убедительные данные по другим материнским мРНК, из которых следует, что разнообразные пиРНК, по-видимому, участвуют в их уничтожении.
Таким образом, для выведения из строя материнских мРНК на ранних этапах развития эмбриона используется та же технология, основанная на пиРНК, что и для обезвреживания мРНК мобильных генетических элементов во время созревания половых клеток. Можно предположить, что первичной функцией пиРНК была борьба с МГЭ (поскольку сами пиРНК считываются с МГЭ), а затем этот молекулярный механизм был приспособлен и для регуляции раннего развития эмбриона. Для этого, очевидно, нужно было дождаться, чтобы в регуляторных областях определенных генов в результате мутаций появились короткие участки, комплементарные каким-нибудь из имеющихся пиРНК. Впрочем, детали эволюционного происхождения этой регуляторной системы пока неясны. Неизвестно также, характерна ли такая система регуляции развития только для насекомых или она более широко распространена в животном царстве.
Поскольку пиРНК считываются с МГЭ, или, иными словами, фрагменты МГЭ функционируют в качестве генов пиРНК, можно заключить, что МГЭ (по крайней мере, ретротранспозоны roo и 412) играют весьма важную роль в эмбриональном развитии дрозофилы. Таким образом, это яркий пример «молекулярного одомашнивания» — появления полезной функции у «эгоистических» мобильных генетических элементов. Другие примеры молекулярного одомашнивания описаны в заметках: Растения заимствуют гены у «геномных паразитов», «Элементы», 26.11.2007; Наездники подавляют иммунную защиту своих жертв при помощи прирученных вирусов, «Элементы», 19.02.2009; Предки человека заимствовали полезные гены у вирусов, «Элементы», 22.10.2008.
Источник: Christel Rouget, Catherine Papin, Anthony Boureux, Anne-Cécile Meunier, Bénédicte Franco, Nicolas Robine, Eric C. Lai, Alain Pelisson, Martine Simonelig. Maternal mRNA deadenylation and decay by the piRNA pathway in the early Drosophila embryo // Nature. 2010. Published online 17 October 2010.
См. также:
1) У млекопитающих найдена система управления мобильными генетическими элементами, «Элементы», 11.05.2007.
2) У низших животных обнаружены системы управления генами и транспозонами при помощи малых РНК, «Элементы», 03.10.2008.
Последние новости