Неорганическая химия — основа новых материалов
Юрий Дмитриевич Третьяков,
академик РАН
«Химия и жизнь» №5, 2007
Большая часть знаний, на которых базируется неорганическая химия, получена довольно давно, но во второй половине прошлого века она вдруг оказалась в тени фантастических достижений органической химии и химии живых систем. Практически у всех создалось ощущение, что неорганическая химия — в глубоком застое. Этому в немалой степени способствовали и университетские профессора, излагавшие предмет почти в неизменном виде на протяжении десятилетий. Между тем ситуация в последние годы существенно переменилась. Интенсивное развитие электроники, фотоники, сенсорики и спинтроники потребовало новых материалов со специальными свойствами, что привело к ренессансу неорганической химии.
Кстати, неорганика вообще гораздо сложнее органической химии. Последняя — это фактически химия одного элемента, а у неорганики их в арсенале почти сто. Именно это дает простор для создания самых разных материалов с разными свойствами.
В Периодической системе элементов уже почти исчезли «застойные» зоны, практически все элементы активно применяются в новых материалах. Пример тому — использование самых молодых (по времени открытия) химических элементов, таких, как рений, технеций и франций, не говоря уже о плутонии, америции и других актинидах.
Переход от химических элементов к материалам исключительно сложен, здесь не помогают даже методы комбинаторной химии, поскольку возможно множество сочетаний различных химических элементов. Например, только для элементов, имеющих стабильные изотопы, таких сочетаний больше 7·1023. Это число увеличится на много порядков, если учесть, что большинство современных материалов создают, используя метастабильные состояния веществ. Дело в том, что 99,9% неорганических материалов находятся в неравновесном состоянии, то есть с ними что-то происходит во времени (например, металл окисляется). Этот процесс превращения может быть очень медленным, поэтому кажется, что материал стабилен и неизменен. Чем отличается стабильное состояние от метастабильного? Если зафиксировать все параметры, которые характеризуют состояние системы, то только одно-единственное будет термодинамически стабильным, а множество других — метастабильными. Таких метастабильных состояний бесконечно много даже для одного вещества, имеющего фиксированный состав, а свойства у этих состояний разные.
В этой ситуации метод случайного перебора композиций не может быть эффективным — надо с умом использовать закономерности неорганической химии. К сожалению, несмотря на славные традиции ее развития в России, в последние 10–20 лет фронт отечественных исследований значительно сузился из-за крайне ограниченных экспериментальных возможностей многих научных групп (нет современных электронных микроскопов, синхротронных источников излучения, сквид-магнетометров, ЯМР-спектрометров высокого разрешения и т. д.). Это тем более печально, что в прошлом российские ученые внесли существенный вклад в развитие неорганической химии, — достаточно вспомнить Д.И. Менделеева, И.С. Курнакова, Л.А. Чугаева, И.И. Черняева, а также А.В. Новоселову, И.В. Тананаева, В.И. Спицина.
Мы не будем пытаться охватить все направления современной неорганической химии, а ограничим круг научных проблем опытом, накопленным на кафедре неорганической химии химического факультета и на факультете наук о материалах МГУ за последние годы. Несмотря на неизбежную субъективность, этот выбор дает достаточно полное представление о современной неорганической химии. Возьмем только основные направления: химия ионных и молекулярных прекурсоров; кристаллохимический дизайн новых неорганических соединений; неорганическая супрамолекулярная химия; химия соединений переменного состава; химия элементов в аномальных степенях окисления; неорганическая химия биоматериалов; неорганический синтез материалов с использованием различных физических воздействий.
Химия прекурсоров
Прекурсор — это предшественник, а точнее, обычное в неорганике обозначение исходного вещества, вступающего в реакцию. Конечная цель исследователей — не синтез соединений, а создание на их основе материалов с определенным комплексом свойств. Свойства же материала зависят от его структуры. Ну, это понятно в общем смысле, а если копнуть глубже, то оказывается, что у каждого материала есть несколько уровней структуры, которые связаны между собой, и все они влияют на свойства материала.
Первый уровень структуры — кристаллический. Это структура на атомном и ионном уровне организации вещества, то, как расположены ионы, атомы или молекулы в кристаллической решетке относительно друг друга. Следующий уровень — более удаленный от атомного состояния, он связан с присутствием в твердом теле различных линейных дефектов. Третий уровень — это макроскопические дефекты (например, поры), которые возникают в твердых телах в процессе их формирования или использования.
Одно дело, когда у нас в руках монокристалл — в нем кристаллический порядок повторяется во всем объеме. Но чаще всего мы имеем дело с поликристаллическими телами, то есть такими, которые состоят из маленьких кристалликов (кристаллитов), по-разному ориентированных друг относительно друга. Здесь возникают дополнительные дефекты (дислокации, границы между кристалликами, поры, трещины), которые вносят важный вклад в формирование свойств. Например, железо, если его получить в виде монокристалла, будет в химическом отношении совершенно инертно. А если железо получить разложением карбонила или оксалата железа, то это будет поликристаллический материал, который сразу сгорает на воздухе, образуя оксиды. И то и другое — железо, а ведут они себя совершенно по-разному.
Чтобы управлять зависимостью свойств от уровней структуры, надо, чтобы исходные вещества были в определенном состоянии. А этого не всегда просто достичь. При получении многих материалов неэффективен, казалось бы, самый простой твердофазный синтез, который широко использовали раньше для получения магнитных диэлектриков и пьезокерамики. Например, марганец-цинковые ферриты синтезировали, осуществляя реакцию:
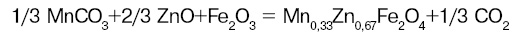
Оказалось, что традиционные механическое перемешивание, прессование смеси реагентов и их высокотемпературный обжиг (1200°С) во многих случаях не дают однофазного продукта. При повышении температуры теряется летучий оксид цинка и происходит диссоциация оксида железа (III). Все это изменяет состав и существенно ухудшает свойства материала.
Шаг вперед — использование в качестве исходных реагентов твердых солевых растворов. Как показали наши исследования, наиболее удобны для этого соли типа шенитов — M2+A+(RO4)2·6Н20 (М = Mg, Mn, Ni, Co, Fe, Cu, Zn; A — щелочной металл или NH4+, R = S, Se, Те) или квасцов A+M3+(SO4)2·12Н20 (А — щелочной металл или NH4, М = Fe, Cr, Со).
Теперь сделаем маленькое отступление и поясним, что такое твердые солевые растворы. Для примера возьмем более простую соль, например NaCl. Если растворить хлорид натрия в воде, а потом понизить температуру, то раствор станет пересыщенным и выпадет осадок. Если мы в этот же раствор добавим еще и KCl, то из раствора по мере понижения температуры выделятся не индивидуальные соли NaCl и KCl, а кристаллиты твердого раствора. В твердом растворе, также как и в жидком, вещества смешаны на атомном уровне — в этом его ключевое отличие от механической смеси кристаллов.
Твердые растворы широко используют в металлургии. Известно, что железо в процессе получения из руды растворяет углерод. Если железо не содержит углерода, то оно мягкое и пластичное, если углерода 1% — это прочная сталь, а если 4% — хрупкий чугун. Для любого человека это совершенно разные материалы, а для химика — твердый раствор железа с различным содержанием растворенного углерода. Другой пример — когда в меди растворяют олово и получается бронза. В зависимости от того, какое количество олова содержится в сплаве, материал будет иметь совершенно разные механические и прочностные свойства, и даже звучание колокола, который делают из меди, будет совершенно разным.
Так вот, оказалось, что шениты и квасцы могут образовывать твердые растворы при любых соотношениях компонентов и имеют хорошую растворимость в воде, резко уменьшающуюся при охлаждении. Это так называемые ионные (поскольку в солях ионная связь) прекурсоры, или исходные реагенты. Целевой продукт — феррит получают с помощью термолиза:
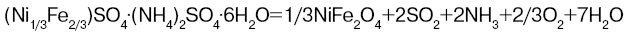
От того, в каких условиях проводится эта реакция, зависит, удастся ли получить поликристаллический материал с нужной керамической структурой и свойствами.
Несколько позже появилась криохимическая технология получения твердых солевых растворов, основанная на сбалансированном сочетании нагрева и охлаждения. Прежде чем применять новую технологию, надо было подробно изучить фундаментальные процессы криокристаллизации, сублимационного обезвоживания, криоосаждения, криоэкстракции и криодиспергирования. Криохимический синтез солеобразных исходных реагентов стал основой получения самых разных функциональных материалов. Например, высокопрочной керамики, пигментов, сорбентов, катализаторов и многого другого.
Важная особенность солеообразных ионных прекурсоров — так называемая топохимическая память, то есть способность помнить свое происхождение и передавать эту информацию в последующих реакциях, которые так и называются — топохимическими. Скорее всего, эту информацию в твердом теле хранит реальная структура, сформированная, как правило, в неравновесных условиях. В дальнейшем это сильно влияет на свойства функциональных материалов (особенно тех, которые получают в форме поликристаллической керамики).
Очень важны и интересны исследования молекулярных прекурсоров (исходных реагентов). Их используют, например, для создания тонкопленочных материалов методом молекулярного наслаивания. Известно, что уже давно назрела необходимость увеличить плотность записи информации в кремниевых микросхемах, а для этого придется заменить SiО2 на оксиды с большей величиной диэлектрической константы. Среди наиболее вероятных претендентов оказались НfO2, ZrO2, Ln203 (лантан и другие редкоземельные элементы). Чтобы получить пленки таких оксидов на поверхности кремния, надо создать исходные реагенты с высокой летучестью и относительной термической стабильностью, которые смогут легко гидролизоваться (или вступать в другие реакции разложения) с образованием аморфных оксидов на поверхности кремния. В лаборатории координационной химии МГУ синтезировали новые молекулярные прекурсоры на основе насыщенных комплексов металла с лигандами, образующими относительно слабые донорно-акцепторные связи.
Комплексы с органическими лигандами использовали и для решения другой важнейшей проблемы — получения термозащитных покрытий на лопатках газотурбинных двигателей. Оказалось, что лучше всего покрытия, полученные осаждением ZrO2 (Y2O3) из паров бета-дикетонатов соответствующих металлов. Процесс недорогой, поскольку можно использовать недорогой ацетилацетат. То, что полимерный Y(AcAc)3 недостаточно летуч, легко устраняется его совместным испарением с летучим Zr(AcAc). — при этом испарение происходит гораздо полнее.
Кристаллохимический дизайн
Сотрудники кафедры неорганической химии МГУ разработали концепцию структур срастания и использовали ее для поиска новых материалов. Что такое структуры срастания?
Например, возьмем кристалл WO3. Его стабильная модификация (со структурой типа ReO3) получается в результате сочленения октаэдров, так что они имеют только общие вершины и больше ничего общего у них нет. Если представить, что одна часть структуры смещается относительно другой, то тогда общими становятся не только вершины, но и грани. Такое смещение происходит при переходе к нестехиометрическим составам. Практически это делают следующим образом. В WO3 на каждый атом вольфрама приходится три атома кислорода. Если отжигать такой кристалл при пониженном давлении кислорода, то он частично восстанавливается, теряя какую-то часть кислорода и сохраняя при этом кристаллическую структуру (на такое восстановление способны не все оксиды, например оксид никеля восстанавливается скачком, изменяя состав с образованием металлического никеля). Структура срастания — это фаза с нестехиометрическим соотношением атомов, и ее можно представить как сдвиг одной части кристаллов относительно другой. Этот сдвиг повторяется через определенное число октаэдров, а увидеть его можно на электронных микроскопах высокого разрешения. Надо отметить, что структуры срастания оказались стабильны в довольно широком диапазоне температур.
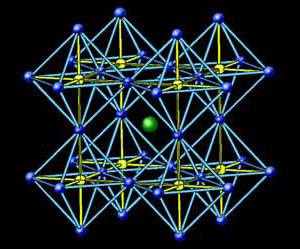
Концепция структур срастания показала себя очень эффективной при синтезе новых высокотемпературных сверхпроводников на основе сложных оксидов меди. В них входит перовскит (ABO3) или его фрагмент, который становится одним из блоков структур срастания (рис. 1). Новые сверхпроводники синтезировали, перебирая различные структуры, подобно тому как это делается при синтезе органических соединений. Но в данном случае надо было рассматривать не изолированные группы атомов, как в органических молекулах, а бесконечные двумерные слои, объединенные в блоки.
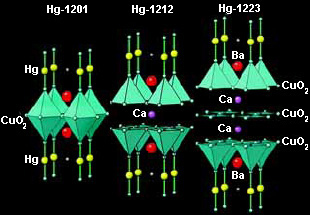
Такое кристаллохимическое моделирование позволило Е.В. Антипову и С.Н. Путилину (кафедра неорганической химии МГУ) спрогнозировать существование и синтезировать новое семейство (рис. 2) сверхпроводников HgBa2
Принципиально новый подход к дизайну новых материалов (разработан А.Р. Каулем с сотрудниками) — эпитаксиальная стабилизация неустойчивых оксидов в виде тонких пленок. Эпитаксия — это когда одно вещество удается кристаллизовать на поверхности другого, заставляя его принять ту структуру, которую имеет подложка. Матрица как бы навязывает пленке свое строение.
Так, ученые МГУ синтезировали новые соединения RBО3 (R — редкоземельный элемент, В = Ni, Co, Mn, Fe, In) с различными свойствами: сегнетоэлектрики (RFeО3 и RMnО3), материалы с переходом «металл—диэлектрик» (RNiО3, RCоО3) и магнитные материалы (R3Fe5O12). Оказалось, что эпитаксиальную стабилизацию можно с успехом использовать в производстве тонкопленочных материалов для микроэлектроники.
Конечно, конструирование функциональных материалов не сводится только к кристаллохимическому дизайну. Можно использовать систему физико-химических принципов, достаточно давно сформулированных автором этой статьи. Ее с успехом применили для оптимизации свойств ферритов, магнитных полупроводников, электронно-ионных проводников, керамических электролитов, пьезокерамики и т. д.
Неорганическая нано- и супрамолекулярная химия
Интерес к наноматериалам связан, в частности, с их необычными физическими свойствами. Принято, что наноматериалы, в отличие от обычных материалов, состоят из частиц меньше 100 нм — именно в этой области происходит резкое изменение свойств. Например, уменьшение размеров полупроводниковых частиц ниже некоторого критического значения может привести к изменению ширины запрещенной зоны, генерации второй гармоники, эффектам размерного квантования энергетических уровней. При этом, наверное, самая большая проблема — предрасположенность свободных наночастиц к агрегации: это сильно затрудняет их практическое применение. Один из путей решения этой проблемы — нанести наночастицы на инертную матрицу, которая защитит их от воздействия окружающей среды и предотвратит агрегацию. Методами получения таких нанокомпозитов тоже занимается неорганическая химия.
Как матрицу для нанокомпозитных материалов можно использовать кремнеземы. Их большое преимущество — высокоупорядоченные поры с диаметром от 20 до 100 А. Пористых материалов много, но кремнеземы в своем роде уникальны, поскольку у них довольно однородное распределение пор по размерам, а также очень высокая удельная поверхность (1000 м2/г). Пористый SiO2, можно использовать как матрицу для синтеза наночастиц металла, полупроводниковых соединений, а также полианилиновых и углеродных волокон.
Cl (получен высокотемпературным синтезом. Изображение: «Химия и жизнь»](images/eltpub/neorg_chem_5.jpg)
Сегодняшний этап развития неорганической супрамолекулярной химии — это супрамолекулярные ансамбли, обладающие благодаря особенностям архитектуры особыми свойствами. Их строение определяется структурой каркаса «хозяина», а функциональные свойства — природой «гостя». Возьмем, к примеру, полупроводниковые клатраты. У них в полостях каркаса «хозяина» размещены атомы «гостя» с координационными числами 20 и 24. Гостевые атомы не связаны с каркасом ковалентными связями и могут колебаться с такими частотами, которые обеспечивают эффективное рассеяние теплопроводящих фононов. У таких материалов очень низкое (как у стекол) значение теплопроводности. В то же время каркас обеспечивает высокие концентрацию и подвижность носителей заряда. Все это делает клатраты перспективными веществами для создания термоэлектрических материалов.
Новое направление неорганической супрамолекулярной химии исследует контролируемую самосборку упорядоченных супрамолекулярных ансамблей в высокотемпературных реакциях, когда реакционная система сложна и не поддается анализу. Основой для таких процессов служит взаимная подстройка «гостя» и «хозяина». Первый служит шаблоном для формирования каркаса определенной топологии и геометрии, но при этом и сам изменяет свои параметры, подчиняясь требованиям «хозяина». Пример — структура [Hg6P4](TiCl6)Cl, сформированная за счет самосборки TiCl63– и Сl– в полостях каркаса [Hg6P4]4+ (рис. 3).
Соединения переменного состава
Соединения переменного состава открыл более 100 лет назад Н.С. Курнаков и назвал их бертоллидами. Позднее оказалось, что практически все неорганические твердофазные соединения с ионным типом связи имеют непостоянный состав. Возьмем, к примеру, поваренную соль NaCl. Кажется, что это соединение постоянного состава, а на самом деле — переменного. Причем его кристаллическая структура будет сохраняться, даже если на один атом натрия придется больше (или меньше), чем один атом хлора. И хотя отклонение состава от стехиометрического очень невелико (порядка 10–5–10–7), это уже влияет на свойства вещества и потому становится очень важным в науке о материалах. Например, бесцветный (и стехиометрический) NaCl, обработанный парами натрия при высоких температурах, станет голубым и начнет проводить электрический ток. Если NaCl обработать парами хлора, то он позеленеет и тоже станет проводником, но не за счет движения электронов, а за счет подвижных дырок. Выходит, что можно получать вещества с различными свойствами, не изменяя кристаллической структуры.
В зависимости от элементов, которые входят в состав соединений переменного состава, область их существования может быть широкой (моноксиды титана и железа) или, наоборот, крайне узкой (галогениды щелочных металлов, халькогениды цинка, свинца, кадмия). Если отклонения от стехиометрии невелики, то такой материал можно описывать как модель с точечными дефектами или внедренными атомами, не взаимодействующими друг с другом. Когда степень нестехиометрии возрастает, изменения, происходящие в кристаллах, имеют другую природу (например, образуются ассоциаты). Подробным исследованием структуры таких соединений занимаются многие исследователи, но тут пока не все ясно.
Есть немало систем с так называемой бесконечно адаптируемой структурой. Они сохраняют свою структурную организацию при непрерывном изменении состава и без участия точечных дефектов. Способностью адаптироваться, как оказалось, обладают фазы переменного состава Y(OF)2,13–2,22 и твердые растворы ТiO2(Cr2O3).
Все уже полученные знания в этой области можно применить к любым вновь созданным материалам: сверхпроводящим купратам, манганитам с колоссальным магнитным сопротивлением или цератам с высокой протонной проводимостью. Но каждый из них имеет собственную специфику и потому требует проведения собственных исследований нестехиометрии.
Именно среди таких соединений с переменным составом удалось найти сверхпроводящий материал, сохраняющий высокий уровень критических токов в сильных магнитных полях, — например, неодим-бариевый купрат Nd1–xBa2–xCu3Oz.
А вот иттрий-бариевый купрат YBa2Cu3Oz со строгой катионной стехиометрией такими свойствами не обладает.
Элементы в аномальных степенях окисления
Идея создавать новые материалы на основе элементов в необычных степенях окисления пока кажется довольно странной. Очевидная причина — аномальная степень окисления равносильна нестабильному состоянию этого элемента. Получать подобные материалы можно только в том случае, когда такой необычный элемент существует достаточно долго. Но тем не менее исследования эти необычайно интересны.
Большой вклад в химию элементов, находящихся в аномальной степени окисления, внесли исследователи из Института физической химии РАН и химического факультета МГУ. Они получили NpVII, PuVII, AmVII, CmVI, CmV, серию актинидов и лантанидов в низших степенях окисления, показали возможность существования TmIV.
С точки зрения материаловеда, наиболее интересны «матричные» системы. Их получают кристаллизацией из раствора или расплава, соосаждением или твердофазным синтезом. Так удалось синтезировать матричные системы, содержащие Fe(IV), Fe(V), Fe(VI) и Co(VI). Возможен и другой путь синтеза — когда легирующий ион замещает металл в матрице, свойства которой предопределяют состояние окисления этого легирующего иона. Так, в пентаоксиде ванадия стабилизируется Fe(V), причем это необычное окислительное состояние возникает просто при растворении в расплаве пентаоксида ванадия оксида трехвалентного железа. Правда, реально получить Fe(V) удалось только после быстрой закалки образцов. Известны также соединения висмута в низших степенях окисления (Bi53+, Bi85+ и Bi95+) и никеля.
Со всеми подобными соединениями очень трудно работать, поскольку они малостабильны. Свойства их почти не изучены, и не очень понятна перспектива их применения.
Неорганические биоматериалы
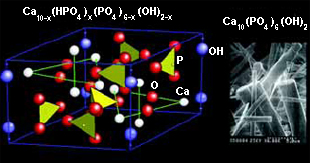
У таких, казалось бы, прочных природных материалов, как костная и зубная ткани, тем не менее постоянно появляются проблемы. Кость, с точки зрения материаловеда, — это композиционный материал, состоящий из гидроксилапатита Ca10(PO4)6(OH)2 (63% вес.) и белка коллагена (20% вес.) (рис. 4). Кроме того, в кости есть заметные количества ионов Na+, Mg2+, К+, Сl–, F–, СО32–. Что обеспечивает высокую прочность кости, так до конца и непонятно. Поэтому даже самыми современными методами пока невозможно создать полный аналог костной ткани. Единственная альтернатива — имплантаты.
Когда требуется восстановить участки, подверженные серьезным циклическим нагрузкам (например, тазобедренный сустав), используют металлические сплавы на основе малотоксичного титана. В остальных случаях предпочитают более похожую по составу на кость керамику или композиты с фосфатом кальция. Современная тенденция — «регенерационный» подход, то есть создание и использование материалов, которые взаимодействуют с организмом и стимулируют восстановление ткани. Такие имплантаты невозможно создать без глубокого понимания физиологических процессов.
Считают, что важен не только химический состав, но и структура кристаллов гидроксилапатита, поскольку это определяет отклик организма на чужеродный материал. С этой точки зрения идеально вещество, во всем подобное костному биоминералу. Этого добиться очень сложно, тем более в промышленных масштабах. Тем не менее химическое и структурное соответствие биоматериала костной ткани — один из основных принципов в этой области. Варьируя эти параметры, можно делать биоматериалы с заданной биоактивностью.
Синтез, модификация и исследование фосфатов кальция с заданным составом и микроморфологией, оценка их будущей биоактивности — большая и неординарная задача для химиков. Уже известно, как образуется и гидролизуется гидроксилапатит. Увеличить его биологическую активность можно двумя путями: уменьшить размеры кристаллов (благодаря чему увеличивается удельная поверхность) и изменить физико-химические характеристики поверхности, то есть химически ее модифицировать. При втором подходе возможно создать материалы, которые активно рассасывались бы при контакте с жидкостями организма. Перспективными считают карбонатсодержащий гидроксилапатит Ca10–0,5x(PO4)6–x(CO3)·(OH)2, а также кремнийсодержащий гидроксилапатит:
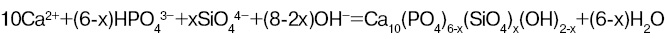
То, что после полувекового активного применения биоматериалов исследователи пытаются сделать такой, который бы стимулировал регенерацию костной ткани, означает, что пришло понимание исключительной сложности задачи. Применение того или иного материала зависит и от характеристики костного дефекта, и от конкретного клинического случая. Поэтому надо иметь целый спектр искусственных заменителей, чтобы можно было выбрать то, что подходит конкретному больному.
Синтез с помощью физических воздействий
Каков бы ни был механизм химических превращений, чтобы они начались, смесь надо активизировать. Самое простое — нагрев, эффективность которого можно оценить величиной энергии активации в уравнении Аррениуса. Однако эта величина (ее можно экспериментально определить как температурный коэффициент скорости реакции) имеет физический смысл только тогда, когда ее можно связать с определенным элементарным процессом, лимитирующим реакцию в рассматриваемом температурном диапазоне.
В реальных же синтезах материалов химическое взаимодействие складывается по меньшей мере из двух фундаментальных процессов — собственно химической реакции и переноса вещества к реакционной зоне. Поскольку последний процесс зависит от диффузии, а в твердом теле подвижность составных частей определяется дефектностью его структуры, то в результате дефекты существенно влияют на условия твердофазного синтеза. А значит, скорость и направление химической реакции можно изменять с помощью различных физических воздействий (с нагревом или без). Нагрева как раз пытаются избежать, поскольку могут происходить нежелательные изменения.

Начнем с ультразвука. Его эффективность зависит от фазового состояния системы. Если это жидкость (растворы, расплавы), то после ультразвукового воздействия происходит кавитация, то есть возникновение, осцилляции и коллапс микропузырьков. В результате формируются короткоживущие «горячие зоны», с температурой до 5000 К и давлением до 1000 атм. В некоторых случаях после схлопывания кавитационных пузырьков возникают интенсивные микропотоки жидкости и мощные локальные ударные волны, которые ускоряют массоперенос. Как следствие — разлагаются летучие соединения (карбонилы металлов), ускоряются окислительно-восстановительные реакции, образуются стабильные эмульсии и суспензии. Оказалось, что ультразвук очень эффективен в жидкофазных системах при проведении классических реакций неорганического синтеза, а также при получении нанопорошков металлов, оксидов и карбидов.
Если реакция идет в твердой фазе, то ультразвук увеличивает плотность дислокаций и эффективные коэффициенты диффузии, а также способствует новым межфазным контактам. Возможно даже, что изменится механизм реакции и снизится температура взаимодействия реагентов. Акустическая активация процессов в твердой фазе дала возможность синтезировать оксидные материалы, получить активные формы исходных реагентов, а иногда и направленно изменять конечные свойства продуктов.
В последние 10–12 лет исследователи предпринимали немало попыток микроволнового синтеза и спекания материалов. Но между тем физико-химическая природа происходящих при этом процессов так и осталась малоизученной. Микроволнами обрабатывали разнообразные оксиды, гидроокиси, соли или их смеси друг с другом, получая при этом самые разные материалы — ферриты, манганиты, кобальтиты, никелаты и купраты.
Согласно теории, для того чтобы микроволновое излучение взаимодействовало с веществом и последнее поглощало энергию, нужно, чтобы в нем были либо диполи, способные переориентироваться и вращаться под микроволновым воздействием, либо свободные носители зарядов, которые могут перемещаться при наложении микроволнового поля. Многие неорганические соли имеют низкую проводимость, а с другой стороны, у молекул воды в кристаллогидратах, а также у некоторых анионов есть значительный дипольный момент. Поэтому в большинстве солевых систем поглощение микроволнового излучения, вероятнее всего, связано с диполями.
Экспериментально известно, что соединения, не содержащие химически связанной воды (карбонаты, нитраты, оксалаты щелочных и щелочно-земельных элементов), практически не поглощают микроволнового излучения. Напротив, кристаллогидраты неорганических солей взаимодействуют с микроволновым полем (рис. 5), причем то, как это происходит, зависит от химической природы катионов. В итоге — микроволновая обработка смеси солей довольно эффективна, поскольку после их разложения образуются высокодисперсные частицы оксидов, равномерно распределенные по реакционному объему, которые активно взаимодействуют друг с другом. Кроме того, при микроволновой обработке смеси не только увеличивается скорость реакции, но и понижается температура взаимодействия — это также наблюдали экспериментально.
Заключение
За последние два десятилетия неорганическая химия разительно изменилась благодаря тесному взаимодействию с физической химией, физикой твердого тела, органической химией, биохимией, а также применению современных инструментальных методов исследования. Необыкновенно расширился круг объектов неорганической химии. К ним теперь причисляют не только соединения, но и материалы, причем помимо неорганической составляющей они часто содержат органические, полимерные или биополимерные фрагменты.
Большинство объектов изучают на нескольких уровнях — кроме кристаллической или молекулярной структуры исследуют электронную и магнитную, структуру дефектов кристаллического строения, распределение микропримесей, структуру границ раздела в поликристаллических веществах, наноструктуру, структуру микро- и мезопор, поверхностей, а также влияние всех перечисленных уровней на свойства вещества. О каком кризисе можно говорить, когда перед химиками столь обширное поле деятельности?
То, что было упомянуто в статье, — далеко не все научные направления неорганической химии. Более того, здесь затронуты даже не все объекты, которые изучают на кафедре неорганической химии химического факультета и на факультете наук о материалах МГУ. Мы не рассказали о неорганических материалах для газовых сенсоров; барьерных материалах; люминесцентных нанокомпозитах на основе AIVBVI; низкоразмерных структурах и сверхрешетках; новых поколениях полупроводников и полупроводниковых гетероструктур; кислородпроводящих мембранах и твердых электролитах; материалах для литиевых источников тока; магнитных нанокомпозитах на основе стекломатриц; фотонных кристаллах; керамических пигментах на основе гидроксиапатитов и многом другом, чем активно занимаются исследователи в МГУ и за его пределами.












