Фридрих Август Кекуле
Марина Молчанова
«Квантик» №10, 2023

В статье про Джона Дальтона «Сделано из атомов» («Квантик» №7 за 2021 год) мы уже рассказывали об атомной теории строения вещества. Она была создана в начале XIX века и быстро распространилась: к середине века весь учёный мир знал, что химические соединения построены из атомов. Оставалось понять — а как именно построены? Особенно загадочными были те соединения, которые изучает органическая химия.
В XVIII веке считалось, что между веществами неживой и живой природы есть непреодолимая граница: как писали в ту пору, «ни животные, ни растительные тела, ни их части не могут быть воспроизведены химическим искусством». А значит, должны быть две разные химии. Неорганическая изучает всё, что можно получить из минералов, воды, воздуха. А органическая — то, что можно выделить из организмов, обладающих «жизненной силой». Что называется, природные дары.

Фридрих Вёлер (1800–1882)
Правда, уже в начале XIX века выяснилось, что резкой границы нет. Тогда молодой химик Фридрих Вёлер впервые синтезировал в лаборатории соединения, которые явно относились к органической химии: мочевину и щавелевую кислоту. Но всё же у органических веществ есть свои особенности. Например, такая: их молекулы часто состоят из большого или очень большого числа атомов. Как так может получаться? По каким правилам строятся эти сложные структуры?
Подробно ответить на эти вопросы удалось только в XX веке. Но первые важные шаги были сделаны именно в XIX — и связаны с именем Августа Кекуле.
* * *
Кекуле родился в немецком городе Дармштадте. При рождении он получил два имени: Фридрих Август. Но с первым именем у него не сложились отношения, и всю жизнь он именовался именно Августом. А ближе к концу жизни он был удостоен дворянского титула и стал Август Кекуле фон Штрадониц.

Юстус фон Либих (1803–1873)
Итак, Август Кекуле жил в семье чиновника и сперва даже не думал, что будет заниматься наукой. В восемнадцать лет он поступил в университет в городе Гисене, чтобы изучать архитектуру. Но вмешалась судьба: химию там преподавал профессор Либих.
Юстус фон Либих (1803–1873) был великим учёным, создавшим основы науки об удобрениях (и не только), и замечательным педагогом. И Кекуле, увидев и услышав Либиха в первый же свой студенческий год, поменял планы: теперь уже он связывал своё будущее только с химическими исследованиями.

Университет в Гисене ныне носит имя Юстуса фон Либиха
Так и вышло: после студенчества и краткой военной службы он занимался именно химией. Сперва за границей (Кекуле свободно владел английским и французским языками), потом в разных городах Германии.
И уже в 1857 — 1858 годах, в неполные тридцать лет, опубликовал статьи, впервые изложив основы своей теории химического строения. Её сейчас изучают в любом начальном курсе химии, да и сам Кекуле вскоре описал её в своём учебнике органической химии.

Марка к 150-летию со дня рождения Кекуле
Идеи Кекуле состоят в следующем. Во-первых, каждый атом может образовывать строго определённое число связей с соседними атомами — мы это называем валентностью. Для углерода валентность 4, для водорода 1, для кислорода 2 и так далее1.
Во-вторых, у атомов углерода есть уникальное свойство: они отлично связываются между собой, образуя длинные или разветвлённые цепочки. А к этому «углеродному скелету», каркасу молекулы, можно присоединять и атомы других типов: водород, кислород, азот, хлор... Таким образом природа способна создавать сколь угодно большие и сложные конструкции, а ведь именно это и нужно для органической химии. То есть основа органической химии — именно углерод.

Статья Александра Крума Брауна (1838 — 1922) с первыми структурными формулами
Кстати, если у каждой молекулы есть своя чётко известная структура, то отсюда один шаг до наглядных представлений. Можно нарисовать картинку, соединяя кружочки-атомы линиями — это структурная формула, именно их используют химики для изображения молекул. Число линий, отходящих от каждого атома, и есть его валентность. Первые такие картинки нарисовал в 1864 году шотландский химик Александр Крум Браун, сейчас мы обычно рисуем их чуть более упрощённо.
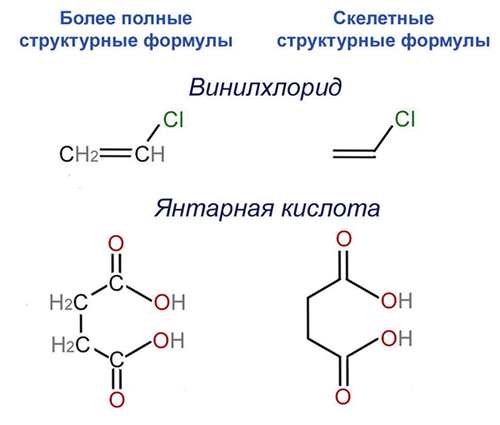
Так мы сейчас рисуем структурные формулы из статьи Александра Крума Брауна
А можно составить и пространственную модель из шариков и стержней — в 1865 году Август фон Гофман впервые показал студентам такие модели из разноцветных крокетных шариков и латунных трубок...
Александр Бутлеров (1828–1886), памятник в Казани. Фото автора
Одна только трудность: в XIX веке не было методов, позволяющих получить прямую информацию о строении тех или иных молекул. Поэтому некоторые химики критиковали использование структурных формул — что это за модели, если их правильность невозможно доказать? Но Кекуле был убеждён — и убедил других, — что эту информацию можно получить, хотя бы для относительно простых веществ.
Теория Кекуле довольно быстро стала общепринятой. Ведь фактически она позволила создать общий язык для химиков-органиков: вот вещество, а вот чёткая и понятная картинка, которая показывает, как оно устроено. Другие химики подхватили и развили идеи Кекуле — так, среди наших соотечественников особенно прославился профессор Казанского университета Александр Бутлеров. А физическое объяснение и понятия химической связи, и понятия валентности появилось уже в XX веке.

Арчибальд Скотт Купер (1831–1892)
Но в этой истории есть и печальная деталь. Почти одновременно с Кекуле сходные идеи выдвинул другой молодой химик — шотландец Арчибальд Скотт Купер.
В истории науки такое бывает: уж если условия для какого-то открытия созрели, то иной раз вопрос «кто первый» решается случайно... И Куперу не повезло: его идеи стали достоянием публики чуточку позже, чем идеи Кекуле. Причём по случайности: Шарль Адольф Вюрц, знаменитый французский химик, у которого Купер тогда работал (каждый, кто бывал в химической лаборатории, видел колбу Вюрца!), промедлил с представлением статьи Купера французским академикам, и эта задержка оказалась роковой. Произошла ссора, но было уже поздно. У Купера случился нервный срыв, и больше он наукой не занимался.
* * *

Шарль Адольф Вюрц (1817–1884)
Среди достижений Кекуле — а он был плодовитым учёным и великолепным педагогом — одно особенно широко известно. Рассмотрим его подробней: оно показывает, как можно попытаться судить о том, чего мы не видим, — в данном случае о структуре молекулы.
Одно из самых известных веществ в органической химии — бензол. Само по себе это вещество, впервые описанное Майклом Фарадеем в 1825 году, не так уж часто встречается в нашей жизни: это ядовитый растворитель с характерным запахом. Но одновременно это важнейшее сырьё для химической промышленности, и в огромном количестве веществ, которые химики называют «ароматическими» (ароматы у них, впрочем, не всегда приятные...), встречается та же структура, что и в молекуле бензола. А вот что это за структура, до Кекуле было неясно.
Сейчас известно, что в молекуле бензола 6 атомов углерода и 6 атомов водорода, это записывается как C6H6. Ещё мы знаем, что валентность углерода равна 4 (то есть из каждого атома углерода «выходит» по четыре палочки-связи), а валентность водорода — 1.
Наконец, мы знаем (во времена Кекуле это тоже было известно), что между двумя соседними атомами углерода может быть не одинарная, а двойная или тройная связь — сразу две или три палочки.
Получится у вас что-нибудь нарисовать, соблюдая эти условия? Только не заглядывайте сразу на следующую страницу, там приведено несколько вариантов. Задача не такая уж простая, если не знать нужный ответ заранее2. И Кекуле позднее утверждал, что ответ к нему пришёл во сне, точнее, в состоянии полудрёмы. Сначала на втором этаже омнибуса в Лондоне. Потом во время работы в городе Генте. Перед его закрытыми глазами (так рассказывал сам Кекуле) проносились атомы, образуя ряды. Эти длинные ряды атомов извивались как змеи. И вдруг одна змея ухватила себя за хвост, образовав кольцо!

Майкл Фарадей (1791–1867)
Иногда эту историю рассказывают и по-другому, хотя эта версия уже точно выдуманная — и даже не самим Кекуле. Якобы он увидел, как обезьян в клетке везут в зоопарк. Они сцеплялись лапами и хвостами, образуя... правильно, живые кольца.
Так или иначе, Кекуле пришла в голову формула, которую вы видите сверху: кольцо из атомов углерода, чередующиеся одинарные и двойные связи, к каждому атому углерода присоединён водород.
Но придумать формулу мало, тем более что похожие идеи возникали и у других химиков. Надо ещё показать, почему она лучше других.

Уроборос — древний символ, использовавшийся и алхимиками (рисунок из трактата 1478 года)
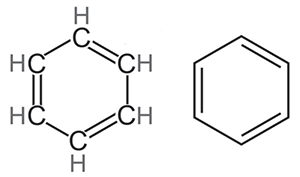
Бензол Кекуле. Обычная структурная формула и скелетная формула
Почему, например, не годятся формулы 1–4 на рисунке внизу страницы? Поставим химический эксперимент. Давайте за ме ним один из атомов водорода, например, на хлор (получится C6H5Cl, хлорбензол). Если водороды в исходной структуре «неравноправны», различимы между собой, то после этой процедуры могут получиться разные молекулы, а значит, разные вещества. А вот если молекула симметрична и все водороды полностью эквивалентны, то вещество будет одно. И действительно, известен только один-единственный хлорбензол!

Обезьяны и бензол (сатирическая картинка, 1886)

Ещё пять возможных структур для C6H6
Значит, молекула симметрична, все водороды одинаковы — вот и аргумент в копилку «за».

Три разных дихлорбензола. Есть ли четвертый?
Теперь попробуем заместить два водорода. Если заменить их опять же на хлор, получится C6H4Cl2, это называется дихлорбензол (сам Кекуле использовал чуть более сложные структуры, но тот же принцип). Таких веществ — с отчасти различающимися свойствами — известно три. И это тоже сочетается с формулой Кекуле: атомы хлора могут стоять либо при соседних атомах, либо через один, либо через два атома.

«Чередующиеся» формулы бензола, рисунок из статьи Кекуле
Хотя... позвольте! Ведь дихлорбензолов должно быть не три, а четыре! Потому что когда хлор стоит при соседних атомах, то между этими атомами может быть одинарная связь, а может быть и двойная!

Памятник Кекуле в Бонне
Неувязка. И Кекуле про неё знал. Поэтому позже он выдвинул идею: на самом деле в кольце бензола все связи одинаковы, потому что одинарные и двойные связи постоянно меняются местами. Таким образом, каждая связь частично одинарная, а частично и двойная. Это объясняет и другие химические особенности бензола. И хотя сейчас мы уже знаем, что фактически такого мелькания не происходит (см. статью «Лайнус Полинг. Среди химических связей» в «Квантике» №1 и 2 за 2020 год), как модель это очень даже неплохо. Даже сейчас мы, понимая всю условность модели, рисуем химические формулы бензола и родственных ему соединений именно с чередующимися связями — так, как делал это Кекуле.

Кекулен
В том числе так мы рисуем и вещество с формулой C48H24 под названием кекулен. Оно было синтезировано в 1978 году и названо в честь нашего героя. Вряд ли возможен лучший памятник для химика.
1 Сейчас мы знаем, что это не совсем так: многие атомы могут иметь разные валентности в разных ситуациях. Так что потом теорию Кекуле пришлось подправить.
2 Компьютерным перебором можно показать, что таких структур есть целых 217, хотя, понятное дело, не все они химически реализуемы.























Фридрих Август Кекуле (Friedrich August Kekulé von Stradonitz), 1829–1896