Тонкая химия жизни, или Нековалентные взаимодействия
Вадим Кукушкин,
академик
«Химия и жизнь» №3, 2025

В научном сообществе химиков есть замечательная традиция. Каждый год, начиная с 1941-го, Санкт-Петербургский государственный университет вместе с Российским химическим обществом проводит Менделеевские чтения. Проходят они, разумеется, в университете в Санкт-Петербурге, колыбели Периодического закона и Периодической таблицы Д. И. Менделеева. Именно здесь хранится главная святыня университета — первая в мире Периодическая таблица, созданная по указанию самого Дмитрия Ивановича. И каждый год химическое сообщество выбирает Менделеевского чтеца из числа выдающихся отечественных ученых, внесших весомый вклад в химию и смежные с ней науки. Менделеевский чтец задает тему, выступает с парадной публичной лекцией и проводит чтения.
За прошедшие 84 года Менделеевскими чтецами становились такие яркие, выдающиеся химики и физики, как А. Н. Несмеянов, Н. Н. Семенов, Г. А. Разуваев, А. Н. Фрумкин, В. А. Энгельгардт, В. А. Коптюг, М. Е. Вольпин, И. П. Белецкая, Ю. Ц. Оганесян, Ю. А. Золотов, В. Н. Пармон и многие другие. В прошлом году состоялись 78-е Менделеевские чтения, которые провел Менделеевский чтец, академик РАН Вадим Юрьевич Кукушкин. Свою лекцию он посвятил нековалентным взаимодействиям — особому типу химических связей, которые определяют важнейшие процессы в живой природе, от структуры белков до работы клеточных мембран. Сегодня Вадим Юрьевич рассказывает о нековалентных взаимодействиях читателям «Химии и жизни».
От кузнечного молота к камертону
История развития химии — это путь от изучения заметных и очевидных явлений к исследованию тонких и едва уловимых эффектов. В каком-то смысле древний кузнец был одним из первых химиков. Правда, он работал молотом, но тем не менее наблюдал явные превращения металлов и в буквальном смысле выбивал из металла ту структуру, которая была ему нужна. Со временем химики освоили более тонкие процессы — научились создавать новые соединения с помощью надежных и прочных ковалентных связей, где атомы обмениваются электронами. Вершиной этого мастерства стал тонкий органический синтез, позволяющий создавать сложнейшие молекулы.
Но наука пошла еще дальше, открыв мир нековалентных взаимодействий, мир очень слабых сил притяжения между молекулами: ван-дер-ваальсовы взаимодействия, водородные связи, галогенные связи, стэкинг. Хотя они в десятки раз слабее ковалентных связей и с трудом фиксируются внешним наблюдателем, эти взаимодействия управляют важнейшими процессами в живой природе. Например, белки принимают определенную форму благодаря водородным связям, а ДНК сохраняет свою знаменитую двойную спираль за счет водородных связей и стэкинга — особого притяжения между плоскими молекулами, укладывающимися друг над другом как колода карт.
Если ковалентную химию можно сравнить с работой кузнеца, который мощными ударами придает форму раскаленному металлу, то работа с нековалентными взаимодействиями напоминает настройку оркестра. Подобно тому, как камертон задает точную частоту колебаний для настройки всех инструментов, слабые межмолекулярные силы определяют, как именно будут выстраиваться молекулы относительно друг друга. И если в ковалентной химии атомы прочно связываются друг с другом, как будто плотно пригнанные молотом кузнеца, то химик-настройщик работает с тончайшими взаимодействиями, словно настраивая множество молекул на единый лад, чтобы они могли «звучать» согласованно в сложном ансамбле живой клетки.
Кузнец и сегодня отлично справляется со своей работой — когда нужно что-то надежно скрепить, без хорошего удара молотом не обойтись! Но наука не была бы наукой, если бы не заглянула туда, где молотом уже не помашешь. Химики научились работать с такими слабыми взаимодействиями между молекулами, что теперь могут не только «ковать» прочные связи, но и «настраивать» тонкие молекулярные ансамбли, где каждая молекула находит свое место в общей структуре, как музыкальный инструмент в оркестре.
Менделеев и Ван дер Ваальс
Итак, структуру вещества удерживают ковалентные и нековалентные взаимодействия. Кто же понял это первым? 1869 год дал удивительный пример того, как попытки что-то объяснить студентам могут привести к эпохальным научным открытиям. В Санкт-Петербургском университете профессор Дмитрий Иванович Менделеев, мучаясь над тем, как бы попонятнее изложить в учебнике «Основы химии» закономерности в свойствах элементов, открыл Периодическую систему. В то же время в Гааге другой преподаватель, школьный учитель Йоханнес ван дер Ваальс, не имевший еще научной степени, описал в своей докторской диссертации совершенно иной тип взаимодействий — слабые нековалентные силы между молекулами.
Открытие Менделеева дало мощнейший толчок развитию теории химической связи и особенно химии ковалентных взаимодействий — периодичность свойств элементов позволила понять закономерности образования прочных химических связей между атомами. Но если Периодическая таблица относительно скоро получила признание и ее начали активно использовать для понимания ковалентных связей, то значимость нековалентных сил оценили только в XX веке, когда квантовая механика встала на ноги.
А сегодня кажется уже общим местом, во всяком случае — для химиков и физиков, что оба типа взаимодействий одинаково важны для природы: ковалентные связи отвечают за существование самих молекул, а ван-дер-ваальсовы силы определяют их бытование и поведение в пространстве.
Роль ван-дер-ваальсовых сил в химии очень долгое время недооценивали — впрочем, такая недооценка в истории науки случается нередко. Достаточно вспомнить историю Периодической системы, которая показывает, как даже гениальные открытия могут долго ждать полного признания. Когда в 1869 году Менделеев опубликовал свою Таблицу химических элементов, часть научного сообщества отнеслась к ней скептически. Многих смущало, что он оставил пустые места для неоткрытых элементов и детально описал их свойства, а также расположил некоторые известные элементы не по порядку их атомных весов (например, теллур и йод).
Переломным моментом стало открытие предсказанных Менделеевым элементов: галлия (1875), скандия (1879) и германия (1886). Их свойства поразительно точно совпали с предсказаниями. Например, для галлия Менделеев предсказал плотность 5,9 г/см3, а реальная оказалась 5,94 г/см3. Однако полное и безоговорочное признание пришло только с развитием атомной теории в начале XX века, когда стала понятна связь периодичности свойств с электронной структурой атомов. К сожалению, Нобелевскую премию за свое фундаментальное открытие Менделеев не успел получить, рано ушел из жизни. А вот ван дер Ваальс дождался «нобелевки» по физике, которую ему присудили в 1910 году.
Сначала было слово
Удачное название может полностью изменить восприятие как повседневных вещей, так и научных концепций. Гусеничник посевной веками рос на территории России, и люди знали о его съедобности, но особого внимания ему не уделяли. Но стоило этому же растению появиться на прилавках под итальянским названием «рукола», как оно мгновенно стало модным и желанным продуктом, неотъемлемой частью современной кухни. Это яркий пример лингвистического ребрендинга — как удачное название может полностью изменить восприятие давно известного продукта и определить его коммерческий успех.
В науке подобные терминологические прорывы имеют еще более глубокое значение. Часто важнейшие открытия начинаются с точного названия. В 1974 году Юрий Тимофеевич Стручков, создавший в Институте элементоорганических соединений первую в СССР лабораторию рентгеноструктурного анализа, предложил термин «нековалентные взаимодействия». Это было не просто новое слово — это был новый взгляд на химию.
Стручков и его коллеги, «вооружившись» рентгеновскими лучами, буквально заглянули внутрь кристаллов и увидели там огромное количество контактов между атомами в разных молекулах, которые были короче суммы соответствующих ковалентных радиусов. Предложенный Стручковым термин «нековалентные взаимодействия» оказался настолько точным и емким, что сегодня стал общепринятым в мировой науке и используется повсеместно в химической литературе.
Исследования нековалентных взаимодействий активно развивались и продолжают развиваться во многих научных школах России. Если говорить о тех, чьи работы оказали особое влияние на понимание автором этой статьи химии нековалентных взаимодействий, то стоит отметить В. И. Минкина с коллегами в Ростове-на-Дону, применивших квантовую химию для понимания природы этих взаимодействий, Е. С. Шубину с сотрудниками в ИНЭОС РАН в Москве, раскрывшую потенциал водородных связей для катализа и создания новых материалов, С. Г. Злотина в ИОХ РАН (Москва), разработавшего эффективные катализаторы на основе нековалентных взаимодействий.
Галогенная связь
История науки часто преподносит нам удивительные сюрпризы. Повторю, что важнейшие открытия порой долгие годы остаются недооцененными, пока не приходит их время. Именно так произошло с галогенными связями — особым типом нековалентных взаимодействий, первые наблюдения которых были сделаны еще в середине XX века, но истинное значение которых было осознано научным сообществом лишь десятилетия спустя. Здесь особенно примечательна история наблюдений норвежского кристаллографа Одда Хасселя, что наглядно демонстрирует, как даже нобелевские лауреаты могут опередить свое время.
Одд Хассель, нобелевский лауреат 1969 года, в своей Нобелевской лекции описал необычные наблюдения: в рентгеновских структурах ассоциатов молекулярного брома с диоксаном (1:1) он обнаружил, что расстояние между атомом брома и кислородом диоксана короче, чем сумма табличных значений ковалентных радиусов этих атомов. А это означает, что между атомами брома и кислорода — между двумя электроотрицательными элементами — есть какое-то взаимодействие.
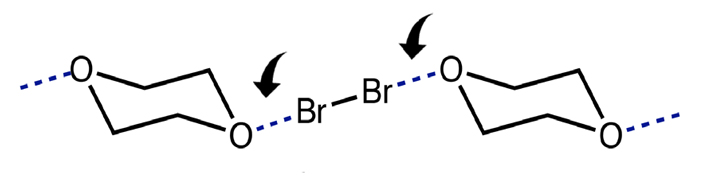
На схеме галогенная связь обозначена стрелками, а диоксан в ассоциате существует в конформации «кресло», за открытие которой Хассель получил Нобелевскую премию.
Сегодня мы знаем, что это галогенная связь — высоконаправленное межмолекулярное взаимодействие между атомом галогена с другим атомом, в данном случае — кислородом. Это нековалентное взаимодействие возникает потому, что электронная плотность вокруг атома галогена распределена неравномерно.
Представьте себе молекулу пентафториодбензола. В перфторарильном фрагменте содержатся пять атомов фтора — самого электроотрицательного элемента Периодической таблицы. Каждый из них является мощным электрон-акцептором, и их коллективное действие определяет суммарное акцепторное действие всей перфторфенильной группы.
Этот фрагмент действует на атом йода, деформируя его электронную плотность. В результате на атоме йода в продолжении ковалентной связи C–I возникает область электроположительного потенциала — так называемая сигма-дырка.
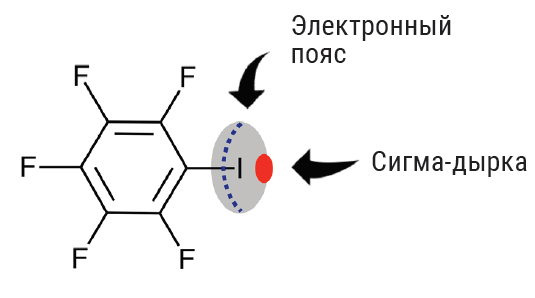
Понятно, если где-то возникает область положительного потенциала (сигма-дырка), то одновременно где-то должна возникнуть область отрицательного потенциала: атом йода ведь остается электронейтральным. Такая область, естественно, существует и называется электронным поясом, который на схеме показан пунктиром. В итоге льюисовские кислотный (сигма-дырка) и основный (электронный пояс) центры возникают в пределах одного атома!
В результате два атома йода из соседних молекул могут вступать в кислотно-основное взаимодействие, когда сигма-дырка одного атома ассоциирована с поясом электронной плотности другого атома.
Такой тип взаимодействия можно проиллюстрировать на примере двух бубликов, где вертикальный бублик направлен электронным поясом к сигма-дырке горизонтального бублика с образованием довольно устойчивой системы — это локальный энергетический минимум.

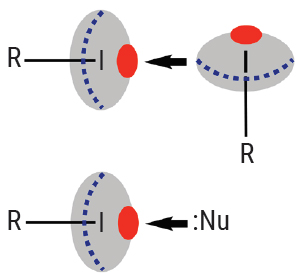
Есть и другой вариант галогенной связи, когда сигма-дырка на атоме иода взаимодействует с каким-то основанием (обозначено как Nu — от термина «нуклеофил»), например с электронной парой аминогруппы.
В наши дни примеров ассоциатов, связанных за счет галогенного взаимодействия, великое множество, и эта тематика продолжает бурно развиваться. Однако в середине XX века, когда Хассель изучал структуру ассоциата брома с диоксаном, химическое сообщество было сосредоточено на изучении ковалентных связей и стереохимии. Химики тогда были больше похожи на кузнецов, работающих с прочными ковалентными связями, чем на настройщиков музыкальных инструментов, улавливающих тончайшие взаимодействия. Нековалентные взаимодействия считались второстепенными, влияющими лишь на кристаллическую упаковку.
Исключением была только водородная связь, признанная из-за ее очевидной роли в биологических системах. Кстати, впервые ее подробно описал знаменитый химик, нобелевский лауреат Лайнус Полинг в своей книге «Природа химической связи» (1939). Поэтому научное сообщество больше интересовалось работами по конформационному анализу циклогексана, а идентификация Хасселем в то время необъяснимых контактов в ассоциатах брома и диоксана никого не взволновала — эти работы просто опередили свое время.
Широкое признание концепция галогенной связи в общем контексте нековалентных взаимодействий получила только в 2000-х годах во многом благодаря работам Джузеппе Резнати из Миланского политеха. Несколько лет назад Резнати работал в Томском политехническом университете, где создал на мегагрант Минобрнауки сильную исследовательскую группу, которая изучает кристаллические материалы, организованные за счет нековалентных связей.
Как химики научились обезвреживать «Годзиллу в мире запахов»
Способность атомов галогенов образовывать направленные нековалентные взаимодействия (галогенные связи, с которыми мы познакомились в предыдущем разделе) находит всё более широкое применение в различных областях химии. В кристаллохимическом дизайне галогенные связи используют для создания супрамолекулярных архитектур. В органическом синтезе эти взаимодействия служат основой для новых методов активации субстратов и контроля селективности реакций. Особый интерес представляет использование галогенных связей для модификации свойств соединений и материалов.
Интересный и неожиданный пример использования галогенной связи не так давно обнаружили в нашей лаборатории. Речь идет об укрощении печально известных изоцианидов — важнейших реагентов органического синтеза, чей отвратительный запах стал настоящим проклятием для химиков. Их иногда образно называют «Годзиллой в мире запахов», и это, пожалуй, даже мягко сказано. Как и с легендарным монстром, встреча с изоцианидами зачастую заканчивается массовым бегством начинающих химиков из лаборатории. К счастью, в отличие от японского чудовища, изоцианиды не крушат здания — они просто заставляют спасаться бегством. Примечательно, что большинство изоцианидов малотоксичны, однако их запах настолько невыносим, что даже было запатентовано их применение в качестве нелетального химического оружия: все разбегаются, но все живы!
Много лет химики искали способ укротить этого «монстра», и наконец это удалось осуществить в нашей лаборатории в рамках диссертационного исследования Александра Сергеевича Михердова. Исследуя нековалентные взаимодействия изоцианидов с различными веществами, мы обнаружили, что они могут образовывать галогенные связи с йодсодержащими органическими соединениями. В результате взаимодействия изоцианидов с йодперфторбензолами образуются кристаллические ассоциаты, в которых компоненты связаны за счет связей между сигма-дыркой на атоме йода и между электронной парой изоцианидной группы.

Самое удивительное, что в таких ассоциатах концентрация изоцианида в воздухе снижается до 50 раз по сравнению с неассоциироваными молекулами RNC! Теперь химики могут работать с изоцианидами прямо на лабораторном столе без противогазов и даже тяг. При этом полученные соединения сохраняют многие полезные химические свойства изоцианидов.
Конечно, это только начало. Мы продолжаем исследования и надеемся найти еще более эффективные способы работы с этими капризными, но незаменимыми веществами.
В семействе именных связей
После открытия галогенных связей химики поняли, что обнаружили важного представителя большого семейства неклассических нековалентных взаимодействий. В отличие от давно известной водородной связи, которая теперь считается классическим типом нековалентных взаимодействий (хотя даже в этой «классике» ученые продолжают находить неожиданные «авангардные» черты!), галогенные связи открыли дверь в мир новых, необычных межмолекулярных контактов.
Оказалось, что многие другие элементы Периодической таблицы тоже способны образовывать направленные нековалентные связи по тому же принципу — через сигма-дырки. Эти взаимодействия назвали по имени групп элементов, которые их образуют: халькогенные (от элементов 16-й группы — серы, селена, теллура), пниктогенные (от элементов 15-й группы — фосфора, мышьяка, сурьмы), тетрельные (от элементов 14-й группы — кремния, германия, олова) и так далее.
На фотографии — первая версия Периодической таблицы, «изготовленная по указанию автора» (то есть самого Д. И. Менделеева) висит в Большой химической аудитории СПбГУ. На ней я написал типы нековалентных взаимодействий, формализованных IUPAC (Международным союзом чистой и прикладной химии) с указанием годов, когда были опубликованы их официальные определения.
Важно, что чем тяжелее атом, тем более выраженными становятся эти взаимодействия. Это как если бы мы спускались вниз по лестнице Периодической таблицы — каждая новая ступенька дает нам более сильные связи. Почему так происходит? Все дело в электронах. У более тяжелых атомов их больше, и они расположены дальше от ядра. Такие электроны легче поддаются внешним воздействиям — говоря научным языком, атом становится более поляризуемым.
В результате на тяжелых атомах могут образовываться более глубокие сигма-дырки, что делает нековалентные связи прочнее. На рисунке показаны две сигма-дырки на атомах халькогенов в соединениях типа (СF3С6F4)2E (E = S, Se, Te), которые синтезировал Антон Викторович Рожков в нашей научной группе. На рисунке приведены величины рассчитанного электростатического потенциала для каждой из сигма-дырок.
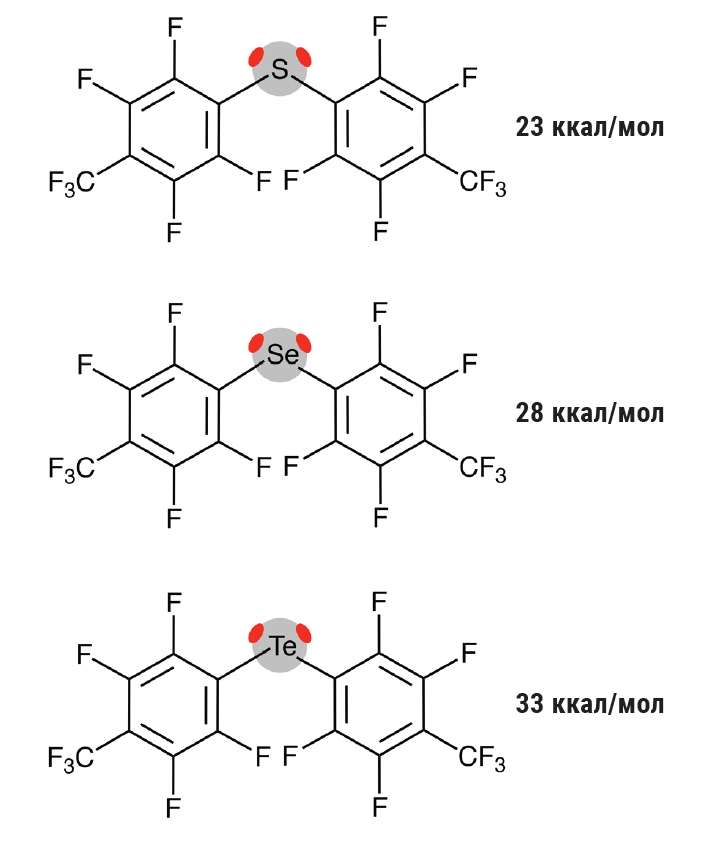
Но есть еще одно важное обстоятельство. В отличие от галогенов, которые образуют только одну сигма-дырку (помните наш пример с бубликом?), более тяжелые атомы других групп могут иметь сразу несколько таких областей положительного потенциала. Например, атом теллура может образовать две сигма-дырки, а атом сурьмы — целых три! Это делает такие атомы похожими на молекулярных осьминогов, способных одновременно держаться сразу за нескольких партнеров по взаимодействию. Представьте себе детский конструктор, где детали соединяются с помощью специальных выступов и углублений. Галогенные связи в такой аналогии — это детали с одним соединением. А вот атомы с несколькими сигма-дырками подобны деталям конструктора с несколькими точками крепления. Это дает химикам удивительные возможности для создания сложных молекулярных архитектур — своего рода наноразмерных замков и дворцов, где роль строительных блоков играют молекулы, а роль цемента — именные нековалентные взаимодействия.
На рисунке приведён пример кристаллической структуры, которую получила в нашей научной группе Мария Александровна Крюкова. Здесь соединение платины взаимодействует с себе подобными за счёт галогенных связей. Эти галогенные связи, как цемент, связывают молекулярные строительные блоки с образование супрамолекулярной архитектуры
Любопытно, что природа тоже использует некоторые из этих взаимодействий. Например, селен, входящий в состав важнейшего антиоксидантного фермента глутатионпероксидазы, образует халькогенные связи, которые помогают ферменту принять нужную для работы форму. Однако о нековалентных связях в природе и в организме человека мы расскажем чуть позже в этой статье и приведем некоторые впечатляющие (по крайней мере, впечатляющие меня) примеры. Так что именные нековалентные взаимодействия — это не просто игрушки химиков, а еще один пример того, как наука открывает и начинает использовать те приемы, которые природа освоила миллионы лет назад.
Изобретение природы
Нековалентные силы — это изобретение природы. Именно они зачастую определяют уникальные свойства живых систем. Удивительная способность гекконов бегать по стенам и потолку всегда завораживала людей. Однако лишь недавно ученые смогли детально разобраться в том, как маленьким ящерицам это удается.
На подушечках лап гекконов находятся миллионы микроскопических щетинок, каждая из которых разветвляется на сотни еще более тонких волосков, напоминающих по форме маленькие лопаточки. Эти крошечные структуры, размером всего около 200 нанометров, позволяют лапам геккона максимально близко приблизиться к поверхности. На таком ничтожно малом расстоянии начинают действовать особые силы межмолекулярного притяжения — ван-дер-ваальсовы взаимодействия. Хотя каждое такое взаимодействие очень слабое, их общее количество создает поразительно сильное сцепление: одна лапка геккона может удержать вес, в десять раз превышающий вес самой ящерицы!
Самое интересное, что этот механизм работает практически на любой поверхности — будь то стекло, пластик или даже полированный металл. При этом геккону не нужно выделять никакого клейкого вещества, а сцепление не зависит от электрического заряда поверхности. Чтобы передвигаться, геккон использует особую технику: он прижимает и отрывает лапки под определенным углом, что позволяет ему мгновенно прикрепляться и открепляться от поверхности.
Это удивительное изобретение природы вдохновило ученых на создание новых материалов. Благодаря им специальные роботы-гекконы могут карабкаться по вертикальным поверхностям подобно ящерицам. У роботов есть иерархически структурированные адгезивные накладки на конечностях, похожие по структуре на подушечки на лапках геккона.
Возможно, в будущем мы увидим новые типы застежек для одежды или обуви в стиле «геккон». Интересно, что похожий механизм исследователи обнаружили и у некоторых пауков. Да, природа экономна, поэтому любое свое удачное решение она использует многократно. Как тут не вспомнить чудесные сроки Константина Фофанова — «Как экономна сущность бытия: все новое тут шьется из старья!»
Квинтэссенция же решения природы заключается в том, что множество слабых, почти незаметных воздействий могут стать мощной силой, когда это потребуется. Вспомним историю о Гулливере — его случай прекрасно иллюстрирует суть нековалентных взаимодействий в природе. Гигант был обездвижен не толстыми канатами, а множеством тончайших нитей. Каждая нить в отдельности была настолько слаба, что Гулливер мог бы порвать ее, даже не заметив. Но тысячи таких нитей, действуя вместе, создали силу, с которой даже великан не смог справиться.
Точно так же работают и лапки геккона: каждое отдельное ван-дер-ваальсово взаимодействие между молекулами на его микроскопических щетинках и поверхностью ничтожно мало. Но миллионы таких взаимодействий, работая одновременно, позволяют небольшой ящерице не просто удерживаться на вертикальной стене, но даже бегать по потолку, словно бросая вызов гравитации.
Нековалентные взаимодействия и гормоны
Вообще, живые системы, включая нас с вами, — это те объекты, где слабые нековалентные взаимодействия играют принципиальную роль. Возьмём, к примеру, йод. Этот элемент демонстрирует удивительную химическую виртуозность, участвуя не только в образовании прочных ковалентных связей, но и галогенных связей, которые мы с вами уже обсуждали в истории с Хасселем.
Йод поступает в наш организм с пищей, солью и водой в виде йодид-иона. Дальше начинается настоящее химическое представление. Специальный фермент, тиреопероксидаза, превращает йодид-ион в молекулярный йод. В этой форме йод способен встраиваться в бензольные кольца аминокислоты тирозин, входящей в состав белка тиреоглобулина щитовидной железы. При этом к одной молекуле тирозина может присоединиться три или четыре атома йода, образуя соответственно тиреоидные гормоны T3 (трийодтиронин) или T4 (тироксин).
Но самое интересное происходит потом. Гормоны щитовидной железы проникают в клетки нашего организма, где их уже ждут специальные белки-рецепторы. В отличие от большинства других гормонов, рецепторы которых расположены на поверхности клеток, рецепторы тиреоидных гормонов находятся в глубине клетки — в ядре, где хранятся гены. Гормону нужно найти эти рецепторы, разбросанные в гуще ДНК, чтобы тем самым включить те или иные гены, на которых рецепторы сидят. И вот тут проявляется удивительное свойство атомов йода — они выступают в составе тиреоидных гормонов как молекулярные магниты, образуя галогенные связи с определёнными участками рецепторов.
Это взаимодействие очень точное и избирательное, но в то же время на порядок более сильное, чем между обычным гормоном и рецептором. Благодаря такому мощному притяжению, даже небольшое количество тиреоидного гормона вызывает максимальный эффект по всему организму — гормон быстро впитывается в клеточные ядра и надолго прилипает к включаемым генам. Поэтому тиреоидныегормоны предназначены для глобальной, долгосрочной настройки всех клеток тела одновременно. Например, они регулируют энергобюджет, переключая организм с режима накопления на режим траты и обратно. А у амфибий те же самые гормоны регулируют превращение головастика в лягушку.
Мона Лиза нековалентных связей
Нековалентные взаимодействия действительно играют важнейшую роль в жизни нашего организма. И не только на уровне клеток, но и на уровне главной молекулы жизни — ДНК.
Вообще, двойная спираль ДНК — это настоящий шедевр молекулярного искусства, своеобразная Мона Лиза мира нековалентных взаимодействий. Ее форму и ее свойства определяют два значимых типа нековалентных связей: водородные связи, соединяющие две цепи ДНК между собой, и стэкинг. Именно нековалентная природа этих взаимодействий позволяет молекуле ДНК быть одновременно стабильной для хранения информации и достаточно гибкой для осуществления биологических процессов.
Красота этой структуры не только в ее элегантности, но и в функциональности, в том, как она объясняет сам принцип жизни, то есть способность к точному самокопированию благодаря комплементарности цепей. Представьте застежку-молнию: расстегнув ее, вы получаете две половинки, каждую из которых можно дополнить до целой молнии. Так же работает и ДНК — ее цепи расходятся благодаря обратимости (образованию и разрыву) нековалентных связей, и каждая достраивается до новой полноценной молекулы. Именно поэтому в биологии деление и умножение — это, по сути, один и тот же процесс.
Структура ДНК, основанная на удерживании двух спиралей за счет множественных нековалентных взаимодействий, привела к удивительным практическим открытиям. Например, метод полимеразной цепной реакции (ПЦР), с которым многие познакомились во время пандемии COVID-19 (к сожалению, уж очень близко познакомились!), родился именно из размышлений о природе двойной спирали. Кэри Муллис, его изобретатель, придумал этот метод в 1983 году, просто размышляя о структуре ДНК во время поездки по калифорнийскому побережью. ПЦР позволяет создавать множество копий определенного участка ДНК, что в свою очередь обнаружить в пробе даже минимальное количество вирусов или других организмов. Это яркий пример того, как фундаментальное понимание строения молекулы и природы связей внутри нее может привести к революционным практическим применениям, меняющим медицину и биологию.
Заключение: от кузнеца до настройщика
Удивительно, как далеко шагнула химия за последние два десятилетия. От грубой силы ковалентных связей, где атомы прочно сцеплены друг с другом, словно выкованные молотом кузнеца, мы пришли к тонкому искусству управления нековалентными взаимодействиями — будто настраиваем сложный оркестр из молекул. Эти слабые, но многочисленные связи определяют важнейшие процессы жизни: от способности гекконов бегать по потолку до работы наших гормонов и хранения генетической информации в ДНК.
Природа давно освоила это искусство, а теперь и химики научились. Мы можем укротить зловонного «монстра» изоцианида с помощью галогенных связей, создать новые материалы и новых роботов, вдохновившись лапками геккона, и даже разработать такие чувствительные методы диагностики, как ПЦР. Похоже, что будущее химии — это не только мощь ковалентных связей, но и виртуозная игра на тонких струнах нековалентных взаимодействий, где каждая молекула находит свое место в сложной симфонии жизни.
Благодарности. Автор выражает сердечную благодарность коллективу своих нынешних и бывших сотрудников, постдоков, аспирантов и студентов за их искренний энтузиазм в изучении межмолекулярных взаимодействий и за то интеллектуальное удовольствие, которое автор получил в совместной работе при планировании исследований и обсуждении результатов. Научные данные, частично представленные в данной статье, получены при поддержке Российского научного фонда (гранты 20-13-00144 и 23-13-00033).
Избранное



































