Двенадцать лет в пузыре из пластика
Елена Клещенко
«Химия и жизнь» №2, 2025
«Он не дотронулся до мира, но мир был тронут им». Дэвид Веттер, мальчик с врожденным иммунодефицитом, всю свою короткую жизнь провел в изолирующих камерах. Трансплантация клеток костного мозга, которая должна была его вылечить, привела к его смерти. Случай «мальчика в пузыре» обсуждается и сегодня, как часть истории этики медицины и лечения генетических заболеваний.
Самые беззащитные дети
Тяжелые комбинированные иммунодефициты (ТКИД) — группа наследственных заболеваний, вызванных раз личными генетическими дефектами, нарушающими формирование и работу иммунной системы. Этот диагноз ставят примерно одному новорожденному из 50 тысяч.
Широкая публика узнала о ТКИД благодаря «мальчику в пузыре» Дэвиду Филиппу Веттеру (1971–1984). У Дэвида был Х-сцепленный ТКИД — дефектный ген IL2RG в Х-хромосоме, и свою жизнь он прожил в стерильной среде, отделенный прозрачной ПВХ-пленкой от других людей. «Пузырь» находился в детском отделении хьюстонской больницы Св. Луки Техасской детской клиники, второй подобный изолятор ему оборудовали дома у родителей. Никто не планировал ставить над ребенком такой эксперимент, это получилось вынужденно.
У его родителей, Кэрол Энн и Дэвида Джозефа Веттера, уже была здоровая дочь Кэтрин. Первый сын, которого, как и отца, назвали Дэвидом Джозефом, умер в семь месяцев от иммунодефицита. Родителям разъяснили риски: следующий сын тоже может родиться больным с вероятностью 50%. Если мать здорова, значит, мутация у нее только в одной Х-хромосоме из двух. Но у мужчин одна Х-хромосома (напомним: мужчины — XY, женщины — XX). И если мальчик получит от матери Х-хромосому с нормальным геном, он будет здоровым, а если с мутантным, то у него разовьется болезнь — та же история, что с гемофилией.
Тут сделаем остановку и разберемся, по каким причинам человек может родиться с поломанной иммунной системой. Разные формы ТКИД — это различные поломки.
Школьные учебники середины ХХ века сообщали нам, что кроме «красных кровяных клеток» (эритроцитов) и «пластинок» (тромбоцитов) есть еще «белые кровяные клетки», лимфоциты. С развитием микроскопических методов исследования стало ясно, что «белые кровяные клетки» крайне разнообразны и по форме, и по характеру окрашивания различными красителями, и по структуре цитоплазмы, и, очевидно, по функциям. В теперешнем представлении белые кровяные клетки разнообразны почти так же, как население большого города. Хотя, как и в городе, среди них есть определенные типажи, объединенные общим происхождением и образом действий.

Все клетки крови происходят от стволовых клеток, которые живут в красном костном мозге. Из одной линии клеток образуются эритроциты, тромбоциты, а также клетки, участвующие во врожденном иммунном ответе (не связанном с распознаванием конкретного антигена). Из второй — развиваются клетки, отвечающие за распознавание антигенов и, соответственно, адаптивный иммунный ответ, — Т- и B-лимфоциты, а также менее знаменитые среди неспециалистов «натуральные киллеры» (NK-клетки).
В-лимфоциты, как известно, производят антитела — белковые молекулы, похожие на букву Y, с бесконечно разнообразными кончиками «рожек», способные связывать бесконечное разнообразие антигенов. (Одна В-клетка производит только один тип антител, но В-клеток очень много.) Т-хелперы, они же CD4+ Т-лимфоциты, помогают В-клеткам и Т-киллерам, они же цитотоксические Т-клетки, они же CD8+ Т-лимфоциты. Т-киллеры убивают зараженные или раковые клетки, несущие «неправильные» антигены. То же самое делают и NK-клетки, но они относятся к врожденному иммунитету и распознают клетки-мишени быстро и независимо от антигенов.
Так вот, при тяжелом комбинированном иммунодефиците у пациента полностью или практически полностью отсутствуют Т-клетки, может также быть снижено количество В- и NK-клеток. Вирус иммунодефицита (ВИЧ) вызывает СПИД — синдром приобретенного иммунодефицита, убивая клетки иммунной системы. А врожденный иммунодефицит — это отсутствие важных иммунных клеток или дефекты их функции, вызванные генетическими нарушениями.
Наиболее частый врожденный иммунодефицит — как раз случай Дэвида Веттера, иммунодефицит, сцепленный с Х-хромосомой. Ген, пораженный мутацией, находится в Х-хромосоме; это ген гамма-субъединицы рецепторов интерлейкинов IL2RG. Интерлейкины — это сигнальные белки, необходимые для развития иммунных клеток. Рецепторы — молекулы, принимающие внешние сигналы и передающие их в клетку, а ген IL2RG кодирует белок, который входит в состав многих рецепторов интерлейкинов. Соответственно, если испорчено устройство, принимающее сигнал, незрелые клетки не развиваются в Т-клетки и NK-клетки. А без Т-хелперов и В-клетки не могут нормально работать. В 1970-е годы молекулярные подробности не были известны, но заболевание было описано, и медицинские генетики понимали, как оно наследуется.
АДА-ассоциированный ТКИД — второй по распро страненности после Х-сцепленного. Его вызывают мутации в гене, кодирующем фермент аденозиндезаминазу (АДА), который отвечает за превращения компонентов нуклеиновых кислот. Отсутствие этого фермента нарушает метаболизм в клетках-предшественницах лимфоцитов, они прекращают делиться, соответственно в крови резко падает количество зрелых Т- и В-лимфоцитов и NK-клеток.
Есть и другие типы врожденных иммунодефицитов: механизм иммунного ответа сложен, каждый его элемент необходим, и, как гласит закон Мерфи, все, что может сломаться, однажды сломается. Но остановимся на этих двух, относительно распространенных и тяжелых.
В первые месяцы жизни младенца защищают антитела, полученные от матери. Однако с 2–6 месяцев ребенок начинает болеть — постоянно и всем сразу. Грибковые инфекции, тяжелые кишечные расстройства, вирусные заболевания никак не проходят. Заболевания у этих детей могут вызывать и микроорганизмы, не патогенные для других людей. Без своевременной диагностики пациенты обычно умирают в младенчестве.

Если диагноз поставлен, исключены другие возможные причины ослабления иммунитета (как, например, заражение тем же ВИЧ), ребенка изолируют — для него опасны буквально любые контакты. Основным методом лечения до сих пор остается трансплантация стволовых клеток крови (то есть костного мозга) от здорового донора. Такие клетки будут размножаться, производить лимфоциты и NK-клетки, и все закончится хорошо. Проблема лишь в том, чтобы найти донора, совместимого с пациентом. При несовместимости возможна реакция «трансплантат против хозяина» — донорские иммунные клетки вместо того, чтобы защищать организм, начнут с ним бороться. Сейчас во всех развитых странах создаются банки доноров, стараются привлечь максимум добровольцев, и все равно многим пациентам помочь не удается. Тем более это было сложно в начале 1970-х.
Скафандр для шестилетнего
Когда Веттеры только решали, могут ли они завести еще одного ребенка, три доктора из Медицинского колледжа Бейлора в Хьюстоне — Джон Монтгомери, Мэри Энн Саут и Рафаэль Уилсон — предложили запасной план на случай, если будущий ребенок все-таки получит мутантный ген. Младенца можно будет временно поместить в стерильную камеру, а потом трансплантировать ему костный мозг от сестры, которая была старше его почти на три года. Ранее Рафаэль Уилсон проделал подобный опыт в Германии: в стерильную камеру поместили двух близнецов, у которых, по-видимому, была более легкая форма иммунодефицита, и они со временем смогли выйти из изоляции. План выглядел рабочим — братья и сестры часто бывают подходящими донорами друг для друга, — а Веттеры очень хотели сына-наследника.
Дэвид Филипп Веттер родился 21 сентября 1971 года. Матери делали кесарево сечение, чтобы снизить вероятность инфекции. Худшие опасения оправдались: Т-клеток в крови младенца было мало. Его поместили в кровать под коконом; позднее оборудовали стерильную камеру побольше. Компрессоры в нее закачивали стерильный воздух, к стенкам были прикреплены пластиковые перчатки, обращенные внутрь, чтобы можно было ухаживать за мальчиком. Но, к сожалению, костный мозг Кэтрин Веттер не подходил для трансплантации, и, забегая вперед, совместимого донора так и не удалось найти.

Врачи и родители осознали, что мальчик проведет в стерильной камере неопределенно долгое время, и нужно строить дальнейшие планы. Ребенка крестили стерилизованной святой водой прямо в камере — для Веттеров, глубоко верующих католиков, это было важно. Крещение совершил тот же Рафаэль Уилсон, который был не только доктором, но и монахом. Камеру в больнице последовательно расширяли, потом оборудовали еще одну камеру дома у Веттеров, а также построили транспортную камеру.
Обслуживание изолятора для ребенка, который никогда не должен контактировать с внешним миром, было отдельной научной задачей. Вероятно, это было бы невозможным, если бы не исследовательские гранты от Национальных институтов здравоохранения США — на эксперимент по созданию свободной от патогенов среды и на изучение редкого заболевания иммунной системы.
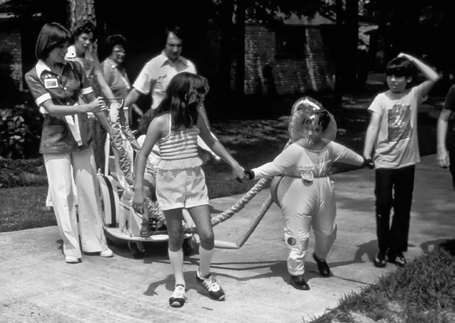
Еда, вода, одежда и игрушки попадали внутрь стерилизованными. Предметы помещали в бокс, заполненный этиленоксидом, и выдерживали четыре часа при температуре 60°С, затем проветривали несколько дней. Компрессоры, качающие воздух, постоянно шумели, так что с ребенком трудно было разговаривать.
О том, что его могут убить микробы, Дэвид Филипп узнал в четыре года. Кто-то забыл в его камере иглу-бабочку для инъекций и взятия крови, и он, как всякий нормальный познающий мир ребенок, начал делать дырочки в пластиковой оболочке. После этого Рафаэль Уилсон ему рассказал, зачем она нужна и почему он должен оставаться внутри.
У Дэвида Филиппа были не только игрушки, но и телевизор, а НАСА подарило ему маленький скафандр для выходов во враждебный ему «открытый космос». Но шестилетний Дэвид сначала разочаровал журналистов, отказавшись его надевать перед камерами. «Я не верю. Мэри, ты веришь? — спросил он психолога Мэри Мерфи, которой удалось наладить контакт с мальчиком — он называл ее своим другом. — Посмотри на эту штуку в конце туннеля (к пузырю прикрепили трубу, которая вела к скафандру). Я ее боюсь. Там могут быть микробы». В конце концов он решился, но пользовался скафандром считанные разы.
Широкий мир его пугал не только микробами, но и неизвестностью. Чтение и занятия не могли компенсировать отсутствие того колоссального объема информации, который получают обычные дети его возраста. Когда Мэри Мерфи однажды попросила Дэвида рассказать, что такое дерево, он ответил, что дерево — это коричневый прямоугольник, а сверху зеленый овал. Действительно, на многих картинках, особенно для детей, деревья выглядят так.
К 1974 году Дэвид мог приезжать домой к родителям и сестре в город Конро, жил там в домашнем пузыре, потом возвращался в больницу. Дэвид и Кэтрин, как многие братья и сестры, иногда спорили и дрались — через перчатки в стенке пузыря. Дэвид мог стукнуть сестру и убежать на другую сторону камеры, где его нельзя было достать. Иногда Кэтрин угрожала отключить компрессоры, если брат не перестанет вредничать, и несколько раз действительно отключала, так что воздух выходил из пузыря, Дэвид прятался в «аварийный» отсек и оттуда просил подключить пузырь к сети. Но все равно они любили друг друга, и Кэтрин, когда брат был дома, перебиралась ночевать в комнату с пузырем.
Его навещали знаменитости. Дэвид даже побывал в кинотеатре на спецпоказе «Возвращения джедая», организованном специально для него. (Психологи поощряли его интерес к космосу и фантастике, к историям, герои которых тоже были должны носить скафандры, чтобы не умереть.) А вот кока-колу так и не попробовал, хотя видел по телевизору и мечтал о ней, просил ее даже перед смертью: газированный напиток невозможно стерилизовать.
Родители ограждали его от внимания СМИ, но однажды, когда Дэвиду было восемь или девять лет, он увидел свою фотографию в газете. «На следующий день он сказал мне, что он звезда, — вспоминала его мать. — Я не поняла, о чем он говорит, и сказала ему, что да, он действительно звезда, потому что освещает мою жизнь. Дэвид сказал, что он звезда, потому что его фотография была в газете вчера, а звездам не нужно убирать игрушки. Я сказала ему, что сегодня его фотографии не было в газете, поэтому сегодня он убирается в пузыре!»
Последняя неудача
Оставалась надежда, что когда-нибудь появится лекарство, которое позволит Дэвиду выйти из пузыря, но лекарство не появлялось. Правительство и общественность относились к дорогостоящему медицинскому эксперименту с растущим скепсисом. Конечно, нельзя было дать ребенку умереть, но как же другие дети с иммунодефицитами, изолирующие камеры для которых никем не оплачиваются? Проблема, которая остается актуальной всегда: если больным можно помочь, но помощь по тем или иным причинам доступна не для всех, многие сочтут это этически неприемлемым.

Тем временем послушный, боящийся микробов мальчик стал невыносимым подростком, и претензии этого подростка к тупому миру и тупым взрослым были довольно обоснованными. Он злился, тосковал, говорил, что хотел бы умереть, и в то же время ему было страшно, что те, кто о нем заботится, могут его покинуть. (Покинул ведь его один из инициаторов эксперимента Рафаэль Уилсон, решив продолжить свою карьеру в другом месте.)
Все труднее становилось объяснять ему, почему он должен жить такой жизнью. Мэри Мерфи спросила его, почему он такой злой, и он ответил: «Все, что я делаю, зависит от того, что кто-то другой решит, что я должен делать. Зачем учеба? Зачем ты заставила меня учиться читать? Какая от этого польза? Я все равно никогда ничего не смогу сделать. Почему? Ты мне скажи, почему!»
В октябре 1983 года Дэвиду все же трансплантировали костный мозг Кэтрин, так как лучшего донора найти не смогли. Операция прошла успешно, тревожных признаков не было. На Рождество брат подарил сестре колечко с сапфиром и бриллиантом, которое помогла выбрать мама, — в благодарность за жизнь. Некоторое время все было благополучно, появилась надежда на счастливый конец истории.
Однако в начале 1984 года мальчик впервые в жизни тяжело заболел — его рвало кровью, сильно болел живот, и 22 февраля он умер. Причиной смерти была лимфома Беркитта, вызванная вирусом Эпштейна — Барр, который вовремя не обнаружили в клетках трансплантата. У большинства людей, включая Кэтрин, инфекция протекает бессимптомно, вирус «спит», но человека с иммунодефицитом он может убить.
Перед смертью Дэвид покинул свой пузырь, и когда его положили в новую палату, он попросил Мэри Мерфи поднять жалюзи, чтобы посмотреть, что за окном. Там оказалась кирпичная стена. Психолог сама не удержалась и заплакала, когда увидела кирпичи вместо неба, а Дэвид стал ее утешать.
После смерти Дэвида его родители развелись; можно предположить, что для католиков это решение было сложным, но тем не менее это произошло. Дэвид Джозеф Веттер много лет был мэром города Шенандоа в Техасе. Кэрол Энн вышла замуж за журналиста, который писал о ее сыне, стала участвовать в работе некоммерческой организации, помогающей людям с ТКИД, боролась за включение в медстраховку методов лечения и тестирование всех новорожденных на это заболевание. Она рассказывает, что многие матери не понимают, что такое врожденный иммунодефицит и почему необходимо принимать срочные меры, пока им не скажешь: «Это болезнь мальчика в пузыре» — «тогда они понимают».

На могильном камне Дэвида Филиппа Веттера написано: «Он не дотронулся до мира, но мир был тронут им» (He never touched the world, but the world was touched by him). В самом деле, история человека, которому нельзя прикасаться к другим людям, захватывала воображение. О Дэвиде и о врожденном иммунодефиците писали книги, снимали документальные и художественные фильмы. Телевизионный фильм «Мальчик в пластиковом пузыре» (в русском переводе «Под колпаком») вышел в 1976 году, главного героя в нем сыграл молодой Джон Траволта. Как и положено в телефильме, зрителям дают надежду на счастливый финал: иммунная система героя вроде бы начинает восстанавливаться, он решает выйти наружу и уехать со своей девушкой, хотя врач предупреждает, что он может умереть. Дэвид посмотрел этот фильм и посмеялся над нарушениями техники безопасности, когда герой надевает свой скафандр, находясь внутри камеры, а не в шлюзе.
Об этической стороне эксперимента много спорили; обвиняли, в частности, Рафаэля Уилсона в том, что он уговаривал родителей зачать ребенка, ссылаясь на милосердие Божье и, возможно, желая поставить этот интересный эксперимент. Другой участник проекта, Джон Монтгомери, уже в 1997 году заявил с достоинством, что «если бы Колумба заранее предупредили, что он никогда не достигнет края Земли, он бы остался в Испании и торговал тортильями». Звучит гордо, но настоящий научный прорыв сделали не инициаторы эксперимента с «пузырем».
В начале 1990-х годов Масаюки Ногучи и другие сотрудники Национального института сердца, легких и крови в Бетесде (США) исследовали три клеточные линии, полученные от трех не родственных между собой мальчиков с Х-сцепленным ТКИД. Одним из них был Дэвид Филипп Веттер — клетки все эти годы росли в культуре. Тогда и была обнаружена мутация в гене IL2RG, из-за которой не работают рецепторы интерлейкина. В сущности, благодаря этой работе мы теперь можем узнать, есть ли у женщины такая мутация и может ли она передать ее ребенку, или же своевременно выявить мутацию у новорожденного.
Важная причина, по которой это заболевание желательно диагностировать сразу, состоит в том, что инфекции разрушительны для организма без иммунной системы. Выживаемость детей, которым сделали трансплантацию костного мозга в первые 3,5 месяца жизни, существенно выше: по данным 2007 года, 94% доживают до 30 лет, а среди тех, кто получил трансплантат позже, — менее 70%. А симптомы, напомним, проявляются не сразу, так как новорожденного некоторое время защищают материнские антитела.
В Российской Федерации с 2023 года работает расширенный неонатальный скрининг — всех новорожденных (кроме тех, чьи родители по непостижимым для меня мотивам не дают на это своего согласия) проверяют на 36 заболеваний и групп заболеваний. Первичные иммунодефициты — группа, в которую входит и болезнь мальчика в пузыре, — в скрининг включены. Если случится такое несчастье, по крайней мере, диагноз будет поставлен быстро, а найти донора костного мозга сейчас все же легче, чем в ХХ веке. Массового преконцепционного скрининга (до беременности) у нас в ближайшее время не ожидается, но, если у кровных родственников будущих родителей были случаи врожденных иммунодефицитов, стоит обратиться к медицинским генетикам на этапе планирования ребенка.
Устранить причину
Но что же с генной терапией ТКИД? Сделал ее кто-нибудь к концу первой четверти XXI века? Можно наконец исправить скрытую в генах причину заболевания, как это делается при спинальной мышечной атрофии или гемофилии? И да, и нет.
Первым пациентом, получившим генную терапию, которая принесла пользу, был именно ребенок с ТКИД. Девочка по имени Ашанти Де Сильва родилась в 1986 году, через два года после смерти Дэвида Веттера. В два года и два месяца после череды изнурительных инфекций ей поставили диагноз — АДА-ассоциированный ТКИД. При этой форме иммунодефицита возможно лечение — регулярные инъекции аденозиндезаминазы, которые восстанавливают количество Т-клеток в крови. Но через два года организм девочки перестал реагировать на инъекции.
В 1990 году четырехлетняя Ашанти получила инновационное лечение. Из ее крови выделили Т-клетки, с помощью ретровирусов внедрили в них ген АДА без мутации и вернули в кровоток. После этого количество Т-клеток в крови резко возросло. Затем модифицированные клетки вводили еще десять раз в течение двух лет. В итоге даже через 10 лет каждая пятая Т-клетка в крови содержала и экспрессировала ген АДА. Ашанти не жила в изоляции, а ходила в школу, как все дети, выросла и вышла замуж. Сейчас она занимается защитой прав пациентов и коммуникациями в области здравоохранения, как написано на ее странице в профессиональной соцсети.
К сожалению, у других пациентов результаты аналогичного лечения были не такими хорошими. Еще хуже получилось с первыми попытками вылечить Х-сцепленный ТКИД методом генной терапии. У этих пациентов модифицировали клетки костного мозга, а не Т-лимфоциты крови, использовали другой тип ретровирусов, и у некоторых детей развилась лейкемия. Даже несмотря на это, выживаемость была лучше, чем при пересадке донорского материала, но рак крови как побочный эффект — невозможный компромисс.
Сейчас разрешен продукт для генно-клеточной терапии АДА-ассоциированного ТКИД — Стримвелис, который компания GlaxoSmithKline разработала и продала компании Orchard Therapeutics. Клинические испытания подтвердили, что он восстанавливает иммунную систему детей, для которых не удается найти донора костного мозга. Но препарат дорогой и, главное, не вполне безопасный — у одного из пациентов через четыре с половиной года диагностировали Т-клеточную лейкемию, вероятно, связанную с лечением. После этого интерес к Стримвелису снизился, хотя разрешение не отозвали — другие пациенты все-таки выжили благодаря этому лечению, а не умерли в младенчестве.
В настоящее время проходят клинические испытания другие виды генной терапии разных видов врожденных иммунодефицитов, которые используют новые методы введения генов в клетки, с повышенной безопасностью. Подождем новостей: может быть, и эти болезни перейдут в категорию гарантированно излечимых.

































