Джон Дальтон: сделано из атомов
Марина Молчанова
«Квантик» №7, 2021
Фамилию героя нашей статьи, сами того не зная, слышали очень многие. Дело вот в чём.
Джона Дальтона в молодости не раз удивляло суждение окружающих людей о цвете тех или иных объектов. Oн не обращал на это особого внимания: мало ли, люди разные и видят мир по-разному.
Hо в возрасте ближе к тридцати Дальтон увлёкся ботаникой. И обнаружил, что один и тот же цветок пеларгонии при разном освещении кажется то небесно-голубым, то красным. Никто больше не отмечал такого эффекта... кроме его родного брата. Пришлось вникнуть в тему. И оказалось, что Джон и его брат действительно видят мир не так, как большинство людей!
Вскоре вышла в свет статья Дальтона «Необычные случаи цветовосприятия» (1794 г.), где автор описал странности собственного цветового зрения. И учёные, прочтя её, впервые обратили внимание на проблему.
Сейчас мы знаем, что нарушения цветовосприятия встречаются у нескольких процентов мужчин (у женщин — крайне редко) и обусловлены генетически. Знаем и о том, какая именно особенность зрения была у Дальтона: он сам пожелал, чтобы его глаза изучали и после его смерти, их фрагменты сохранились, и в конце XX века был проведён анализ ДНК. Из него ясно, что Дальтон не мог различать цвета в средней части спектра: скажем (как он и сам отмечал), оранжевый и зелёный для него были просто оттенками жёлтого. О цветовой слепоте было известно и раньше, но первое подробное описание дал сам Дальтон, и поэтому мы называем её дальтонизмом1.
Но описание цветовосприятия — не первая и не главная страница научной жизни Дальтона. До работ, прославивших его на весь мир, оставались годы.
* * *

Мемориальная табличка в Иглсфилде, родной деревне Дальтона
Джон Дальтон родился в семье ткача в английском графстве Камберленд, во взрослом возрасте переехал в Манчестер, где и занимался наукой всю жизнь. Работать ему пришлось с десяти лет, с 15 лет он уже помогал руководить школой, а в университет так и не поступил — помешали обстоятельства. Но ему всегда везло на людей, которые рады были поделиться с ним знаниями. Так, большую роль в его жизни сыграл слепой учёный Джон Гоф (Gough) — молодой Дальтон помогал ему с чтением, письмом и расчётами, а Гоф учил Дальтона латыни и греческому, заодно в неформальной обстановке рассказывал о науке.
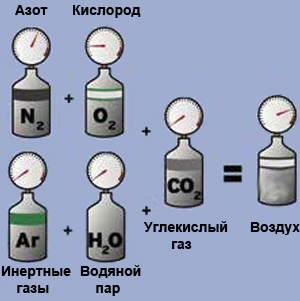
Закон Дальтона
В 1793 году Дальтон опубликовал свою первую книгу — по метеорологии. Чуть позже занялся географией — в частности, измерял высоты гор в своём родном Озёрном краю в Англии, залезая на их вершины с барометром. Интересовался возникновением водных источников и выпадением росы, отражением и преломлением света. Много работал с газами, изучая соотношения между их давлением, объёмом и температурой, причём работал с грубыми и неточными приборами, но достигал успеха, потому что, по словам великого химика тех времён Гемфри Дэви, «доверял своей голове больше, чем рукам». Открыл закон физики газов, получивший его имя: давление смеси газов равно сумме парциальных, то есть частичных, давлений всех её компонентов, взятых по отдельности. Сформулировал ещё один закон о растворимости газов. Выпустил книгу по английской грамматике. Преподавал. Вспомните Пристли2 — такая же широта интересов. Тогда это было ещё возможно для учёного.
Но всё-таки мы помним Дальтона по другой причине. Он стал одним из основателей современной химии. И прежде всего это связано с атомной теорией.
* * *
Сейчас с детства мы знаем, что вещества построены из атомов. Даже не понимаем, как можно думать иначе, — немыслимо же без атомов записывать химические формулы и превращения! Но ещё двести с небольшим лет назад всё было совсем не так очевидно. Что ещё за наименьшие частицы материи? Мы же их не видим!
Да, абстрактное представление о них восходит ещё ко временам Древней Греции: философ Левкипп высказывал идею о частице настолько маленькой, что её уже невозможно разделить на более мелкие, а Демокрит назвал эти частицы атомами (от греческого «неделимый»). Но затем об атомах прочно забыли примерно до XVII — XVIII веков. Да и непонятно, зачем бы они могли понадобиться в эпоху алхимии.
Однако к XIX веку химия потихоньку становилась настоящей наукой. Великий Лавуазье в числе прочего сформулировал закон сохранения массы: «Можно принять в качестве принципа, что во всякой операции количество материи одинаково до и после опыта, что качество и количество начал остаются теми же самыми». Затем другой французский химик, Пруст, сформулировал закон постоянства состава: как бы мы ни получали какое-то вещество, отношения масс входящих в него химических элементов будут постоянными — например, в белом порошке двуокиси олова по весу всегда будет 79% олова и 21% кислорода3. Но не было единой теории, объясняющей все эти факты. Почему сохраняется масса? Почему состав большинства веществ постоянен? Что именно меняется местами и перегруппируется во время химической реакции?
Ответ дал именно Дальтон. А главной отправной точкой для его идеи строения вещества из атомов послужил закон кратных отношений.
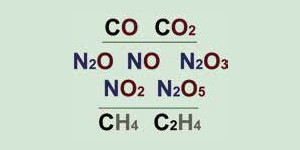
Рис. 1. Формулы соединений, иллюстрирующих закон кратных отношений, в современной нотации. До Дальтона эти формулы были неизвестны
Неизвестно, какие вещества натолкнули Дальтона на формулировку этого закона, поэтому объясним его на своих примерах (рис. 1). Есть два соединения углерода с кислородом — угарный газ и углекислый газ. Сравнив их составы, мы увидим, что на одну и ту же массу углерода в углекислом газе приходится ровно в 2 раза больше кислорода, чем в угарном. Оксидов азота, то есть соединений азота с кислородом, сейчас известно целых пять (в те времена — три); массы кислорода в них, приходящиеся на одну и ту же массу азота, соотносятся между собой как 1:2:3:4:5. Массы водорода, приходящиеся на одну и ту же массу углерода в «болотном газе» метане и «маслородном газе» этилене, отличаются точно вдвое. Таких примеров очень много. Не означает ли это, что перечисленные соединения «собраны» из небольшого числа одних и тех же простейших частиц — водорода, азота, углерода, кислорода, — взятых в разных отношениях?

Дальтон собирает метан на болоте. Фреска Ф. М. Брауна (1887 или 1893 г.)
Никакие теории, существовавшие к началу XIX века, не могли объяснить закон кратных отношений. За несколько лет, начиная с 1803 года, Дальтон создал собственную теорию. Вот её основные положения.
Все вещества состоят из отдельных очень малых частиц — атомов, которые не создаются, не уничтожаются и не разделяются на части. Атомы одного и того же элемента неразличимы, в том числе имеют одинаковый вес; атомы разных элементов отличаются друг от друга и не превращаются друг в друга. Из разных атомов, взятых в определённых соотношениях, получаются химические соединения. В ходе химических реакций атомы соединяются, разъединяются или перегруппируются.
Сейчас мы знаем, что всё ещё сложнее: есть более мелкие частицы, из которых состоят сами атомы; в ходе ядерных реакций одни атомы могут превращаться в другие; у одного и того же элемента могут быть разные изотопы — атомы неодинаковой массы... Мы видим у Дальтона и чисто химические ошибки: так, из соображений «наибольшей простоты» он считал, что формула воды будет OH, а не H2O, аммиака — NH, а не NH3. Но всё же это частности, поправки. А основу, без которой никуда, заложил именно Дальтон.
Важнейшая характеристика атомов — их вес. Дальтон не мог измерить вес одного атома в унциях, гранах или других обычных единицах. Но он понял, что можно оперировать с соотношениями весов разных атомов — исходя из массового состава каждого соединения (помните закон постоянства состава?) и из догадки, сколько атомов одного элемента в нём приходится на атом другого. Можно принять вес самого лёгкого атома — водорода — за 1, а потом просто вычислять, во сколько раз другие атомы тяжелее. Мы сейчас знаем, что в вычислениях Дальтона (рис. 2) была ошибка на ошибке, но сама идея оперировать относительными весами используется до наших дней.
Теория Дальтона позволила создать для химии её язык — систему знаков. Ведь если все химические соединения образуются из комбинаций сравнительно небольшого числа атомов, можно обозначать вещества этими комбинациями: для каждого атома свой рисунок, а из них собираются конструкции (рис. 3). Правда, потом с подачи Йонса Якоба Берцелиуса (ещё один основатель современной химии!) и к большому недовольству Дальтона прижилась нынешняя система (как на рисунке 1): одно- и двухбуквенные обозначения для элементов и цифры, показывающие количества их атомов. Но чтим же мы память Кирилла и Мефодия, создавших глаголицу, первую славянскую азбуку, хотя кириллица давно уже актуальнее...
* * *

Эта статуя была создана Ф. Чантри ещё при жизни Дальтона, в 1838 году
Атомную теорию, к счастью для Дальтона и науки, очень быстро признали, в её развитие включились лучшие умы тех времён. Дальтон был принят во все основные академии и стал председателем Манчестерского литературно-философского общества — именно с этой организацией связаны многие десятки его научных сообщений в течение всей жизни, начиная с описания цветовой слепоты... Но сам он вёл жизнь скромного холостяка и не очень нуждался в шумной славе.
Популярного лектора из него не вышло: у Дальтона был неприятный голос и никаких ораторских способностей. А вот занятия наукой продолжались до самой его смерти. Накануне своего последнего дня он ещё записывал метеорологические наблюдения, хотя рука дрожала после двух инсультов.
Дальтона не забыли, особенно в Манчестере, где он прожил большую часть жизни. Улица Дальтона, стипендия Дальтона, премия Дальтона, медаль Дальтона. А ещё единица, которую сейчас во всём мире используют для измерения атомных масс и которая очень близка к той самой массе атома водорода. Эта единица называется дальтон, сокращённо Да.
1 Редчайший случай: медицинская особенность была впервые описана пациентом и получила имя пациента! Правда, как раз в родном для Дальтона английском языке слово daltonism используется редко и только для определённого вида цветовой слепоты.
2 О Джозефе Пристли см. «Квантик» № 3 за 2020 год, с. 20.
3 Есть и исключения, но на них останавливаться не будем. Если интересно, поищите в интернете слово «бертоллиды».
Избранное
См. также






























Джон Дальтон (John Dalton), 1766–1844