Найдены причины потери социальной памяти при болезни Альцгеймера
Американские ученые выяснили, что мыши при болезни Альцгеймера перестают узнавать сородичей из-за разрушения внеклеточного матрикса в одной из областей гиппокампа, что приводит к «расклеиванию» синапсов между нейронами. Это открытие позволяет понять, почему люди при болезни Альцгеймера также перестают узнавать своих близких — и как им помочь. Ведь в эксперименте на мышах развитие дефекта памяти предотвращалось введением ингибитора матриксных металлопротеиназ иломастата, а это дает надежду на разработку сходной терапии для людей.
Болезнь Альцгеймера — одна из лидирующих причин деменции по всему миру. Это тяжелое неизлечимое нейродегенеративное заболевание, неизбежно заканчивающееся летальным исходом. Помимо самого пациента, она тяжким бременем ложится на его родственников: наряду с общим снижением когнитивных способностей пациент постепенно утрачивает декларативную память буквально на все.
Декларативной памятью называется память о фактах, конкретных людях, местах и событиях, которую можно передать словами (то есть буквально «задекларировать»). Помимо нее, существует процедурная память, включающая умения и навыки.
Исследователи стараются на животных смоделировать дефекты декларативной памяти при болезни Альцгеймера, чтобы понять их механизм и найти лекарства, которые если не останавливали бы заболевание совсем, то хотя бы помогали сохранить память. Ранее «Элементы» рассказывали о том, что мыши с инактивированным геном фосфодиэстеразы 4B практически не теряют пространственную память, если на них смоделировать болезнь Альцгеймера, а значит, блокирование этого фермента могло бы помочь и заболевшим людям не теряться в собственном дворе (Мутация гена фосфодиэстеразы улучшила память мышей с болезнью Альцгеймера, «Элементы», 04.04.2024). Но еще одним тяжелым нарушением, развивающимся достаточно рано при болезни Альцгеймера, становится потеря социальной памяти.
Социальная память — это способность запоминать родственников, друзей, других знакомых, отличать их от других людей, связывать их образ с особенностями поведения или фактами из жизни. Потеря этой способности приводит людей с деменцией в ситуацию, когда они неспособны узнать ближайших людей — даже тех, кто за ними ухаживает. Проект DementiaByDay, оказывающий методическую помощь родственникам пациентов с деменцией, даже выпустил памятку (рис. 1) по распространенной ситуации: жена, страдающая болезнью Альцгеймера, не узнает своего мужа. Проект рекомендует мужу в таком случае притворяться другом семьи или соседом, чтобы избежать безуспешных попыток переубедить супругу. Но остается надежда: вдруг получится создать лекарство, которое позволило бы ей вообще не забыть некогда любимого человека?
За социальную память, как и за пространственную, отвечает гиппокамп — вытянутый и изогнутый участок древней коры, «завернутый» глубоко внутрь больших полушарий. Но социальная память имеет специфическую локализацию — она локализуется в области CA2 — одном из четырех полей гиппокампа (рис. 2), которые картируются в его поперечном сечении (то есть зона CA2, как остальные поля с кодом CA, протягивается через весь гиппокамп спереди назад, идя параллельно парагиппокампальной и зубчатой извилинам — другим важным частям древней коры).

Рис. 2. Слева — гиппокамп. Справа — гиппокамп в поперечном сечении, вместе с парагиппокампальной и зубчатой извилинами. Обозначены 4 области гиппокампа — CA1, CA2, CA3 и CA4, из которых в настоящей статье обсуждается область CA2. Аббревиатура CA означает латинское cornu ammonis — аммонов рог (устаревшее название гиппокампа). Рисунки с сайтов ru.wikipedia.org и en.wikipedia.org
Про критическое значение зоны CA2 для социальной памяти известно уже более десяти лет, а недавно группа исследователей Медицинской школы Университета Вирджинии заинтересовалась, а что, собственно, такое происходит в этой зоне при болезни Альцгеймера, что могло бы объяснить относительно избирательную потерю социальной памяти?
В зоне CA2 находятся пирамидальные клетки — нейроны, по форме сходные с пирамидальными клетками коры. Они образуют многочисленные синапсы с нейронами гиппокампа и других отделов мозга. Собственно, «усиление» или «ослабление» синапсов — увеличение или снижение их пропускной способности в ответ на стимулы — является нейрональной основой памяти, ее «языком кодировки». Но чтобы этот «код» сохранился надолго, синапсы должны быть чем-то стабилизированы. Роль такого «стабилизирующего клея» выполняют перинейрональные сети.
Это ничто иное, как разновидность внеклеточного матрикса — волокнистого материала, заполняющего пространство между клетками. Основной его составляющей являются высокомолекулярные комплексы из белков и сложных углеводов — протеогликаны (рис. 3).
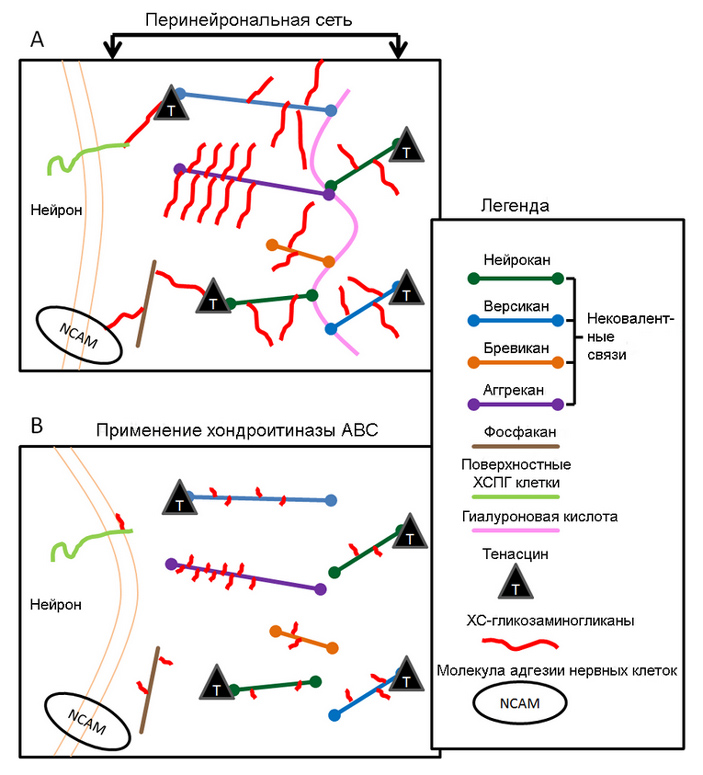
Рис. 3. Схема строения перинейрональной сети (вверху) и ее разрушения под действием фермента хондроитиназы. Адаптированный рисунок с сайта en.wikipedia.org
Перинейрональные сети — не исключение, у них просто особая структура и набор протеогликанов. Перинейрональных сетей мало в мозге детей, и они формируются с возрастом, по мере утраты синаптической пластичности. То есть их задача действительно состоит в консолидации каких-то синаптических связей. Логично предположить, что потеря памяти может быть связана с утратой перинейрональных сетей гиппокампа, из-за чего синапсы «расклеиваются» и теряют стабильность.
Чтобы это проверить, исследователи из Университета Вирджинии решили воспользоваться мышиными моделями. Социальная жизнь мышей, конечно, по сложности не сравнится с человеческой. Мышь не назовет другую мышь своим супругом или партнером и не окликнет друга по имени (а вот насчет дельфинов я бы не был так уверен). Но, тем не менее, социальную память у мышей проверить можно.
Мыши при первом контакте с сородичами знакомятся путем обнюхивания друг друга и груминга (ухода за шерсткой друг друга). Время, затраченное на такой контакт, можно измерить. В норме, у здоровых мышей (с хорошей социальной памятью), контакт с уже знакомыми сородичами короче, чем с теми, которых они видят первый раз. Но вот при болезни Альцгеймера мыши склонны терять социальную память и каждый раз проводить с уже знакомым сородичем столько же времени, сколько в первый раз — несмотря на то, что уже сидели с ним в одной клетке ранее.
Существуют линии «альцгеймеровских» мышей, несущие целый комплект генных мутаций в предрасполагающих к болезни генах. У таких мышей болезнь Альцгеймера развивается практически неизбежно в течение их короткой жизни. Ранее мы писали об эксперименте на таких линиях в упоминавшейся новости Мутация гена фосфодиэстеразы улучшила память мышей с болезнью Альцгеймера («Элементы», 04.04.2024). Исследователи из Университета Вирджинии использовали такой же подход, только мыши были с другим набором мутаций. (Вероятно, это не так важно — все то, о чем пойдет речь ниже, касается не пути запуска патологического процесса, а его конечных звеньев).
Прежде всего, исследователи выяснили, что период потери социальной памяти у «альцгеймеровских» мышей действительно совпал с активным разрушением перинейрональных сетей в зоне CA2 гиппокампа. Транскриптомный анализ показал, что в этот период в нейронах этой зоны снижается активность генов, задействованных в обучении и памяти, и повышается активность генов, связанных с воспалением — в том числе генов матриксных металлопротеиназ. Эти ферменты содержат в активном центре ион цинка и с его помощью расщепляют пептидные связи внеклеточного матрикса. Исследователи предположили, что именно активация матриксных металлопротеиназ из-за воспаления приводит к разрушению перинейрональных сетей и «стиранию» социальной памяти мышей.
Но post hoc non ergo propter hoc («после этого — не значит из-за этого»), так что исследователи провели еще два дополнительных эксперимента, чтобы доказать причинную связь разрушения перинейрональных сетей и потери социальной памяти. Для этого они отключили у мышей ген аггрекана (Acan) — ключевого протеогликана, необходимого для формирования перинейрональных сетей (обозначен фиолетовым на рис. 3). При этом дефект социальной памяти воспроизвелся, как если бы мыши страдали болезнью Альцгеймера — несмотря на то, что при таком дефекте характерные амилоидные бляшки в мозге мышей полностью отсутствовали.
Осталось понять: а может ли блокирование разрушения перинейрональных сетей остановить утрату мышами социальной памяти? Для этого исследователи попытались лечить их иломастатом (рис. 4) — ингибитором матриксных металлопротеиназ широкого спектра действия. Несмотря на то, что иломастат абсолютно бессилен против формирования в мозге амилоидных бляшек и гибели нейронов, он предотвращал потерю памяти мышами: те узнавали своих сородичей и при второй встрече нюхали и грумировали их уже меньше, чем при первой.
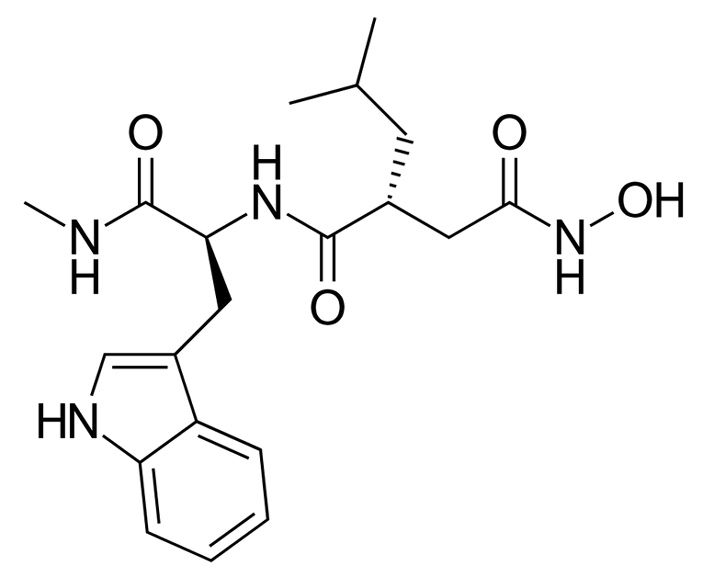
Рис. 4. Молекула иломастата напоминает две аминокислоты, соединенные пептидной связью. Это сходство с естественными субстратами протеаз позволяет ей проникать в их активные сайты и связываться с ними. Но, в отличие от белка, молекула иломастата не расщепляется. В результате протеаза ингибируется и межклеточный матрикс остается целым. Рисунок с сайта en.wikipedia.org
Это был ключевой и финальный аргумент: если блокаторы матриксных металлопротеиназ помогают сохранить социальную память при болезни Альцгеймера, значит дело действительно в разрушении перинейрональных сетей. Но открытие ценно еще и тем, что исследователи фактически смогли найти лекарство, устраняющее этот специфический дефект. Значит, есть надежда и для заболевших людей — пусть не прожить дольше, но хотя бы до конца жизни узнавать своих близких?
К сожалению, пока иломастат не одобрен для медицинского применения, и безопасность его для людей неясна. Тем не менее, он активно изучается геронтологами, ведь матриксные металллопротеиназы задействованы не только в разрушении перинейрональных сетей, но и, например, в старении кожи. Так что иломастат рассматривается как перспективное омолаживающее косметическое средство — а тема старения кожи довольно популярна. Есть шанс в скором времени получить новые сведения о возможности его применения у человека — и о его эффективности против забывания близких.
Источник: Lata Chaunsali, Jiangtao Li, Erik Fleischel, Courtney E. Prim, Izabela Kasprzak, Shan Jiang, Silky Hou, Miguel Escalante, Elise C. Cope, Michelle L. Olsen, Bhanu P. Tewari, Harald Sontheimer. Degradation of perineuronal nets in hippocampal CA2 explains the loss of social cognition memory in Alzheimer's disease // Alzheimer's & Dementia. 2025. DOI: 10.1002/alz.70813.
Георгий Куракин
-
Круто конечно, но это всего лишь ингибитор, он не сможет восстановить уже разрушенную структуру внеклеточного матрикса. И как заранее нужно начинать его принимать?
И надеяться, что «парфюмеры» ускорят введение этого иломастата в медицинскую практику - смешно. Максимум, глаза бедным кроликам намажут.-
Он не сможет восстановить уже разрушенную структуру внеклеточного матрикса – поэтому он не способен обратить забывание вспять. Он не сможет вернуть в память то, что уже забылось. Но он может предотвратить дальнейшее разрушение перинейрональных сетей и потерю синапсов – то есть остановить процесс потери памяти. Сохранить память на то, что человек ещё не забыл.
Болезнь Альцгеймера – довольно длительное заболевание. Очень часто от момента постановки диагноза до развития серьёзных нарушений социальной памяти проходит некоторое время. Вот его и стоит использовать. Я предполагаю, что в случае его одобрения препарат будет назначаться с момента постановки диагноза. А дальше уже потребуются наработки в сфере ранней диагностики болезнь Альцгеймера – чтобы выиграть для пациента больше времени.
Нанесение препарата на глаза кроликам делается не просто так. Это тест переносимости перед испытаниями на человеке. И если "парфюмеры" введут его в косметическую практику, то суммарная экспозиция препарата по популяции будет большой – и мы получим большой набор данных хотя бы по переносимости при наружном применении. И уже будет ясно, чего опасаться при испытаниях переносимости при системном применении, как построить исследование с минимальным риском и каковы шансы на успех (грантодателю нужны они).
То есть косметологи могут поучаствовать во внедрении препарата косвенно – и ничего плохого я в этом не вижу.-
Я предполагаю, что в случае его одобрения препарат будет назначаться с момента постановки диагноза.
Ну если потенциальные интересанты оценят будущий рынок в хорошую сумму, то всё пойдет как по маслу. Бабло побеждает зло. Хотя это конечно не оземпик ;)То есть косметологи могут поучаствовать во внедрении препарата косвенно – и ничего плохого я в этом не вижу.
Так я и не говорю, что это плохо. От косметологов тоже иногда бывает польза :)
-
-
Последние новости
























Рис. 1. Комикс проекта DementiaByDay, изображающий распространенную ситуацию при болезни Альцгеймера. Жена забыла своего мужа и принимает его за отца. Она еще и потеряла ориентировку во времени, думая, что им с ее пожилым мужем лишь немного за тридцать. По совету реабилитологов муж прекращает попытки переубедить жену — ее мозг уже не способен вернуться в реальность. Вместо этого он притворяется пожилым джентльменом, который был другом их семьи в молодости. Эта тактика успешна: он, по крайней мере, может вывести собственную жену на прогулку, сославшись на занятость мужа, с которым «говорил» только что. Рисунок с сайта dementiabyday.com