Мышей заразили болезнью Альцгеймера через кишечник

Болезнь Альцгеймера — самое распространенное нейродегенеративное заболевание. От него нет лекарства и, более того, ученым пока не известны даже надежные маркеры этой болезни, позволяющие диагностировать ее до проявления первых симптомов, ведь чтобы выявить главный симптом болезни Альцгеймера — бета-амилоидные бляшки, — нужно исследовать ткани головного мозга. Но если болезнь начинается не в мозге, а где-то еще, то у врачей будет возможность заметить ее на ранних стадиях и предотвратить прогрессию. Потенциальную возможность для этого установили ученые из Гонконга. В недавнем исследовании на мышах они обнаружили, что агрегаты бета-амилоида, введенные в стенку кишечника, способны проникнуть в мозг. Правда, все еще неясно, единственный ли это путь и используется ли он на самом деле.
Болезнь Альцгеймера, как и многие другие нейродегенеративные заболевания, — это «эпидемия», которая поражает головной мозг, постепенно распространяясь по нервной ткани. Начинается она, как правило, в гиппокампе и коре больших полушарий. Поэтому одним из первых симптомов болезни становятся проблемы с памятью. Затем движется по мозгу, захватывая таламус, средний мозг и, наконец, мозжечок, приводя к нарушению когнитивных и двигательных функций.
Движущей силой «эпидемии» служит пептид бета-амилоид (Aβ) — фрагмент мембранного белка АРР, который отщепляется с поверхности нейронов. Некоторые молекулы Aβ принимают неправильную форму, и на их поверхность выступают «липкие» гидрофобные участки. Такие неправильно свернутые молекулы становятся «семенами» — ядром для будущего белкового комка. Слипаясь друг с другом в нерастворимые агрегаты, они попутно заставляют и другие молекулы Aβ принимать искаженную форму, и так комок увеличивается и растет как снежный ком. В конце концов он принимает вид амилоидной бляшки (рис. 2) — внеклеточного скопления белков, по которому патолог опознает в ткани следы болезни Альцгеймера. В результате окружающие клетки оказывается под двойным ударом: помимо того что амилоид сам по себе может быть токсичен для нейронов, бляшки разрушают связи между ними и мешают транспорту веществ внутри ткани.
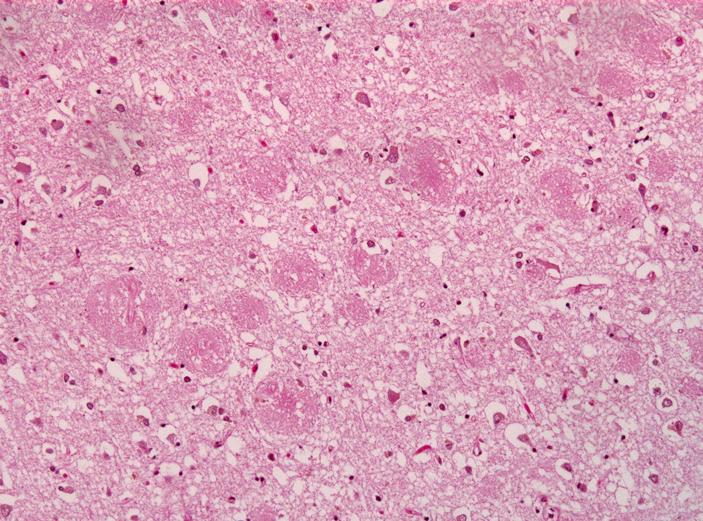
Рис. 2. Бета-амилоидные бляшки (крупные розовые пятна) в головном мозге пациента с болезнью Альцгеймера. Изображение с сайта commons.wikimedia.org
Несмотря на то что бета-амилоидные агрегаты считаются основным признаком болезни Альцгеймера, а их накопление — одной из главных ее причин, ни одна терапия, основанная на их уничтожении, пока не оказалась успешной. На момент написания этого текста большинство крупнейших мировых фармакологических компаний закрыли разработки лекарств от болезни Альцгеймера (на плаву остается только Biogen, однако данные его последних клинических испытаний тоже вызывают сомнения).
В чем причина этих неудач, пока неясно. Возможно, неверна исходная предпосылка, и амилоидные бляшки — ложная мишень, то есть они являются не причиной болезни, а ее симптомом. Но может быть, дело просто в том, что мы пытаемся вмешаться в процесс слишком поздно, когда бета-амилоидный «снежный ком» уже начал путешествие по ткани мозга, бляшки формируются, и уничтожение отдельных «снежинок» не может ни остановить «эпидемию», ни обратить нейродегенерацию. В таком случае нужно научиться распознавать симптомы болезни раньше, чем они становятся необратимыми. А поскольку ткани мозга в живом человеке анализировать трудно, маркеры ранних стадий болезни Альцгеймера ищут в более легкодоступных участках тела, например, в крови, глазах или спинномозговой жидкости — тоже, впрочем, пока тщетно.
Но что, если «эпидемия» начинается не в головном мозге, а в каком-нибудь другом органе? Мозг — не замкнутая система, в него можно попасть самыми разными способами: например, через гемато-энцефалический барьер или по входящим нервным волокнам. Если бы удалось найти внешний источник амилоидной патологии, то это, с одной стороны, объяснило бы неудачу традиционных подходов к лечению болезни Альцгеймера, а с другой — помогло бы ловить и пресекать ее в зародыше.
Эти догадки опираются на примеры других нейродегенеративных патологий, которые приходят в мозг извне. Так происходит с прионными белками, которые, подобно бета-амилоиду (точнее, это амилоид демонстрирует прионоподобное поведение), образуют в мозге «снежные комки». Патологические формы прионных белков попадают в мозг через кишечник: так, болезнь Крейтцфельда-Якоба можно подхватить через мясо коровы, а болезнь куру — через ритуальный каннибализм. В редких случаях заражение происходит через кровь — например, если человеку вводят препарат, полученный из мозга больного животного или другого человека (для болезни Альцгеймера, кстати, такие случаи тоже известны, см. Z. Jaunmuktane et al., 2015. Evidence for human transmission of amyloid-β pathology and cerebral amyloid angiopathy).
Похожие механизмы удалось найти и у близкого «родственника» болезни Альцгеймера — болезни Паркинсона. Белок, который ее вызывает (и тоже ведет себя как прион), — альфа-синуклеин — считают виновником того, что у больных нарушается работа кишечника. А в экспериментах на мышах нити альфа-синуклеина, которые животным вводили в мускулатуру кишечника, через месяц оказывались в головном мозге (см. S. Kim et al., 2019. Transneuronal propagation of pathologic α-synuclein from the gut to the brain models parkinson’s disease). Поэтому группа исследователей из Гонконга поставила своей целью выяснить, возможна ли и для бета-амилоида миграция из кишечника в мозг.
Для этого они вводили меченый флуоресцентными молекулами бета-амилоид в слизистую оболочку желудка и разных участков кишечника молодых мышей. Это позволило отслеживать распространение введенных молекул бета-амилоида по организму мышей in vivo буквально в прямом эфире. Оказалось, что уже через три часа после инъекции бета-амилоид начал проникать в подслизистую оболочку, в которой находятся мышцы и отростки нейронов, иннервирующих кишечник (рис. 3).

Рис. 3. Кишечник мышей через три часа после введения помеченных флуоресцентными красителями молекул бета-амилоида. Бета-амилоид светится красным, синим окрашены ядра клеток. А — срез кишечника, желтые стрелки указывают направление миграции амилоида. В, С — амилоид распространяется по подслизистой оболочке стенки кишечника. Изображение из обсуждаемой статьи в The Journal of Physiology
На третий день меченые молекулы можно было разглядеть еще только вокруг укола, через неделю область с ними начала медленно расползаться, а к концу первого месяца она захватила желудок и тощую кишку целиком (рис. 4).

Рис. 4. Путешествие флуоресцентного бета-амилоида по кишечнику мыши. Красный цвет соответствует максимальной интенсивности свечения помеченных молекул бета-амилоида. А и В — состояние через три часа после инъекции, С — через три дня, D — через неделю, E и F — через месяц. Изображение из обсуждаемой статьи в The Journal of Physiology
Через год после начала эксперимента бета-амилоид добрался и до мозга — бляшки нашли в волокнах блуждающего нерва, а также в гиппокампе, миндалине и коре больших полушарий. Амилоидные агрегаты удалось обнаружить и вокруг сосудов головного мозга. Этот симптом известен как церебральная ангиопатия, и он встречается у большинства пациентов с болезнью Альцгеймера, хоть и не служит диагностическим критерием (рис. 5).
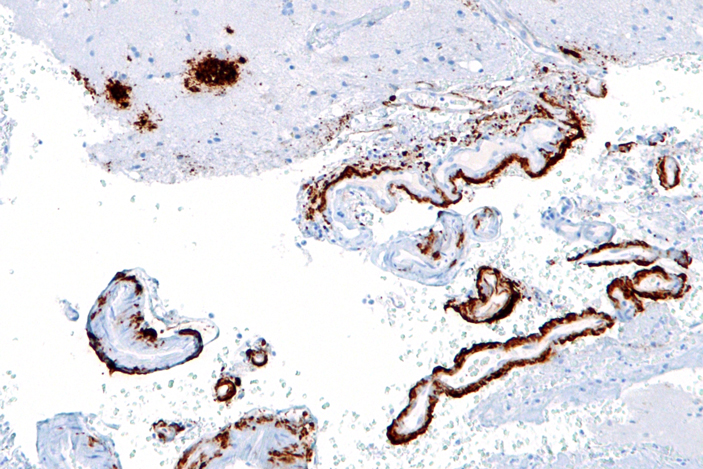
Рис. 5. Церебральная ангиопатия в головном мозге человека. Амилоидные бляшки показаны коричневым. Рисунок с сайта en.wikipedia.org
Через год авторы работы обнаружили у мышей и другие симптомы патологии. Они набрали вес (стали в среднем на 4,6 г тяжелее, чем их сородичи из контрольной группы) и стали на 20% больше есть. А вот отходов производили столько же, из чего исследователи сначала сделали вывод, что у мышей была нарушена работа кишечника. Тем не менее, с кишечником у мышей оказалось все в порядке, за исключением замедленных сокращений тощей кишки. Но это объяснимо: при болезни Альцгеймера, в отличие от болезни Паркинсона, кишечные симптомы возникают нечасто.
Зато у животных появились отклонения в когнитивных функциях. Например, когда им предлагали запомнить два объекта, а потом один из них заменяли на новый, они не уделяли ему больше внимания, чем знакомому. Это, по мнению авторов, говорит о проблемах с долговременной памятью.
Симптомы, которые авторы работы наблюдали у мышей, не в полной мере воспроизводят человеческую болезнь Альцгеймера. Однако стоит иметь в виду, что мыши не болеют ей сами по себе, а похожую на нее патологию удавалось вызвать только у трансгенных животных, которые производили аномально много белка-предшественника амилоида APP. В обсуждаемой работе использовали обычных животных, не склонных к агрегации амилоида, поэтому не удивительно, что и симптомы болезни у них проявились лишь частично. Тем не менее, исследователям удалось впервые показать, что бета-амилоид, подобно прионным белкам и альфа-синуклеину, может проникать в головной мозг из кишечника.
После этой работы остаются открытыми как минимум два важных вопроса. Во-первых, возможна ли такая миграция бета-амилоида у людей и происходит ли она в действительности у пациентов с болезнью Альцгеймера? Или все-таки это путь, который может быть реализован теоретически, но не встречается на практике? Во-вторых, какую именно дорогу использует бета-амилоид? Тот факт, что его удалось обнаружить в блуждающем нерве, подсказывает, что он может распространяться по чувствительным волокнам, которые идут из кишечника в мозг. По крайней мере, именно так «передвигается» альфа-синуклеин, и его миграцию можно предотвратить, если эти волокна перерезать. Но может быть и так, что бета-амилоид мигрирует в мозг через кровь (известно, например, что его способны пронести в мозг макрофаги, см. A. F. Cintron et al., 2015. Transport of cargo from periphery to brain by circulating monocytes) — подобно, опять же, альфа-синуклеину и прионам. А если окажется, что для распространения из кишечника в мозг существуют разные пути, то это значит, что единым биомаркером для начинающейся болезни Альцгеймера обойтись не удастся, и придется искать такие маркеры в нескольких местах организма одновременно.
Источник: Y. Sun, N. R. Sommerville, J. Y. H. Liu, M. P. Ngan, D. Poon, E. D. Ponomarev, Z. Lu, J. S. C. Kung, J. A. Rudd. Intra‐gastrointestinal amyloid‐β1–42 oligomers perturb enteric function and induce Alzheimer's disease pathology // The Journal of Physiology. 2020. DOI: 10.1113/JP279919.
Полина Лосева
-
Что мешает классифицировать Альцгеймер как прионную болезнь, раз бета-амилоиды имеют так много общего с прионами?
-
Прионными болезнями, я так понимаю, считают только те, которые вызваны конкретным прионным белком. Все остальные - прионоподобные. К тому же, в случае прионных болезней белок выступает настоящим инфекционным агентом. С Альцгеймером такое бывает крайне редко, и очевидно, что, если это и возможно, то это не основная причина возникновения болезни.
-
С Альцгеймером такое бывает крайне редко, и очевидно, что, если это и возможно, то это не основная причина возникновения болезни.
??? Так вроде данное исследование как раз и показывает, что бета-амилоид явился инфекционным агентом и причиной болезни. Раз его ведение вызвало характерные для болезни Альцгеймера нарушения у животных, которые этим недугом вообще обычно не болеют.
Альцгеймер и в других своих аспектах "крякает" вполне по-прионному: позднее появление симптомов, наследуемость, характер распространения бляшек в мозгу, напоминающий транссинаптический инфективный процесс и т.д. Хотя, очевидно, что этиология болезни в случае Альцгеймера более комплексная и включает также и другие факторы.-
Прионные болезни означают размножение прионов. Крохотное количество введенного приона вскоре размножается и приводит к смерти.
Здесь же изначально введено было большое количество бета-амилоида. Никакого его размножения, если я правильно понял, не наблюдалось.-
Прионные болезни означают размножение прионов.
В мозгу больных Альцгеймером амилоидный белок как раз этим и занимается.Крохотное количество введенного приона вскоре размножается и приводит к смерти.
Не критерий. У некоторых наследуемых прионных болезней инфекционной передачи (дозозависимой или нет) между некровными родственниками не наблюдалось. (Хотя, нарочно прионы никто никому не пытался вводить, разумеется.) Например, у фатальной семейной бессонницы. https://en.wikipedia.org/wiki/Fatal_insomnia-
> "В мозгу больных Альцгеймером амилоидный белок как раз этим и занимается."
Так вот это как раз и не доказано - ни теоретически, ни экспериментально.
> "У некоторых наследуемых прионных болезней инфекционной передачи (дозозависимой или нет) между некровными родственниками не наблюдалось."
Но это не значит, что у них прионы не размножаются. Это значит, что у них в мозгу с возрастом самопроизвольно возникают (в ничтожных количествах) первые прионы, которые в дальнейшем уже быстро размножаются в том же мозгу.-
Так вот это как раз и не доказано - ни теоретически, ни экспериментально.
Вы о чём?
Читаем второй абзац: "Некоторые молекулы Aβ принимают неправильную форму, и на их поверхность выступают «липкие» гидрофобные участки. Такие неправильно свернутые молекулы становятся «семенами» — ядром для будущего белкового комка. Слипаясь друг с другом в нерастворимые агрегаты, они попутно заставляют и другие молекулы Aβ принимать искаженную форму, и так комок увеличивается и растет как снежный ком."
Когда говорится о размножении прионных белков, имеется в виду именно этот механизм.-
Сам процесс, описанный в этом втором абзаце, происходит при кристаллизации многих белков. Но для того, чтобы он вызвал болезнь, нужно еще, чтобы:
1) Оказавшись в здоровом (до этого) мозгу, такая бляшка только росла, а не растворялась обратно при изменении условий;
2) Выросши, она распадалась на части - дочерние бляшки, которые тоже будут расти;
3) А в здоровом мозгу подобных бляшек вообще не бывает.
Так вот это как раз и не доказано - ни теоретически, ни экспериментально.
Не доказано, что введение в мозг ничтожного количества упомянутых "семян" из молекул Aβ приводит к массовому появлению "комков". В то время как для прионов подобное отлично доказано.
И в статье как раз об этом и сказано ниже: "Возможно, неверна исходная предпосылка, и амилоидные бляшки — ложная мишень, то есть они являются не причиной болезни, а ее симптомом."-
Не имеет смысла комментировать уже остывшие темы, но поскольку Вы так усердствовали, чтобы меня убедить...
В следующий раз договоритесь с самим собой, о чем именно спорите - о том, что бета амилоиды в мозгу не делают никакой propagation, или что делают, но болезни не вызывают. По второму вопросу можно спорить, но его нельзя использовать для ответа на первый. :)
В догонку, ещё немного про амилоидных мышей-маразматиков: https://actaneurocomms.biomedcentral.com/articles/10.1186/s40478-018-0529-x -
Что только Вы не делаете, чтобы не признавать свою ошибку :)
>В следующий раз договоритесь с самим собой, о чем именно спорите - о том, что бета амилоиды в мозгу не делают никакой propagation, или что делают, но болезни не вызывают.
РОСТ бляшки и ее РАЗМНОЖЕНИЕ - это разные вещи. Размножение - по самому смыслу слова - означало бы, что:
- из одной введенной в мозг (или самопроизвольно возникшей там) бляшки возникают новые, такие же;
- и в то же время, что если бляшку не ввести (или удалить), то никаких других бляшек не появится.
Для прионов это доказано. Для амилоидных бляшек - нет.
Это я уж не говорю о такой "мелочи", что бывает болезнь Альцгеймера вообще без бляшек: https://en.wikipedia.org/wiki/Alzheimer's_disease#Osaka_mutation
-
-
-
-
-
-
-
-
Я в данном случае имела в виду, что бета-амилоид в природе не является инфекционным агентом. Случаи с попаданием его в кровь - редкие и искусственно созданные. Можно так же сказать, что раковая опухоль - инфекционный агент, потому что в некоторых случаях она может передаваться от беременной женщины к плоду или от больного к хирургу, который его оперирует, но это единичные случаи, и явно не основной путь, которым человек может обзавестись опухолью.
Что же касается причины - то здесь до сих пор все сложно. Амилоид вызывает у мышей симптомы, которые напоминают человеческий Альцгеймер. Но поскольку мыши все-таки не болеют Альцгеймером в классическом понимании и демонстрируют не все симптомы, то знак равенства я бы опасалась здесь ставить. Кроме того, есть и другие процессы в мозге, которые связаны с болезнью Альцгеймера - накопление агрегатов тау-белка, например, воспаление, нейродегенерация, нарушение гематоэнцефалического барьера - и до сих пор, строго говоря, не очевидно, что здесь причина, а что следствие. То, что сам по себе бета-амилоид вызывает часть характерных симптомов, не означает, что цепочка начинается именно с него.
-
-
Это хороший вопрос. Не уверена, что я где-то встречала на него ответ. Здесь есть несколько отдельных поводов для размышления, например 1) насколько по мышам можно судить о когнитивных нарушениях, характерных для людей (там начинаются вечные споры, вроде того: это мышь медленнее бежит по лабиринту, потому что забыла дорогу, потому что ей некомфортно или потому что ноги плохо бегают) 2) почему у мышей не встречаются в норме мутации, характерные для людей с Альцгеймером и так далее.
Но наверняка есть и еще какие-то механизмы, которые у них отличаются, и поэтому не замыкаются в тот круг, который у нас вызывает нейродегенерацию.
интересно, почему из этого сделан вывод, что кишечник стал работать хуже. Он, получается, расщепляет пищу гораздо полнее, чем в контрольной группе, раз выход не возрос при возрастании поступления.
-
Да, здесь не самая очевидная логическая цепочка. В статье подробнее не написано, поэтому за авторов ответить не решусь. Могу только предположить, что их в целом смутило несоответствие двух параметров, и они решили, что в промежутке между входом и выходом пищи что-то пошло не так. Впрочем, потом эта идея все равно не подтвердилась.
Последние новости






















Рис. 1. Накопление бета-амилоида в блуждающем нерве мышей. Разными красителями окрашены разные части нерва: синим — ядра нейронов, зеленым — отростки нейронов, красным — молекулы бета-амилоида. А — мыши из контрольной группы, В — мыши, получившие инъекцию физраствора, C и D — мыши, получившие инъекцию бета-амилоида в кишечник. Длина масштабных отрезков — 20 мкм. Изображение из обсуждаемой статьи в The Journal of Physiology