Нобелевская премия по физиологии и медицине — 2025

В 2025 году Нобелевскую премию по физиологии и медицине присудили Мэри Брункоу (Mary E. Brunkow), Фреду Рамсделлу (Fred Ramsdell) и Симону Сакагути (Shimon Sakaguchi). Каждый из них получит по трети награды за «открытия в области периферической иммунной толерантности». Сакагути доказал существование регуляторных Т-клеток (Т-лимфоцитов), а Брункоу и Рамсделл выяснили, что развитие и работу таких клеток нарушают мутации в гене Foxp3. Регуляторные Т-клетки — один из важных инструментов организма для предотвращения аутоиммунных заболеваний. Потенциально на них можно воздействовать и для борьбы с опухолями, но пока этим занимаются только в рамках клинических исследований.
Современная иммунология — область, в которой все очень быстро меняется. То, что еще двадцать-тридцать лет назад упоминали в учебниках, уже порой опровергнуто. Кто-то из читателей наверняка помнит деление одного из типа клеток иммунной системы, Т-лимфоцитов, на три группы: Т-хелперы, Т-киллеры и Т-супрессоры. Однако сейчас классификация Т-клеток выглядит по-другому. Существование третьей группы, Т-супрессоров, долгое время не удавалось доказать. Один из лауреатов этого года смог это сделать, но оказалось, что в молекулярном плане эти клетки не такие, какими их представляли. Да и назвали их иначе — Т-регуляторы, они же регуляторные Т-клетки, или Treg.
Коротко о лимфоцитах
Иммунитет делят на врожденный и приобретенный (адаптивный). Первый действует быстрее, но менее разборчив. На активацию второго нужно больше времени, но он позволяет «запомнить» то, что когда-то проникло в организм, и в следующие разы атаковать такой же чужеродный объект быстрее. Открытие, отмеченное Нобелевское премией, относится к области приобретенного иммунитета.
Адаптивный иммунитет обеспечивают две группы клеток: Т-лимфоциты и B-лимфоциты. И те, и другие способны связываться с антигенами — чуждыми (в норме) организму молекулами. Для этой цели на поверхности Т-клеток размещаются Т-клеточные рецепторы (ТКР), а на мембранах B-клеток — антитела и молекулы главного комплекса гистосовместимости (ГКГ).
Часто в случае человека употребляют понятие «человеческий лейкоцитарный антиген», а термин «главный комплекс гистосовместимости» используют для других видов. Здесь мы будем пользоваться второй фразой, поскольку многие упомянутые исследования проводились не на людях.
Т-клетки «созревают» и получают специализацию в тимусе — железе, которая у человека располагается за верхней частью грудины. Зрелые Т-лимфоциты делят на две группы. Одни, Т-киллеры (они же цитотоксические Т-лимфоциты), уничтожают содержащие антиген зараженные клетки организма. Другие, Т-хелперы, выделяют вещества, которые влияют на активность других типов клеток иммунной системы. Отличить цитотоксические лимфоциты от хелперов можно по дополнительным рецепторам к их ТКР — так называемым кластерам дифференцировки (cluster of differentiation, CD). На поверхности Т-киллеров присутствуют молекулы CD8, на поверхности Т-хелперов — CD4.
B- и Т-лимфоциты взаимодействуют: в ряде случаев первые «показывают» (презентуют) антигены и некоторые другие молекулы вторым, и те активируются. Кроме B-клеток презентовать антиген Т-лимфоциту могут и некоторые другие типы клеток, несущие один из типов ГКГ; все они за эту свою особенность называются антигенпрезентирующими (рис. 2).

Рис. 2. Взаимодействие Т-лимфоцита и антигенпрезентирующей клетки. Пояснения в тексте. MHC I — главный комплекс гистосовместимости I, MHC II — главный комплекс гистосовместимости II, TCR — Т-клеточный рецептор. Изображение с сайта ru.wikipedia.org
Отбор Т-лимфоцитов
Функциональная иммунная клетка должна быть «враждебна» к молекулам других организмов и толерантна к «нормальным» веществам в составе родного организма. Чтобы соблюсти эти два условия, среди незрелых лимфоцитов ведется отбор, который устраняет недостаточно или избыточно реактивные клетки.
Потенциально ТКР и антитела на поверхности B-лимфоцитов способны различать огромное количество антигенов (более 1015), поскольку у каждого нового лимфоцита гены этих рецепторов собираются заново из нескольких фрагментов ДНК. Часть этих фрагментов в ходе особой перестройки хромосом (см. V(D)J-рекомбинация) меняется местами, часть удаляется, и в результате каждый лимфоцит получает уникальный набор ТКР или антител.
Не все получившиеся ТКР реагируют на нужные антигены и ГКГ, и не все Т-лимфоциты несут на поверхности оптимальное количество рецепторов. Какие-то из Т-клеток оказываются не в состоянии связаться с молекулами ни одного из главных комплексов гистосовместимости. (Их будущим Т-киллерам или Т-хелперам впервые демонстрируют специальные антигенпрезентирующие клетки в тимусе.) Какие-то, напротив, связываются с ними настолько прочно, что «воспринимают» ГКГ как антигены. И недостаточно, и избыточно активные Т-лимфоциты уничтожаются еще в месте их созревания. В результате выживает всего около трех процентов всех содержащихся в тимусе незрелых Т-клеток.
Тем не менее такой отбор не застрахован от ошибок. И если для другого критически важного процесса — репликации ДНК — механизмы устранения таких ошибок давно известны (это репарация, ее механизмы изучают с 1960-х годов), то механизм остановки «упущенных» в тимусе клеток, запускающих иммунный ответ при встрече с молекулами собственного организма, долго скрывался от биологов.
Долгое время наличие механизма устранения ошибок тимуса вообще не удавалось доказать, хотя было понятно, что он существует. Так, в 1973 году Уильям Пенхейл (William Penhale) продемонстрировал, что у 60% крыс линии Wistar после удаления тимуса развивается тиреоидит (см. W. Penhale et al., 1973. Spontaneous thyroiditis in thymectomized and irradiated Wistar rats). Это вряд ли могло бы произойти, если бы все дающие аутоиммунную реакцию Т-клетки были бы уничтожены еще в тимусе.
Считалось, что существуют Т-супрессоры — лимфоциты, которые, как и Т-киллеры, несут на мембране молекулы CD8 (см., например, J. Gray, M. Hirokawa, D. Horwitz, 1994. The role of transforming growth factor beta in the generation of suppression: an interaction between CD8+ T and NK cells). Было известно, что они каким-то образом подавляют выработку антител другими клетками, но каким именно, не получалось точно установить. Кроме того, не находили молекул-маркеров, по которым можно бы было однозначно отличить супрессоры от других Т-лимфоцитов.
«Нобелевские» исследования
Японский иммунолог Симон Сакагути в 1982 году провел эксперимент, похожий на тот, что был в работе Пенхейла. Он удалял у трехдневных лабораторных мышей-самок тимус, и у тех появлялись признаки воспаления яичников. Но когда таким мышам вводили Т-клетки с определенными молекулами-маркерами, самочувствие животных улучшалось (S. Sakaguchi, T. Takahashi, Y. Nishizuka, 1982. Study on cellular events in post-thymectomy autoimmune oophoritis in mice. II. Requirement of Lyt-1 cells in normal female mice for the prevention of oophoritis).
В последующие годы биологи уточнили, какие именно Т-клетки «успокаивают» иммунитет животных без тимуса. Выяснилось, что это лимфоциты, которые имеют на поверхности одновременно молекулы CD25 и CD4.
CD25 — это часть рецептора к интерлейкину-2, сигнальному веществу, которое воспринимают и некоторые Т-киллеры с CD8 на мембране. Возможно, из-за этого сначала сложилось впечатление, что Т-супрессоры — это лимфоциты с CD8.
В 1995 году Сакагути фактически уточнил свой предыдущий эксперимент и на этот раз вводил мышам без тимуса либо только клетки с CD25 и CD4 из чужих селезенок, либо все клетки донорской селезенки за исключением нужных. В качестве контроля выступали мыши, которые после удаления тимуса получали все клетки донорской селезенки. Аутоиммунные реакции развились только у тех, кому не досталось лимфоцитов с маркерами CD25 и CD4 (рис. 3). На отторжение тканей других мышей эти клетки тоже влияли: в их отсутствии иммунный ответ на трансплантаты был сильнее (см. S. Sakaguchi et al., 1995. Immunologic Self-Tolerance Maintained by Activated T Cells Expressing IL-2 Receptor α-Chains (CD25). Breakdown of a Single Mechanism of Self-Tolerance Causes Various Autoimmune Diseases).
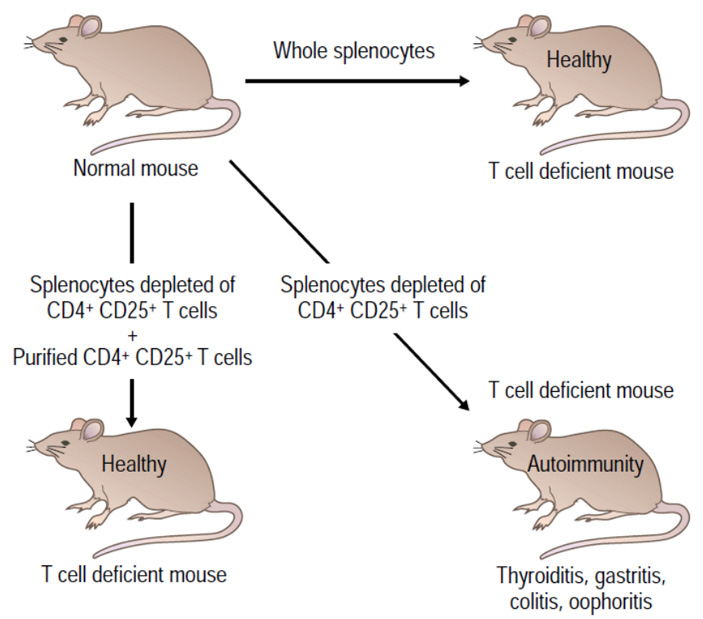
Рис. 3. Эксперимент Сакагути 1995 года. Изображение из R. Rich et al (eds). Clinical Immunology: Principles and Practice (Elsevier, 2008. P. 251.)
В исследовании 1995 года ученые лишили экспериментальных животных не только тимуса: соответствующие лимфоциты в периферических структурах иммунной системы, лимфоузлах, у тех мышей тоже были уничтожены. То есть собственных лимфоцитов с CD25 и CD4 у них не осталось.
Т-лимфоциты с CD4 и CD25 на поверхности получили название регуляторных Т-клеток (Treg). К 2003 году биологи выявили еще одну ключевую молекулярную особенность Treg: в них активен ген Foxp3. Если его «выключить», иммунный ответ организма на свои и чужие структуры усилится.
Сам ген Foxp3 за два года до этого обнаружили два других нынешних нобелевских лауреата — Мэри Брункоу и Фред Рамсделл. Они вместе с несколькими другими сотрудниками компании Celltech Bioscience изучали мышей с мутацией scurfy (дословно «покрытый чешуйками»). Самцы с этой мутацией страдают анемией и диареей, у них избыток лейкоцитов, шелушится кожа, недоразвиты половые железы и крайне снижен вес. Такие мышата живут меньше месяца. У людей проявляется похожий синдром — IPEX (immune dysregulation, polyendocrinopathy, enteropathy, X-linked syndrome, по-русски синдром Х-сцепленной иммунной дисрегуляции, полиэндокринопатии и энтеропатии).
Учитывая, что самки, как правило, не проявляют такого набора симптомов, ученые предположили, что мутация scurfy затрагивает какой-то из генов на X-хромосоме (у самок их две, и наличие нормальной копии может компенсировать дефект второй Х-хромосомы). Исследователи уточнили область хромосомы, затронутую мутацией, и дали название найденному гену (Foxp3). Продукт этого гена стали именовать скурфин. Гомологичный ген, ответственный за синдром иммунной дисрегуляции, нашли и у людей (см. C. Bennett et al., 2001. The immune dysregulation, polyendocrinopathy, enteropathy, X-linked syndrome (IPEX) is caused by mutations of FOXP3). Показано, что если доставить в CD4-клетки функциональную копию Foxp3 или «включить» там уже имеющуюся, такие лимфоциты станут регуляторными.
Сейчас регуляторным Т-лимфоцитам посвящают целые главы в учебниках иммунологии. Известно, что почти все эти клетки получают свои регуляторные способности в тимусе, хотя небольшое количество Treg становятся таковыми на периферии иммунной системы. Более того, есть возможность создавать индуцированные регуляторные Т-клетки «в пробирке».
Потенциальные применения
Пока регуляторные Т-лимфоциты не вошли в медицинскую практику, но клинические исследования их применений уже ведутся. Сейчас на сайте clinicaltrials.gov зарегистрировано около двухсот испытаний Treg. Правда, статус некоторых из них неизвестен.
Число и активность регуляторных Т-лимфоцитов можно увеличивать. Это должно быть полезно при лечении аутоиммунных заболеваний и аллергий, а также для профилактики отторжения органов и тканей при трансплантации. А уменьшение количества Treg и (или) снижение их активности, скорее всего, пригодятся в борьбе со злокачественными опухолями.
Повысить активность Treg-клеток можно, если подействовать на них интерлейкином-2 (IL-2), предварительно изъяв из организма, а затем «вернуть на место». Теоретически это могло бы помочь в борьбе с аутоиммунным диабетом первого типа. Однако пока клинические исследования не показали эффективности такого метода лечения. По крайней мере, единичного введения регуляторных Т-лимфоцитов недостаточно (C. Bender et al., 2024. A phase 2 randomized trial with autologous polyclonal expanded regulatory T cells in children with new-onset type 1 diabetes).
Зато похожий метод сработал в случае атопического дерматита (J. Silverberg et al., 2024. The regulatory T cell-selective interleukin-2 receptor agonist rezpegaldesleukin in the treatment of inflammatory skin diseases: two randomized, double-blind, placebo-controlled phase 1b trials). Правда, в этом случае на регуляторные Т-лимфоциты воздействовали IL-2, не извлекая их из организма.
Также есть возможность создать «дизайнерские» регуляторные Т-клетки: заменить им часть рецепторов на те, что будут соединяться с желаемым антигеном. К примеру, такие видоизмененные Treg-клетки потенциально облегчат состояние пациентов с целиакией. При этом заболевании мутации в ряде генов приводят к тому, что глютен (клейковина) злаков слишком прочно связывается с лейкоцитами и провоцирует воспаление в тонком кишечнике. В недавнем исследовании на мышах ученые из Швейцарии использовали Treg-лимфоциты, которые связываются с компонентами глютена (R. Porret et al., 2025. T cell receptor precision editing of regulatory T cells for celiac disease). В ответ на введение глютена через зонд эти клетки мигрировали в кишечник и там подавляли активность Т-хелперов, которые в противном случае усиливали бы иммунный ответ на глютен.
Регуляторные Т-лимфоциты способствуют росту опухолей, когда подавляют активность атакующих эти опухоли клеток иммунной системы. Соответственно, ослабив действие Treg, мы облегчим борьбу с новообразованиями. На практике это попробовали сделать исследователи компании Bayer. Они применили разработанное ими антитело, которое связывается с одним из рецепторов на поверхности внутриопухолевых Treg-клеток (H. Roider et al., 2024. Selective depletion of tumor-infiltrating regulatory T cells with BAY 3375968, a novel Fc-optimized anti-CCR8 antibody). Регуляторные Т-лимфоциты, помеченные такими антителами, атаковали цитотоксические клетки, и благодаря этому удавалось уменьшить размер опухоли.
Регуляторные Т-клетки и выходец из России
Конечно, нынешние нобелевские лауреаты не единственные, кто занимался (и занимается) темой регуляторных Т-лимфоцитов. Один из видных исследователей в этой области — выходец из России Александр Руденский. Как и Сакагути (S. Hori et al., 2003. Control of Regulatory T Cell Development by the Transcription Factor Foxp3), и Рамсделл (R. Khattri et al., 2003. An essential role for Scurfin in CD4+CD25+ T regulatory cells), он в 2003 году опубликовал статью о важности гена Foxp3 для развития Treg-клеток (J. Fontenot et al., 2003. Foxp3 programs the development and function of CD4+CD25+ regulatory T cells). Более того, работы Руденского и Рамсделла вышли в одном номере журнала Nature Immunology и размещены там на соседних страницах.
Наконец, Руденский, Сакагути и Рамсделл разделили в 2017 году другую шведскую награду за заслуги в науке — премию Крафорда (Crafoordpriset). Вместо номинации «Физиология и медицина» в рамках этой премии присуждают награды за «исследования в области полиартрита». Полиартритом называют множественные воспаления суставов, чаще всего вызванные аутоиммунными заболеваниями. Достижения, которые касаются его изучения, вынесли в отдельную номинацию, так как один из основателей премии, Хольгер Крафорд (Holger Crafoord), в конце жизни страдал от ревматоидного артрита.
Как мы знаем, Treg-клетки теоретически можно использовать в борьбе с аутоиммунными болезнями. Этим объясняется формулировка основания премии Крафорда в 2017: «за открытия, касающиеся регуляторных Т-лимфоцитов, которые противодействуют неадекватным иммунным реакциям при артрите и других аутоиммунных заболеваниях». Почему среди лауреатов другой премии Шведской королевской академии наук не оказалось Руденского, неизвестно. Однако в расширенной версии пресс-релиза о Нобелевской премии этого года его работы, как и других исследователей Treg-клеток, упоминаются.
Светлана Ястребова
-
Со слов шефа (они в 90-е работали/конкурировали с Руденским в области кросс-презентации антигенов и MHC компартмента): он просто во время почуял потенциал и важность Foxp3 и начал работать по этой теме, сделали мышей нокаутных по Foxp3, и т.д. Его вклад большой и заслуживает премий. Но впервые описал Foxp3 не он.
-
-
Ребята работают с такой темой... Не придумано для них еще испытательных стендов и тренажеров. Виртуальная реальность тоже не поможет. Ии тож тупит пока. Приходится на живых пробовать. Хорошо хоть на мышах.
-
в новосибирском академгородке целый виварий построили - работают с размахом
https://www.icgbio.ru/blog/2025/08/14/akademgorodok-nauka-na-lapkah/ -
Конкретно этот виварий (про который статья по ссылке) - конвенциональный виварий Института цитологии и генетики (ИЦиГ) - построили ещё при СССР, лет 50 назад. А кроме него в новосибирском Академгородке есть, как минимум, ещё три вивария: в Институте нейронаук и медицины, в НМИЦ им. акад. Е.Н. Мешалкина и - самый новый, открытый около 15 лет назад - второй виварий ИЦиГ. Второй виварий ИЦиГу понадобился т.к. он построен по стандарту SPF (specific pathogen free), там соблюдается суровый "антимикробный" режим. А конвенциональный виварий сохранили т.к. у ИЦиГа есть несколько ценных коллекций, в т.ч. линий животных собственной селекции, которые просто так в SPF виварий не переселишь (насколько я помню, для этого обычно используют суррогатное материнство: оплодотворенную яйцеклетку животного переселяемой линии подсаживают в "микробно чистую" самку из SPF вивария; иначе есть риск занести в SPF виварий какую-нибудь заразу). Но уж если где в Новосибирске и проводить эксперименты на животных с нарушениями иммунитета, то именно в SPF-виварии, а не в конвенциональном.
-
-
-
-
Брункоу родилась в 1961 году в Портленде, штат Орегон . Она окончила Академию Святой Марии в Портленде в 1979 году.
Брунков получила степень бакалавра наук по молекулярной и клеточной биологии в Вашингтонском университете в 1983 году и степень доктора философии по молекулярной биологии в Принстонском университете в 1991 году. Её научным руководителем была Ширли М. Тилгман .
В чем повесточка? Академию Святой Марии? Или руководитель Ширли-Мырли Тилгман?-
Бают, у нее нет достижений от слова "вообще" (в отличие от Руденского, например), кроме постдоковской работы по секвенированию FOXP3 (уровень заурядного МНС). И пабмед это, вроде бы, подтверждает (https://pubmed.ncbi.nlm.nih.gov/?term=Brunkow+ME) - на мой взгляд, но я не спец, поэтому и интересуюсь мнением компетентных товарищей. Повесточка понятна - Ж тоже человек, т.е. учоный. "Голубь, если он в подливе, не хужее глухаря."
-
Ну х.з. грозоотметчик Попова (уровень сельского клуба юных техников) тоже Радио FM не ловил, но Попов считается "изобреталетем", хотя нобелевку Маркони в 1909г дали.
А может тоже повесточка, что СССР вперди планеты всей. МНЕ кажется там без повесточек вообще никак. Дадут Трампу нобелевку тогда поглядимю
-
2. Судя по тому, что соавторство во всех трёх вышеупомянутых статьях имеется только у Мэри Брункоу и Фреда Рамсделла, именно они двое были ключевыми его участниками. При этом Мари Брункоу является первым автором самой большой статьи из трёх и последним (обычное место для руководителя исследования) - в ещё одной. Если премия дана за это исследование, то логично, что ее получили именно Брункоу и Рамсделл.
3. Статей у Мэри Брункоу действительно не слишком много (но почти все в журналах из Q1). Однако Нобелевская премия даётся не за "публикационную активность", а за прорывные исследования. При этом, если я правильно понял, Мэри Брункоу всю свою карьеру работала не в академической науке и не в университетах, а в частных биотехнологических исследовательских фирмах. А там акцент на публикациях гораздо меньше.
4. Допускаю, что Мэри Брункоу "просто" повезло оказаться в нужное время в нужном месте. Но это вопрос удачи, а не "повестки".
Итог. Признаков "повесточности" во включении Мэри Брункоу в число лауреатов этой Нобелевской премии я не вижу. Я недостаточно компетентен чтобы оценивать заслуживает ли открытие FOXP3 Нобелевской премии, но если да, то место Мэри Брункоу в списке лауреатов вполне заслуженное.
Последние новости


См. также

















Рис. 1. Лауреаты Нобелевской премии по физиологии 2025 года. Слева направо: Мэри Брункоу (Mary E. Brunkow), Фред Рамсделл (Fred Ramsdell), Симон Сакагути (Shimon Sakaguchi). Фото с сайтов hood.isbscience.org и en.wikipedia.org