Метиллитий в кубе
Задача
B начале XX века химики научились делать соединения щелочных металлов (лития, натрия, калия) с углеводородами. Связь металл-углерод в таких соединениях очень поляризована (почти ионная). Другими словами, атом металла «норовит» отдать электрон углероду. Таким образом, на углероде образуется отрицательный заряд, а на металле остается положительный. Отрицательный заряд одной молекулы должен притягиваться к положительному другой, поэтому ученые предполагали, что в растворе и в кристаллическом состоянии будут получаться агрегаты из нескольких молекул органолитиевого (содержащего связь углерод-литий; см. Металлоорганическая химия) соединения. Однако то, каким образом молекулы выстраиваются и взаимодействуют между собой внутри агрегатов, оставалось загадкой.
Несколько позже был разработан метод расшифровки молекулярных структур рентгеноструктурным анализом (РСА). Когда исходя из полученных данных расшифровали структуру самого простого из соединений углеводорода с литием — метиллития (СН3Li, CH3-метил), — исследователи получили следующее изображение отдельного агрегата (рис. 1). Множество таких агрегатов образуют кристалл.

На картинке показан агрегат, состоящий из четырех молекул метиллития (тетрамер). Эта структура, на первый взгляд, выглядит очень необычно: положительно заряженные атомы лития в середине структуры образуют тетраэдр. Но ведь положительные атомы лития, по идее, должны друг от друга отталкиваться, как магниты, которые повернуты друг к другу одинаковым полюсом!
Отрицательно заряженные метильные группы находятся на периферии, и каждая метильная группа связана с тремя атомами лития одновременно (на рисунке это показано как связь от углерода к центру литиевого треугольника; металлоорганические соединения натрия и калия имели похожую структуру). Но ведь углерод четырехвалентен, у него не может быть больше четырех ковалентных связей.
Что же тут происходит? Почему атомы лития не отталкиваются друг от друга? Каким образом у углерода оказалось шесть связей?
Подсказка 1
При некоторых условиях вместо тетрамера из органолитиевого соединения можно получить димер — состоящий из двух молекул. Структура органолитиевого димера выглядит попроще — вот так:

Рис. 2. Димер органолитиевого соединения (R — органическая группа)
Подсказка 2
Структуру кристаллов поваренной соли (NaCl), самого известного из соединений щелочных металлов с галогенами, определили сразу как только научились определять кристаллическую структуру чего-либо. Вот так выглядит кристаллик соли на атомном уровне — чередующиеся атомы натрия и хлора в трехмерном пространстве. Каждый отрицательный атом хлора связан с шестью положительными атомами натрия, каждый положительный атом натрия — с шестью отрицательными атомами хлора.
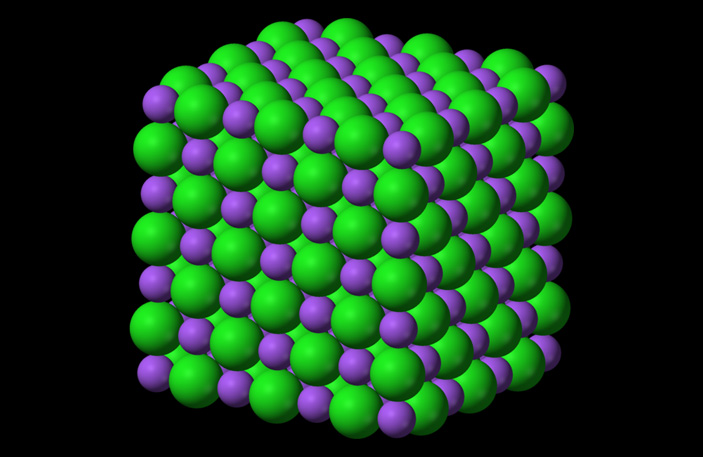
Рис. 3. Структура кристалла поваренной соли NaCl. Зеленые шарики — хлор, фиолетовые — натрий
Решение
Если изобразить тетрамер по-другому, нарисовав связи между атомом углерода и каждым атомом лития, картина становится уже не такой странной. Атомы лития друг от друга отталкиваются, но в агрегате они связаны с отрицательными атомами углерода, которые их удерживают в такой структуре. Это как магниты с разными полюсами: если два магнита притянутся противоположными полюсами, то и одинаковые полюса станут ближе друг к другу (рис. 4).

Рис. 4. Метиллитий можно сравнить с магнитом
Если рассмотреть гипотетический тетрамер поваренной соли, «вырвав» его из бесконечно чередующихся атомов натрия и хлора, то окажется, что он образует такой же куб, только без атомов водорода. То же получится (рис. 5), если приложить друг к другу два димера органолитиевого соединения, изображенных на рисунке 2.
Шесть связей углерода не нарушают законы валентности, так как связи углерода с атомами лития не ковалентные, а, скорее, ионные — существующие за счет притягивания положительного заряда к отрицательному.
Послесловие
Химия занимается превращением веществ, в том числе их синтезом. Органическая химия занимается синтезом органических веществ, или углеводородов (то есть органическим синтезом). Самой главной задачей органической химии был и остается синтез связи углерод-углерод. В природе связь углерод-углерод, как правило, получается в результате сложных биохимических процессов под контролем белков-ферментов. На заре химии ученые контролировать биохимические процессы не могли (да и сейчас могут далеко не всё) и поэтому искали другие методы синтеза. Например, связь углерод-углерод можно получить, добавив углерод с положительным зарядом к углероду с зарядом отрицательным.
Углеродные соединения с положительным зарядом получить несложно — это, например, соединения углеводородов с галогенами (фтор, хлор, бром, йод, ...). Самое известное такое соединение — хлороформ (CHCl3) — было получено еще в 1831 году независимо тремя химиками — американским врачом Самуэлем Гутри (Samuel Guthrie), затем немецким химиком и отцом-основателем органической химии Юстусом фон Либихом и французским ученым Эженом Субераном (Eugène Soubeiran). А определил химическую формулу хлороформа и дал ему название французский химик Жан-Батист Дюма в 1834 году.
Чтобы получить углерод с отрицательным зарядом (карбанион), достаточно приставить к нему атом металла, желательно щелочного (литий, натрий, калий, ...) — как наиболее стремящегося отдать электрон углероду. Но получить такие соединения оказалось гораздо сложнее, поскольку они мгновенно реагируют с кислородом и влагой из атмосферы. Соединения углеводородов с щелочными металлами научились делать через сто лет после хлороформа — в начале XX века, до этого обходясь другими, менее прямыми методами получения связи C–C.
Oрганолитиевые соединения впервые были получены в 1930-е годы немецкими химиками Карлом Циглером (лауреатом Нобелевской премии 1963 года за исследование полимеров) и Георгом Виттигом (удостоившемся в 1979 году Нобелевской премии за реакцию Виттига) и американским химиком, отцом металлоорганической химии Генри Гилманом (Henry Gilman, см. Gilman reagent). С реакциями органолитиевых соединений оказалось всё гораздо сложнее, чем можно было ожидать. Но несмотря на эти сложности, органолитиевые реагенты (см. Organolithium reagent) представляют сегодня огромную важность для химической промышленности и исследований и их в мире ежегодно синтезируют тоннами. Реакции, открытые Циглером, Виттигом и Гилманом, используются и по сей день в синтезе лекарств, удобрений и вообще почти любых органических соединений.
-
Интересно, атомы собираются в молекулу, словно детский конструктор!
То есть конструктор в микромире!
Спасибо, я не специалист в химии, но познакомился с интересом!!-
Самосборка
https://elementy.ru/novosti_nauki/432928/Samosborkoy_polucheny_struktury_iz_144_molekulyarnykh_komponentov
https://elementy.ru/novosti_nauki/431879/Poyavilsya_sposob_polucheniya_netsentrosimmetrichnykh_nanochastits
https://elementy.ru/novosti_nauki/432759/Polucheny_dvumernye_nanostruktury_s_kontroliruemymi_razmerom_i_svoystvami_pover khnosti
-
Последние задачи
















Рис. 1. Молекулярная структура тетрамера метиллития (CH3Li)4. Фиолетовые шарики — литий, черные — углерод, белые — водород. Метод РСА дает расположение атомов, а связи между ними дорисовывали вручную. Каждый атом углерода расположен на одинаковом расстоянии от трех атомов лития, и связь от него тянули к середине литиевого тетраэдра. Органическим химикам очень неуютно видеть углерод с количество связей больше четырех — ведь углерод четырехвалентен