Одни рецепторы к ацетилхолину помогают дрозофилам спать, другие — просыпаться
Действие нейромедиатора во многом зависит от того, с какими рецепторами каких клеток он связался. Это означает, что одно и то же сигнальное вещество в разных случаях может давать совершенно разные, даже противоположные эффекты. К примеру, ацетилхолин и у млекопитающих, и у насекомых способствует и сну, и пробуждению. Как выяснили китайские ученые в одном из недавних исследований, плодовым мушкам дрозофилам просыпаться от действия внешних стимулов помогают никотиновые ацетилхолиновые рецепторы, содержащие α3-субъединицы, а спать — рецепторы с субъединицами α2 и β2 в составе. Они расположены на разных нейронах (дофаминовых и октопаминовых соответственно), входящих в состав разных цепочек нервных связей.
«Активный отдых» нервной системы, сон, нашли едва ли не у всех организмов, которые такой системой обладают. Спят позвоночные и насекомые. Состояние, похожее на сон, наблюдается у нематод и даже у стрекающих, а конкретно у перевернутых медуз. В целом, есть ощущение, что сон — фундаментальное свойство нервной системы, то, без чего она не может нормально функционировать. Вот только нет пока сведений о том, спят ли гребневики, а получить их было бы очень интересно: их нервная система мало похожа на те, что есть у остальных животных, вдруг и сон ей не нужен?
Когда наступит сон, как долго он продлится и насколько глубоким будет, зависит от двух групп факторов: циркадных и гомеостатических. Под первыми имеются в виду внутренние ритмы организма, «часы», которые упорядочивают его деятельность, обеспечивают ему периодическую смену периодов высокой активности на периоды отдыха в течение дня. Они определяют время сна и пробуждения. Вторые отражают состояние клеток, тканей и органов животного. Некоторые отклонения состояния от нормы может исправить сон. Уставшему нужно отдохнуть, а недоспавшему — в следующий раз поспать подольше. Задумываться об этом специально животному не приходится, гомеостатическая регуляция все сделает за него. Она «выключит» организм, если он истощен, и определит подходящую длительность сна.
Циркадные ритмы в целом и механизмы циркадной регуляции сна в частности неплохо изучены, а про гомеостатическую регуляцию сна понятно меньше — но тем интереснее. Известно, например, что у таких эволюционно далеких животных, как домовая мышь и дрозофила, нейромедиатор (сигнальное вещество в нейронах) ацетилхолин стимулирует и сон, и пробуждение.
Как так получается? Это легко себе представить, если вспомнить, что в нервной системе не одна и не две клетки, а гораздо больше (даже в одном из самых лаконичных ее вариантов, у нематоды Caenorhabditis elegans, их три сотни). Одни клетки, к которым посылают ацетилхолин, воспринимают его одними белками-рецепторами, другие — другими.
Рецепторы разных типов неодинаково действуют на процессы, происходящие внутри своих клеток, а значит, и конечные эффекты различаются. В качестве аналогии можно представить себе комнату с двумя закрытыми дверьми: одна открывается наружу, другая — внутрь. Если толкнуть каждую из них от себя, то первая дверь останется на месте, а вторая откроется. Это, конечно, упрощенный пример, а в случае с нейромедиаторами и рецепторами к ним все обычно гораздо сложнее. Клетка может нести на поверхности несколько типов рецепторов, но нередки и группы нейронов с рецепторными наборами, которые пересекаются лишь частично или вообще не совпадают.
У мушек дрозофил известно 13 разновидностей рецепторов к ацетилхолину (холинорецепторов). Их делят на две группы по тому, какие вещества кроме ацетилхолина способны их активировать. Для одних холинорецепторов это составляющее табака никотин, и они называются никотиновыми или н-холинорецепторами. Для других — компонент мухомора мускарин, и они, как нетрудно догадаться, именуются мускариновыми или м-холинорецепторами. У позвоночных рецепторы к ацетилхолину тоже делятся на никотиновые и мускариновые.
Н- и м-холинорецепторы отличаются по строению (рис. 2). Первые представляют собой ионные каналы, молекулярные ворота, через которые в клетку (или из клетки, в зависимости от концентраций различных частиц внутри и снаружи нее) проходят ионы — заряженные частицы. В данном случае ворота открываются, если к рецептору присоединяется ацетилхолин. Вторые ничего через себя не пропускают, а сигнал о присоединении ацетилхолина передают так называемым G-белкам, расположенным с внутренней стороны мембраны, и уже они запускают цепочку реакций, которая приводит к открытию ионных каналов. В обоих случаях связывание нейромедиатора с рецептором меняет форму последнего, и именно это обстоятельство обеспечивает передачу сигнала.

Рис. 2. Схема обобщенных никотинового и мускаринового ацетилхолиновых рецепторов. α, β, γ — молекулы-субъединицы в составе G-белка. АцХ — сокращенное обозначение ацетилхолина (показан черными кружочками). Изображение из статьи E. Proulx et al., 2013. Nicotinic acetylcholine receptors in attention circuitry: the role of layer VI neurons of prefrontal cortex
М-холинорецептор — это единая молекула, у дрозофил встречается три их разновидности: A, B, C. Н-холинорецептор состоит из пяти субъединиц, названия которых складываются из буквы греческого алфавита и цифры. У плодовых мушек 10 вариантов таких субъединиц: α1 — α7, β1 — β3. Один н-холинорецептор может состоять из субъединиц одного вида, а может и из разных. Точно известно, что в один рецептор способны одновременно входить α1, α2 и β2. Почти наверняка холинорецепторы разного состава оказывают разное влияние на поведение дрозофил (других животных тоже, но сейчас речь в первую очередь об этих насекомых).
Чтобы выяснить, как различные субъединицы н-холинорецепторов и различные м-холинорецепторы влияют на количество сна, необходимое дрозофиле, и ее способность к пробуждению, сотрудники нескольких исследовательских институтов Пекина создали несколько линий дрозофил с нарушениями экспрессии генов м- или субъединиц н-холинорецепторов. Для этого они использовали систему генного редактирования CRISPR/Cas9.
У мух одной линии была нарушена экспрессия какого-то одного мускаринового холинорецептора или какой-то одной субъединицы никотинового холинорецептора. Насекомых, которые проходили метаморфоз, выходили из куколки и выживали после этого хотя бы 5–8 дней, сажали в прозрачные индивидуальные пробирки с кормом и в течение 3–5 дней снимали перемещения мух по этим пробиркам. По тому, двигается или не двигается ли дрозофила, определяли, спит ли она, и подсчитывали общее время сна за сутки. Сном считали отсутствие движений в течение пяти минут или дольше.
Чтобы определить потребность мух в гомеостатическом сне — дополнительном времени отдыха, нужном, если в предыдущие сутки не удалось поспать достаточно долго, пробирки с представителями различных линий (и, конечно, контрольную группу) ночью каждые две — пять минут вращали и трясли в течение 18 секунд с помощью автоматизированной установки. Затем считали, сколько минут каждое насекомое «недоспало» из-за вращения, и насколько длиннее обычного был его сон после.
Готовность к пробуждению из-за действия внешних стимулов тестировали, записывая реакцию спящих дрозофил на вибрацию три раза за ночь. Интенсивность стимула при этом колебалась от 1g до 3g (g — ускорение свободного падения).
Выяснилось, что насекомые, у которых подавлено образование α2- и β2-субъединиц н-холинорецептора, спят значительно меньше, чем дрозофилы дикого типа, у которых нормально синтезируются все субъединицы: три-четыре часа в сутки против восьми. Также статистически значимо меньше спали насекомые без α1-субъединиц и те, у кого была снижена экспрессия гена β1-субъединицы. Напротив, мухи с подавленным образованием α5-субъединиц спали даже больше, чем дрозофилы дикого типа.
В одной более ранней работе другого коллектива получалось, что дрозофилы, у которых кодирующий α4-субъединицу никотинового холинорецептора ген не функционировал нормально, спят меньше, чем насекомые дикого типа (см. M. Shi et al., 2014. Identification of Redeye, a new sleep-regulating protein whose expression is modulated by sleep amount). В новой работе это не подтвердилось. Вероятно, расхождение данных возникло потому, что мутации гена, кодирующего α4, в этих исследованиях не совпадают: в предыдущем это были точечные изменения, а в нынешнем — делеция 10296 пар оснований.
Мух без α3-субъединицы никотинового холинорецептора получалось разбудить вибрацией 1g только в 20% случаев, а дрозофил дикого типа — в 80% (рис. 3). Однако от вибрации 3g почти все мутанты начинали двигаться, а значит, восприятие подобных механических стимулов само по себе не было нарушено. Спали дрозофилы без α3-субъединиц практически столько же, сколько особи из контрольной группы, а значит, α3 не влияет на длительность сна, а влияет на пробуждение, притом не спонтанное самопроизвольное, а только вызванное внешними стимулами. Интересно, что насекомые с одной рабочей и одной «испорченной» копией соответствующего гена просыпались в ответ на вибрацию чаще, чем те, у кого α3-субъединицы не синтезировались, но все-таки реже, чем животные дикого типа.

Рис. 3. Вероятность пробуждения дрозофилы определенной линии в ответ на вибрацию 1g (A) и отношение времени, которое мухи конкретной линии в среднем проводят во сне, к общей среднем продолжительности сна дрозофилы дикого типа (B; отмечена пунктиром). wt — дикий тип. mRA, mRB, mRC — разновидности мускариновых холинорецепторов. Красными стрелками показаны линии мух, чьи реакции сильнее всего отличаются от реакций насекомых дикого типа. β1/+ — мухи, у которых одна копия гена, кодирующего β1-субъединицу н-холинорецептора, функционирует (если не работает ни одна, дрозофила погибает). Изображение из дополнительных материалов к обсуждаемой статье в Sleep
Кроме того, дрозофилы, которые не могли синтезировать α3-субъединицу никотинового ацетилхолинового рецептора, после лишения сна отдыхали не настолько долго, как те, у кого α3-субъединица вырабатывалась. Вероятно, этот белок играет какую-то роль в гомеостатической регуляции сна. У мутантов по генам, кодирующим α2- и β2-субъединицы, компенсирующий сон длился столько же, сколько у особей дикого типа.
Полная неспособность производить β1-субъединицу н-холинорецептора была несовместима с жизнью (то есть даже личинок с соответствующим неработающим геном не удавалось получить). Немногие мухи без α4-субъединицы доживали до взрослого состояния, но тем не менее у ученых получилось собрать достаточно данных по выжившим мухам с таким генотипом. Отсутствие какой-либо одной разновидности мускариновых рецепторов не влияло на продолжительность жизни насекомых, длительность их сна и готовность проснуться.
Укорочение сна или трудности пробуждения теоретически могли быть вызваны нарушением циркадных ритмов: допустим, «внутренние сутки» мутанта длятся на полчаса–час меньше или больше, чем у мухи дикого типа. Это предположение проверили отдельно: сначала три дня дрозофилы жили в режиме «12 часов свет / 12 часов темнота», а затем 9 дней их непрерывно держали в темноте и наблюдали за тем, когда они подвижны, а когда спят. Но оказалось, что с циркадными ритмами у насекомых линий «без α2», «без β2» и «без α3» все в порядке: циклы сна и бодрствования в темноте у мутантов сдвинулись не больше, чем у обычных мух.
Теперь стоило выяснить, где в нервной системе дрозофилы — в каких ее клетках — чаще всего встречаются белки, чье отсутствие сильнее всего сказалось на длительности сна и легкости пробуждения. Для этого мухам вставили ген зеленого флуоресцентного белка так, чтобы этот белок накапливался только в определенных частях нейронов, где присутствуют α2-, β2- или α3-субъединицы. Так удалось выявить, что α2-, β2-субъединицы никотинового ацетилхолинового рецептора широко представлены во всем «мозге» (головных ганглиях) дрозофилы. Но особенно много и α2, и β2 в антеннальной доле, подпищеводных ганглиях, а также в грибовидных телах и интерцеребральной части. Про последние две области уже было известно, что они регулируют сон насекомых. По-видимому, α2- и β2-субъединицы нередко синтезируются в одних и тех же клетках и совместно формируют там н-холинорецепторы (рис. 4). Оставалось понять, что это за клетки могут быть.

Рис. 4. Экспрессия генов α2 (изображения A, B, C), β2 (D, E, F) и одновременно обеих субъединиц (G, H, I) этих субъединиц никотиновых холинорецепторов в головных ганглиях дрозофилы, выявленная иммуногистохимическими методами. Цвета дают антитела к зеленому флуоресцентному белку (GFP) и к белку nc82, характерному для концов аксонов (длинных отростков, передающих сигналы другим клеткам) нейронов. По столбцам: вид спереди, вид сзади, брюшная нервная цепочка. Рисунок из обсуждаемой статьи в Sleep
Уже было известно, что с регуляцией сна у дрозофил связаны нейромедиаторы дофамин, серотонин и октопамин (последний, кстати, не играет роль сигнального вещества в нервной системе позвоночных). Поэтому исследователи «вернули» дрозофилам с нефункциональными генами α2-, β2- и α3-субъединиц функциональные последовательности соответствующих генов, но только в определенные нейроны. Такими нейронами были клетки с триптофангидроксилазой, необходимой для синтеза серотонина, и тирамин-бета-гидроксилазой, производящей октопамин. За сном мух, которые заново обрели возможность создавать недостающие субъединицы н-холинорецепторов, следили, как и в первой серии опытов.
Возвращение α2-, β2- или α3-субъединиц в производящие серотонин (серотонинергические) нейроны не оказывало эффекта на пробуждение и продолжительность сна. Однако введение генов, кодирующих α2 и β2, в октопаминергические клетки приводило к тому, что сон мух удлинялся до значений, характерных для насекомых дикого типа. Получается, что взаимодействие ацетилхолина с α2- или β2-субъединицами н-холинорецепторов (а чаще — с обеими сразу) в октопаминергических нейронах стимулирует сон.
В более ранней работе тех же исследователей получалось, что октопамин провоцирует бодрствование, и это хорошо согласуется с его ролью эдакого «норадреналина насекомых» (об этой его возбуждающей роли см. В. Е. Дьяконова, 2007. Поведенческие функции серотонина и октопамина: некоторые парадоксы сравнительной физиологии). Авторы оправдывают несостыковку новых результатов с предыдущими тем, что теперь они использовали более точную систему контроля движений насекомых. Вместо того чтобы считать с помощью инфракрасного луча перемещения мухи из одной половины пробирки в другую (рис. 1), они снимали на видео все движения дрозофил, в том числе те, что не выходили за пределы одной половины пробирки. Поэтому в прошлой работе они непреднамеренно «выкинули» часть движений, и получилось, будто у мутантов с нарушенной октопаминовой сигнализацией сон становится длиннее.
Возвращение гена α3-субъединицы в дофаминергические клетки восстанавливало чувствительность спящих мух к вибрации, но в других случаях оно не срабатывало. Отсюда исследователи сделали вывод, что ацетилхолин, связываясь с α3-субъединицами н-холинорецепторов дофаминергических нейронов, обеспечивает нормальную способность к пробуждению под действием внешних стимулов.
Дофаминергические и октопаминергические нейроны, в которых работают холинорецепторы с α2-, β2- и α3-субъединицами в составе, входят в разные сети связей. Это тоже способствует тому, что ацетилхолин в одних случаях помогает спать, а в других — проснуться.
Авторы не рассматривали отдельные фазы сна дрозофилы, хоть и упомянули об их существовании. Китайские исследователи не успели учесть новые данные, что мухи, по всей видимости, имеют аналог REM-сна (см. новость У дрозофил обнаружили состояние, похожее на парадоксальный сон млекопитающих, «Элементы», 08.01.2021; в ней он назван активным сном.) А это, вероятно, помогло бы выявить роль м-холинорецепторов в регуляции сна. Ведь у млекопитающих на продолжительность парадоксального сна (это то же самое, что REM-сон и фаза быстрого движения глаз) влияют мускариновые холинорецепторы, и нет никакого запрета на то, что у насекомых они действуют сходным образом.
Напомним, что сном китайские ученые считали периоды, когда муха была неподвижна больше пяти минут подряд. Такой же критерий применяли и в более ранних работах на эту тему. Но в исследовании, в котором показали вероятный аналог парадоксального сна у дрозофил (см. упомянутую в предыдущем абзаце новость), этой традиции следовать не стали и рассматривали как возможный сон и более короткие периоды бездействия насекомого. Именно это позволило выявить активный сон мух: он нередко длился меньше пяти минут. Поэтому вполне вероятно, что эффекты мускариновых ацетилхолиновых рецепторов проявятся, если смотреть не на сон в целом, а на каждую его фазу по отдельности, разбивая его на короткие отрезки. Для этого надо одновременно с поведением дрозофил регистрировать активность их нервных клеток: она покажет, где неподвижное бодрствование, где медленный сон, а где сон активный.
Источник: Xihuimin Dai, Enxing Zhou, Wei Yang, Renbo Mao, Wenxia Zhang, Yi Rao. Molecular resolution of a behavioral paradox: sleep and arousal are regulated by distinct acetylcholine receptors in different neuronal types in Drosophila // Sleep. 2021. DOI: 10.1093/sleep/zsab017.
Светлана Ястребова
-
Где то читал что в теории для нервной системы даже позвоночных достаточно было бы одного медиатора :)
-
Да, тоже видела такое. Возможно, дело в том, что это не нервные клетки начали выделять разное, а изначально нервная система сформировалась из разных групп клеток с разными "способностями к выделению". Про это неделю назад вышел занятный обзор https://royalsocietypublishing.org/doi/10.1098/rstb.2019.076
2, надеюсь про него хоть что-то написать.
-
Последние новости



















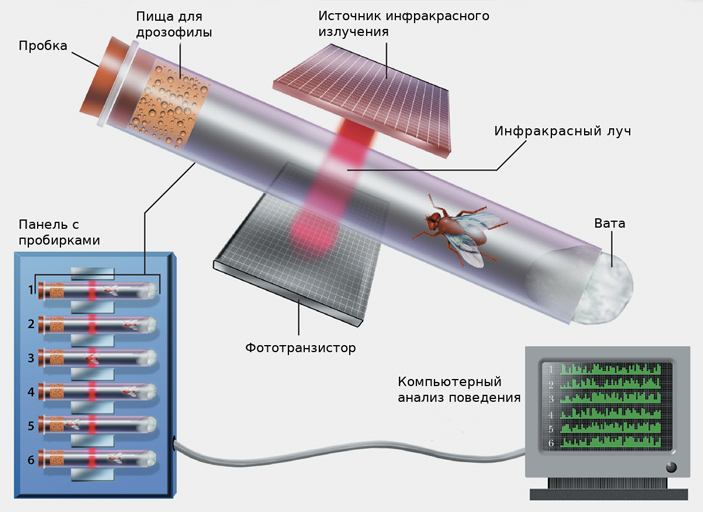
Рис. 1. Схема установки для изучения двигательной активности мух, нужного в том числе в исследованиях сна и бодрствования. Каждый раз, когда насекомое переползает из одной половины пробирки в другую, оно пересекает инфракрасный луч, и это регистрирует фототранзистор. Минус такого способа регистрации поведения в том, что если муха перемещается только в одной половине пробирки, фототранзистор «не увидит» этого, и движение не зачтется. Авторы обсуждаемой статьи отказались от использования инфракрасного луча (хотя раньше его применяли) и в новой работе записывали все перемещения дрозофил на видео. Изображение с сайта scientificamerican.com