Как вода связала азот
Роман Балабин,
кандидат технических наук, Восточно-Китайский технологический университет
«Химия и жизнь» №6, 2024
Превращать азот атмосферы в сложные соединения, да еще в нормальных условиях, умеют только азотфиксирующие бактерии. Человеку для этого нужны высокая температура и давление. Так было до окончания многолетней работы исследователей из России и КНР, которые научились с помощью обычной воды превращать атмосферный азот сразу в два биологически активных вещества: гидроксиламин NH2OH и нитроксил HNO. Это не чудо, а результат напряженного интеллектуального труда.
Электричество тянет воду
Исходно эта работа никакого отношения к получению азотных соединений не имела. Задача была иная — разобраться в 400-летней тайне мелких водяных капелек, которые возникают в результате приложения к крупной водяной капле электромагнитного поля. История этой тайны такова.
На границе XVI и XVII веков, в 1601 году, лейб-медиком королевы Елизаветы I стал Уильям Гильберт, который не только лечил людей, но и увлекался физикой, в частности электричеством и магнетизмом. За ним числится много славных дел. Так, он первым отделил собственно магнетизм от «эффекта янтаря» — способности натертой янтарной палочки притягивать разные пушинки, листочки и тому подобное. Он же ввел само понятие «электрический» и создал первый электроскоп. Проводя очередные опыты с действием заряженного янтаря на воду, он и заметил интересный эффект, который описал во втором томе своего шеститомного трактата «О магните» (De Magnete): водная капля при поднесении к ней заряженного янтарного стержня деформировалась и принимала форму конуса.
Более чем через век, в начале 1730-х годов, работу Гильберта продолжил другой англичанин, Стивен Грей. В истории науки он прославлен своими опытами по передаче электричества на расстояние как без проводов, так и по проводам; собственно, он был первым, кто открыл способность электричества распространяться по проводнику на большое расстояние. Ему принадлежит авторство опыта с «электрическим мальчиком»: во время демонстрации электрических чудес ребенка на шелковых изолирующих нитях подвешивали над полом, а к его ногам, не касаясь их, подносили заряженный стержень. Тело мальчика приобретало заряд, достаточный, чтобы притягивать к себе мелкие бумажки, а коснувшийся его носа мог получить ощутимый удар током.
Изучая действие электричества на воду, Грей заметил, что обнаруженный Гильбертом конус не прост: из его острия вылетают мельчайшие капельки воды.
Аббат Жан-Антуан Нолле, французский исследователь электричества, тесно общался со Стивеном Греем и интересовался его опытами. В частности, аббат любил демонстрировать эффектный трюк с электрическим мальчиком. Изучая же эмиссию воды под действием электричества, он обнаружил, что вода, вытекающая из сосуда, образует аэрозоль под действием электрического поля. Аббат опубликовал свои детальные изыскания в пятой части книги «Исследования частных причин электрических явлений» (Recherches sur les causes particulières des phénomènes électriques), увидевшей свет в 1749 году.
Переход к практике
Казалось бы, до реального использования этого явления, а именно до технологии электрораспыления различных растворов, оставалось полшага, но для него потребовалось два столетия: только в 1902 году в США выдали два патента на распыление жидкостей под действием электрического поля. Потом были и другие патенты, а в 1936 году немецкий изобретатель Антон Формхальс получил патент на электропрядение или, используя английскую кальку, электроспиннинг — процесс, в котором распыляемый электрическим полем раствор или расплав полимера вытягивается в тончайшие перепутанные нити, образуя нетканый материал. Несколько лет спустя, в 1941 году, именно электропрядением будущий академик И. В. Петрянов-Соколов станет изготавливать свой знаменитый материал — фильтр Петрянова (см. «Химию и жизнь», 2008, №11).
Впрочем, с теорией явления долго не удавалось разобраться. Лишь в 1964-м британский физик Джеффри Ингрем Тейлор, специализировавшийся в гидродинамике — а под старость, в возрасте 80 лет, заинтересовавшийся поведением капелек воды в грозовом облаке, — сумел рассчитать главный параметр электрораспыления. Он стал автором формулы для искривления мениска жидкости в капилляре под действием электрического поля, и появился термин «конус Тейлора». В зависимости от того, как искривляется мениск, и удается получать либо отдельные капли, либо цельные нити, то есть осуществлять либо электрораспыление, либо электропрядение.
Впрочем, электропрядением нетканых материалов дело не ограничилось. В частности, явление нашло широкое применение в масс-спектрометрии крупных биомолекул. В 1984 году Джон Фенн и Ямасита Масамити из Йельского университета и, независимо от них, группа советских спектрометристов во главе с Лидией Николаевной Галль, заведующей лабораторией Института аналитического приборостроения АН СССР, опубликовали статьи о новом методе приготовления образцов препаратов с такими биомолекулами. Суть метода как раз и состояла в распылении раствора биомолекул и их ионизации под действием сильного электрического поля. Сегодня этот метод известен во всем мире как электроспрей, и он столь важен, что в 2002 году Джон Фенн — совместно с японским инженером Коити Танакой — стал лауреатом Нобелевской премии по химии «за разработку методов идентификации и структурного анализа биологических макромолекул».
Радикалы в каплях
Вскоре электроспрей стали активно использовать в аналитической химии, в биохимии, для ионной имплантации и даже в космических ракетных двигателях, а электропрядение нетканых материалов разнообразного назначения сформировало важную отрасль промышленности. Тем не менее детали механизма формирования заряженных частиц на границе жидкость — газ по-прежнему остаются научной загадкой, и попытка разгадать ее порой приводит к удивительным сюрпризам. Именно такой сюрприз и ожидал нас в ходе изучения водного коронного разряда.
Путь к этому сюрпризу начался с того, что мы обнаружили важный факт: при определенных условиях основными носителями заряда в этом разряде служат катион-радикалы димера воды (их назвали КРАДВ) в форме (H2O)2+. Сообществу ученых было сложно принять, что эти крайне нестабильные частицы могут образовываться в значительном количестве даже при атмосферном давлении, и дискуссия заняла почти десятилетие. А важность этого открытия состоит в том, что КРАДВ имеют высокую реакционную способность по отношению к широкому спектру летучих молекул, и нам удалось хотя бы отчасти раскрыть богатый химический потенциал этих молекулярных систем. Но даже для нас совершенной неожиданностью стала способность КРАДВ взаимодействовать с молекулярным азотом, N2.
Азотфиксация, то есть превращение молекулярного азота в биологически доступные азотистые соединения, один из важнейших химических процессов, необходимых для поддержания жизни на Земле. Молекула N2 очень стабильна и потому химически инертна. Чтобы заставить ее реагировать с другими веществами, приходится либо прикладывать много энергии, либо использовать катализ, либо и то и другое. Увы, каталитическая система, способная разлагать молекулу азота без чрезмерных затрат энергии, есть только у азотфиксирующих бактерий.
Человек до сих пор не может разгадать и, соответственно, воспроизвести тайну их механизма азотфиксации; поэтому к его услугам только высокая температура, огромное давление и специальные катализаторы, воплощенные в процессе Габера — Боша. Ну а сами авторы процесса совершенно заслуженно получили Нобелевские премии соответственно в 1918 и 1931 году. Именно открытие процесса азотфиксации и его воплощение в виде промышленной технологии позволили резко поднять продуктивность сельского хозяйства, что легло в основу второй «зеленой революции» в истории человечества, если считать со времени неолита.
Мы же обнаружили, что реакция между N2 и КРАДВ протекает в мягких условиях: при комнатной температуре и вообще без участия катализаторов. Новый путь азотфиксации позволяет получать иные, но не менее ценные вещества: вместо аммиака (NH3), конечного продукта процесса Габера — Боша, в каплях активированной электрическим полем воды образуются гидроксиламин (NH2OH) и нитроксил (HNO). Таким образом, обнаруженная реакция представляет собой совершенно новый механизм фиксации азота с явным потенциалом для дальнейшего развития.
Азотный парадокс
Возникновение в капле воды гидроксиламина и нитроксила кажется настоящим чудом, ведь энергия продуктов значительно выше, чем энергия реагирующих частиц. Расчет дает, что изменение энергии Гиббса в результате реакции положительное и составляет неполные 4 эВ, то есть законы термодинамики ее попросту запрещают.
И тем не менее все экспериментальные доказательства, собранные с использованием различных аналитических методов, включая масс-спектрометрию, инфракрасную спектроскопию, ядерный магнитный резонанс (ЯМР) и оптическую спектроскопию, единогласно указывают на получение именно нитроксила и гидроксиламина. Мы оказались в ситуации отчасти схожей с той, в которой был Гильберт четыре столетия назад: наблюдали явление, не понимая его природу.
Объяснение механизма реакции заняло более трех лет. Как могла такая реакция произойти в столь мягких условиях, без катализатора, без горения N2 и со столь своеобразными продуктами? Мы заподозрили, что должно быть что-то уникальное во взаимодействии азота и КРАДВ. Как отметил Марсель Пруст в своей «Пленнице»: «Единственное подлинное путешествие... это не путешествие к новым пейзажам, а обладание другими глазами» (в переводе А. А. Франковского). И нам потребовались три больших осознания, прежде чем искомый ответ был найден.
Первое осознание случилось с нами в апреле 2022 года. Ход мысли был такой. Диспропорционирование, то есть разделение, молекулы азота с помощью КРАДВ термодинамически не допускается отнюдь не всегда; это требование справедливо, когда N2 находится в своем основном (синглетном) состоянии — то есть когда суммарный спин обоих азотов равен 0. Однако если перевести молекулу в триплетное состояние N2*, когда суммарный спин равен 1, то энергия молекулы возрастет и это облегчит реакцию. Лазерные физики многие десятилетия активно используют данный высокоэффективный переход для создания азотных лазеров. И что важно: возбужденное состояние N2* обладает исключительной стабильностью для электронно-возбужденной системы — азот остается в активной форме более одной секунды.

При этом активация N2 в N2* происходит за счет манипуляции с электронами, возможной при сильных столкновениях азота с ионами или электронами; а этот переход происходит гораздо быстрее, чем химическая перегруппировка атомов. Следовательно, переход N2 в N2* и последующая ассоциация азота с водой могут произойти в пределах единичного столкновения с катионом воды. Проще говоря, сталкиваясь с азотом, КРАДВ сначала быстро активирует его, а уже затем химически взаимодействует с возбужденной системой.
Тем не менее, хотя мы и получили теперь термодинамически возможный процесс, кинетический механизм реакции между N2* и КРАДВ все еще оставался неясным.
Нестандартная вода
Предыдущие исследования наряду с нашими собственными расчетами показывали, что абсолютный энергетический минимум для иона КРАДВ представляет собой конфигурацию с водородной связью вида [H3O+•••OH]. Однако, как мы ни старались, так и не удалось найти устойчивую промежуточную структуру для связывания N2* с [H3O+•••OH]. И здесь случилось второе осознание. Из ранних работ по химии воды было известно, что КРАДВ сосуществуют в двух различных конформациях. Помимо конфигурации с водородной связью [H3O+•••OH] существует также своеобразная двухцентровая трехэлектронная конфигурация вида [H2O•••OH2]+, также часто называемая «полусвязанной конфигурацией». Действительно, нам легко удалось обнаружить стабильную промежуточную структуру для связывания N2* с этой конформацией [H2O•••OH2]+. И за этим стоит довольно простая физика: объединение «полусвязанного» КРАДВа с азотом происходит за счет их совместной стабилизации положительного заряда, как видно по структуре INT1, показанной на рисунке 2: ее энергия оказывается ниже, чем суммарная энергия водяного димера и триплетной молекулы азота. Значит, этот переход не запрещен.
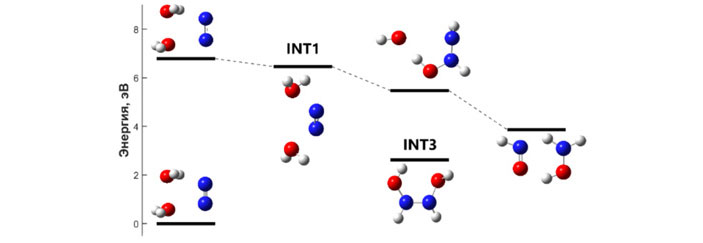
Окончательная схема реакции для нового метода фиксации азота водой
Парный танец протонов
После того как нам удалось найди промежуточный продукт реакции, остался последний вопрос. Как именно два протона переходят от водного фрагмента к азоту? И снова не удалось сразу найти путь реакции, по которому два протона последовательно передавались бы от воды к N2. Все попытки приводили к промежуточным продуктам с энергией заметно выше, чем у реагентов. Для этого нам понадобилось третье, и последнее, осознание: сама симметрия промежуточной структуры могла способствовать одновременному двойному переносу протонов в возбужденном состоянии. Можно сказать, что такой процесс идет практически без нарушения симметрии всей системы. Иными словами, механизм заключается не в двух последовательных передачах одного протона, как мы полагали изначально, а в передаче двух протонов одновременно.
Эта гипотеза подтвердилась последующими расчетами. Пока система продолжает находиться в возбужденном электронном состоянии, два протона могут быть без труда переданы от воды двум азотам с образованием INT3 (верхняя линия). Далее у молекулярной системы есть два пути: она может либо релаксировать в свое основное электронное состояние (INT3, нижняя линия), либо распасться «надвое» с образованием нитроксила и гидроксиламина. Оба пути наблюдаются экспериментально: масс-спектрометрия видит как конечные продукты, так и промежуточный аддукт INT3 вида HONH-HNOH+. В новой системе заряд — ранее локализованный на димере воды, а затем стабилизировавший INT1 — оказывается «размазанным» по всей молекуле INT3. Соотношение между данными путями во многом определяется временем. Как уже отмечалось выше, электронные процессы идут на несколько порядков быстрее атомарных. В результате появился согласованный механизм всего процесса (см. рис. 2).
Теперь, когда мы завершили проект и опубликовали статью в 2024 году в журнале «Nature Communications», мы смотрим на КРАДВ как на крайне удачное средство для фиксации N2. Сразу несколько факторов совершенно случайно сложились в единое целое: симметрия и относительная стабильность неклассической конфигурации [H2O•••OH2]+, уникальная стабильность азота в возбужденном триплетном состоянии и сама возможность одновременного двойного переноса протонов. Как только все эти факторы сошлись, стал возможен принципиально новый подход к фиксации N2 в мягких условиях, соответствующих принципам «зеленой химии». Этот новый подход позволяет полностью отказаться от использования природного газа, который служит источником водорода в процессе Габера — Боша и обеспечивает немалые выбросы углекислого газа в промышленности азотных удобрений (см. «Химию и жизнь», 2024, №5).
Сегодня на факультете фармацевтики Цзянсийского университета китайской медицины функционирует небольшой лабораторный химический реактор, где идет диспропорционирование азота водой новым плазменным методом. Реактор способен производить азотсодержащие вещества стоимостью в сотни долларов на каждый киловатт-час использованной электроэнергии. Выход продуктов на каждый квадратный сантиметр эффективной площади реактора составляет 1,1 мкг в час для гидроксиламина и 0,4 мкг в час для нитроксила.
В ближайших планах построить более крупный реактор, уже рассчитанный на фиксацию азота в полупромышленных масштабах. Кстати, все эти установки, от лабораторной до промышленной, не нуждаются ни в особом вакуумном оборудовании, ни в металлоемких реакторах высокого давления. Предварительные оценки показывают, что промышленное внедрение плазменной азотфиксации позволит многократно снизить энергоемкость всего процесса.
В статье также показано, что нитроксил можно использовать для прямого превращения серосодержащей аминокислоты, цистеина, в цистин. Кроме того, его можно применять для защиты клеток от агрессивного воздействия пероксидов. Гидроксиламин можно как превращать в аммиак, так и использовать напрямую: из него легко образуются аминокислоты и анилин.
Мы верим в практическое будущее нашего проекта примерно так же, как в свое время аббат Нолле верил в важность изучения свойств электричества. В предисловии ко второму изданию своей книги «Эссе об электрических телах» (Essai sur l'électricité des corps, 1765) аббат писал, что «в течение примерно тридцати лет электричество настолько ослепило нас своими необычными явлениями, что мы не можем наблюдать их без восхищения, а поклонники бредят знанием их причин: но насколько этот объект разжигает наше любопытство, кажется, что он также может и ускользнуть от наших детальных изысканий».
Следуя мудрости Нолле, мы продолжаем проводить систематические экспериментальные и теоретические исследования. Более того, наши текущие данные для схожих молекулярных систем показывают, что КРАДВ — благодаря своей уникальной структуре — может быть отличным реагентом для работы и с другими инертными молекулами.
Что еще почитать по теме
Xiaoping Zhang, Rui Su, Jingling Li, Liping Huang, Wenwen Yang, Konstantin Chingin, Roman Balabin, Jingjing Wang, Xinglei Zhang, Weifeng Zhu, Keke Huang, Shouhua Feng & Huanwen Chen. Efficient catalyst-free N2 fixation by water radical cations under ambient conditions, Nature Communications 15(1) 1535, 2024.
-
Шикарная работа, только возникло "головокружение от успехов", как говорил Классик Государственного Управления- авторы замахнулись на другие упорные молекулы. Тут просто повезло с симметрией орбиталей реагентов, активированного комплекса(переходного состояния) и продуктов реакции. Всё по Фукуи и Хоффманну.





















Первое осознание: первоначальный набросок механизма был нарисован на салфетке во время обеденного перерыва в апреле 2022 года