Дом для электронов
Валерия Сирота
«Квантик» №12, 2018

Так что же это за «ручки», которыми атом держится за другие атомы в молекуле? Коротко говоря — это некоторые из его электронов, а силы, удерживающие молекулу, — электрические. Чтобы разобраться подробнее, нужно понять, как живут электроны в атоме.
Знаете, как устроено осиное гнездо? Оно состоит из тонких сферических слоёв, вложенных один в другой, с большими воздушными промежутками между слоями. Вот примерно так же можно представлять себе атом. (Заметьте — «можно представлять» не значит, что он так выглядит! Слои у атома на самом деле не сферические, и они невидимы.) Слои — они называются уровнями энергии — это как бы этажи большого дома — атома. На каждом этаже — комнаты для электронов.
Все комнаты двухместные, но на разных этажах число комнат разное. Более того, не все комнаты на одном этаже одинаковы. Как в гостиницах бывает, что, например, номера с окнами, выходящими на море, считаются лучше тех, что с видом на город, — так и в атоме на одном и том же этаже есть разные «коридоры»: в одних комнаты «лучше», в других «хуже». А вот в каждом коридоре комнаты уже одинаковы. Коридоры обозначаются латинскими буквами: s — коротенькие коридорчики всего с одной, зато самой лучшей, комнатой; p — коридоры чуть похуже, по три комнаты в каждом; d — ещё похуже, в каждом по пять комнат, дальше f-коридор...
Замечательно, что у всех атомов — от водорода до унбинилия — этот дом устроен совершенно одинаково, вся разница в высоте этажей и количестве жильцов. Первый этаж совсем маленький: там только s-коридор с единственной комнатой (он называется 1s). Как в осином гнезде, каждый следующий уровень «выше» и больше предыдущего; поэтому на втором этаже уже два коридора, 2s и 2p, так что туда могут, в принципе, поместиться восемь жильцов. На третьем этаже — три коридора: 3s, 3p и 3d и т.д.

Теперь давайте заселять в наш дом жильцов, то есть электроны. Они вообще-то любят жить как можно ниже, при этом, естественно, если есть выбор, предпочитают лучшие комнаты. Поехали!
В атоме водорода единственный электрон, конечно, «селится» на первый уровень, в комнату 1s. В атоме гелия электрона два, и оба они поселяются в одной и той же комнате. То, что в коридоре 1s у гелия два жильца, обозначается так: 1s2. В атоме лития три электрона, и одному приходится поселиться на втором этаже: 1s22s1. А в атоме бора уже и коридор 2s весь занят, приходится селиться в p-коридор второго этажа: 1s22s22p1.
Во многих вариантах таблицы Менделеева (как и в том, что мы здесь приводим)1 есть «подсказки», в каких коридорах (по-научному — на каких подуровнях) сколько электронов живёт. Правда, места в клетках мало, и обычно указываются только внешние уровни — последний и иногда предпоследний этажи. И вот глядите, в первых трёх горизонтальных рядах таблицы, вплоть до аргона, «новые» электроны чинно-благородно «селятся» по порядку: сначала s-подуровень, потом p, потом переходим на следующий этаж...
А вот с калием и кальцием случается странное. Вместо того чтобы выбрать себе место в d-коридоре третьего этажа, электроны 19-го и 20-го элементов отправляются на четвёртый этаж! Видно, в d-коридоре комнаты настолько непривлекательны для электронов, что они предпочитают подняться на этаж повыше, но уж поселиться в s-комнате. Зато элементы с 21-го по 30-й «поселяют» свои новые электроны на 3d-подуровень, и третий этаж, наконец, заполняется полностью. (Заметьте, в таблице в этих клетках указано, что заселяется коридор d, а какого этажа — не написано, надо самим догадаться.)

Теперь мы знаем, почему клетки таблицы Менделеева раскрашены в разные цвета! Это тоже подсказка — в красных клетках последние электроны заполняют s-подуровень, в жёлтых — p-, а в синих — d-подуровень. Номер строки при этом совпадает с номером последнего занятого (хотя бы одним электроном) этажа.
Как же всё это связано с тем, как соединяются атомы в молекуле? А вот как: атомы стремятся, чтобы все их уровни-этажи были полностью заполнены. Или хотя бы подуровни-коридоры. Ради этой цели они готовы на многое: могут, например, отдать свой собственный электрон или взять себе чужой. Например, встречается атом лития с атомом фтора. Фтору страсть как хочется заполнить свой второй этаж, ведь ему не хватает всего одного электрончика. А у лития как раз этот электрончик один на своём этаже, можно сказать, лишний... Вот литий и готов отдать его фтору. Это и есть связь: ведь теперь литий, отдавший свой электрон, стал заряжен положительно, а фтор, присвоивший чужое, — отрицательно, и вот они теперь притягиваются друг к другу. Такая связь называется ионной (ион — помните? — это «неправильный» атом, который лишился одного или нескольких электронов или, наоборот, захватил себе один или несколько лишних).
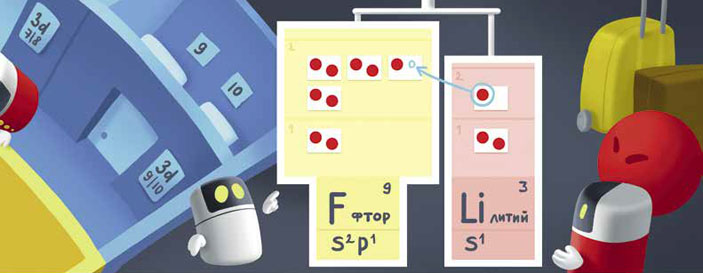
Но часто бывает удобнее не отдавать электроны, а делиться ими. Вот так это происходит. Встретились, скажем, два атома водорода. Обоим не хватает по одному электрону, но как решить, кто кому отдаёт? Атомы-то одинаковые! И вот они обобществляют свои электроны, то есть сближаются так, что каждый из этих двух электронов может считаться принадлежащим им обоим. Электроны немножко меняют своё движение и начинают «вращаться вокруг обоих ядер сразу». Опять образовалась связь — благодаря тому, что каждый отдал свой электрон «в общее пользование». Такая связь называется ковалентной.
А если встретятся два атома кислорода? Им не хватает по два электрона на внешнем уровне, и они обобществят каждый по два электрона — получится две «ручки»-связи. Так могут делать и неодинаковые атомы. Например, в молекуле соляной кислоты HCl водороду невыгодно отдать электрон и остаться совсем без ничего, поэтому они с хлором «делят» пару электронов, «объявляя» их общими. Остальные, внутренние свои электроны, хлор держит при себе.

И так всегда — поскольку все нижние слои заполнены и о них волноваться не приходится, химические свойства атомов определяются электронами на внешних, незаполненных уровнях. Поэтому атомы из одного вертикального столбца (то есть с одинаковым набором электронов на внешнем уровне) похожим образом ведут себя в химических реакциях, и число «ручек» у них обычно одинаковое.
Теперь вы уже и сами можете разобраться, почему у натрия и у хлора валентность 1, у кислорода — 2, а у углерода — 4. Или почему атомы инертных газов из восьмой колонки ни с кем не хотят «иметь дела».
Конечно, отнюдь не всё так просто объяснить или вывести, особенно когда в дело включаются d-электроны. У больших и тяжёлых атомов внешние этажи уже так далеко от ядра, что не всегда понятно, что такому атому удобнее — взять на этот уровень ещё пару электронов или отдать все те, что там уже есть... Иногда, чтобы предсказать, какими электронами и как именно атомы «согласятся поделиться» друг с другом, люди пишут специальные программы и долго считают на мощных компьютерах. А иногда и это не помогает, приходится все гипотезы проверять на опыте. Но всё-таки главные закономерности мы поняли.
Но и это ещё не всё. Продолжение истории — в следующем номере!
Художник Мария Усеинова
1 Читатель, возможно, заметил, что таблица Менделеева, приведённая в этом номере, отличается от той, которая была в № 11. Там она для компактности была укорочена, длинные строки были разбиты на две части.
-
 22.05.2020Ещё дальше в микромир: кваркиВалерия Сирота • Библиотека • «Квантик» №10, 2019
22.05.2020Ещё дальше в микромир: кваркиВалерия Сирота • Библиотека • «Квантик» №10, 2019
-
 30.04.2020Ядра атомов: вынужденное деление и термоядерный синтезВалерия Сирота • Библиотека • «Квантик» №9, 2019
30.04.2020Ядра атомов: вынужденное деление и термоядерный синтезВалерия Сирота • Библиотека • «Квантик» №9, 2019
-
 15.02.2020Внутри атомного ядра: сильное и слабоеВалерия Сирота • Библиотека • «Квантик» №8, 2019
15.02.2020Внутри атомного ядра: сильное и слабоеВалерия Сирота • Библиотека • «Квантик» №8, 2019
-
 28.09.2019КристаллыВалерия Сирота • Библиотека • «Квантик» №1, 2019
28.09.2019КристаллыВалерия Сирота • Библиотека • «Квантик» №1, 2019
-
 09.09.2019Дом для электроновВалерия Сирота • Библиотека • «Квантик» №12, 2018
09.09.2019Дом для электроновВалерия Сирота • Библиотека • «Квантик» №12, 2018
-
 31.08.2019Что у атома внутриВалерия Сирота • Библиотека • «Квантик» №11, 2018
31.08.2019Что у атома внутриВалерия Сирота • Библиотека • «Квантик» №11, 2018
-
 22.08.2019Самый маленький конструкторВалерия Сирота • Библиотека • «Квантик» №10, 2018
22.08.2019Самый маленький конструкторВалерия Сирота • Библиотека • «Квантик» №10, 2018













