Химический подсолнух
М. М. Левицкий,
кандидат химических наук
Д. С. Перекалин,
кандидат химических наук
«Химия и жизнь» №6, 2009
Цветная капуста — это обычная капуста,
получившая высшее образование.
Марк Твен
История химии знает примеры драматической судьбы некоторых соединений: яркое, эффектное появление, затем долгое прозябание, иногда про них даже забывают, и потом неожиданный расцвет. Речь пойдет о давно известном соединении — тиофене.
От заблуждения к открытию
Немецкий химик Адольф Байер, удостоенный в 1905 году Нобелевской премии, заложил основы химии красителей. Среди наиболее ярких его достижений — анализ строения природного индиго и синтез этого соединения. Есть и менее известные результаты, один из которых получил неожиданное продолжение. Изучая в 1879 году строение индиго, Байер получил продукт его окисления — изатин, который, как оказалось, обладал интересным свойством: при смешении с бензолом в присутствии серной кислоты изатин давал интенсивное синее окрашивание. Это соединение стали использовать как удобный реагент для качественного обнаружения бензола. К счастью, заблуждение продолжалось сравнительно недолго.
В 1882 году другой немецкий химик, Виктор Мейер, читая лекцию студентам, решил показать этот эффектный опыт, однако у него под руками не оказалось бензола. Не растерявшись, Мейер решил на глазах у студентов вначале получить бензол, а затем подтвердить его наличие с помощью качественной реакции. Бензол он получил, нагревая бензойную кислоту: C6H5COOH → C6H6 + CO2.
Добавив к свежеполученному бензолу серную кислоту и изатин, он с изумлением убедился, что смесь не посинела. Можно себе представить веселое оживление студентов, увидевших такой неудачный результат! Тем не менее Мейер сделал из этого наблюдения абсолютно правильный вывод. То, что он получил из бензойной кислоты абсолютно чистый бензол, сомнения не вызывало. Следовательно, бензол, которой обычно использовали химики для работы (его получали из каменноугольной смолы), содержит какую-то примесь, дающую окрашивание с изатином.
Мейер выделил из каменноугольного бензола это соединение и назвал его тиофеном. Название (корень «фен») оказалось на редкость удачным: оно указывало на родство с бензолом — имеется в виду фенильная группа. Тиофен — бесцветная жидкость с температурой кипения 84,2°C. В сыром бензоле, полученном из каменноугольной смолы, его совсем немного — 1,3–1,4%. Долгое время тиофен находился в тени своего выдающегося собрата бензола и вообще считался «загрязнителем», мешающим проводить спектральные исследования и молекулярно-массовые измерения. Но потом оказалось, что из тиофена можно синтезировать много полезных соединений.
Вслед за бензолом
Тиофен похож на бензол комплексом свойств, которые обобщенно называют ароматичностью. Этим свойством обладают плоские циклические молекулы. У атомов, участвующих в образовании цикла, взаимно перекрываются атомные р-орбитали и образуются обобщенные молекулярные кольцевые орбитали. В результате появляется единая замкнутая электронная оболочка, а система приобретает высокую стабильность. Количество электронов, обеспечивающих ароматичность, должно быть строго определенным. Немецкий химик Эрнст Хюккель вывел правило, согласно которому оно всегда равно х = 4n + 2, где n — число натурального ряда, то есть 1, 2 , 3 и т. д. Поэтому только плоские циклические молекулы, имеющие 6 (бензол), 10 (нафталин)... электронов, обладают ароматичностью.

Постепенно круг соединений, причисляемых к ароматическим, расширялся. К ним стали относить и молекулы, которые обладают структурными признаками, характерными для бензола, — то есть любые циклические структуры с чередующимися простыми и двойными связями, удовлетворяющие правилу Хюккеля.
В тех молекулах, где в состав цикла помимо углерода входят атомы О, S или N (например, в фуране, тиофене, пирроле — см. рис. 1), так же, как в бензоле, существует устойчивая шестиэлектронная замкнутая система. В ее образовании участвует неподеленная электронная пара, принадлежащая гетероатому (О, S, N). Четыре р-электрона предоставляют двойные связи цикла, а два р-электрона — атомы кислорода, серы или азота. При этом количество атомов в цикле (5 — у гетероциклов, 6 — у бензола) решающего значения не имеет.
Обобщенная электронная система дает интересные свойства: электроны создают кольцевой ток. Вполне естественно возникла идея синтезировать токопроводящие мостики из подобных молекул, соединенных в цепочку. Так были синтезированы проводящие полимеры, цепи которых собраны из циклических ароматических молекул (рис. 2). Чтобы все кольцевые токи в гетероциклах объединить в единый проводящий материал, вводят стимулирующие электроны и таким образом активируют всю систему.

Электропроводимость у некоторых этих полимеров почти такая же, как у металлической меди. Надо отметить, что химия всегда умела ломать сложившиеся представления: и в этот раз оказалось, что полимеры, долгое время считавшиеся эталонными диэлектриками, можно превратить в проводники.
В этой области политиофен сумел проявить свою индивидуальность. В сравнении с остальными проводящими полимерами он имеет ряд достоинств: стабилен, долго сохраняет проводящие свойства, кроме того, он растворим (в отличие от остальных), что позволяет формовать из него пленки и волокна. Из полимерного тиофена делают тонкопленочные электронные устройства, светодиоды, полупроводники, а также элементы для аккумуляторных и солнечных батарей. Надо упомянуть, что тиофен также входит в состав некоторых лекарственных препаратов, например антибиотиков — цефалотин, цефалоридин.
Однако «заслуги» тиофена пока нельзя назвать уникальными: сходных результатов можно достичь и с иными соединениями. Для того чтобы тиофен или какое-либо другое вещество стало заметным на фоне миллионов других, нужны яркие научные результаты. Часто они возникают только после того, как накопится экспериментальный массив при поисках в самых разных направлениях.
Подготовка взлетной полосы
Достаточно хорошо изученная химия тиофена позволила исследователям начать поиск необычных структур. Движущей силой здесь было стремление не только получить принципиально новые молекулярные конструкции, но и расширить диапазон электронных свойств таких молекул.
Ученые синтезировали много таких структур (рис. 3). Например, сверхразветвленный олиготиофен — дендример, содержащий 30 тиофеновых циклов (рис. 3а). Если его нанести на поверхность слюды или графита, он самоорганизуется и образует тонкие слои за счет межмолекулярных взаимодействий. Получен олигомерный тиофен (рис. 3б), цепям которого придана дополнительная жесткость за счет взаимодействий между фрагментами —O—CH2—CH2—O— и атомами серы (показаны пунктиром). В прямых цепях соседние р-орбитали легче перекрываются, что важно для проводимости, однако эффект будет заметен, только если синтезировать достаточно длинную цепь.
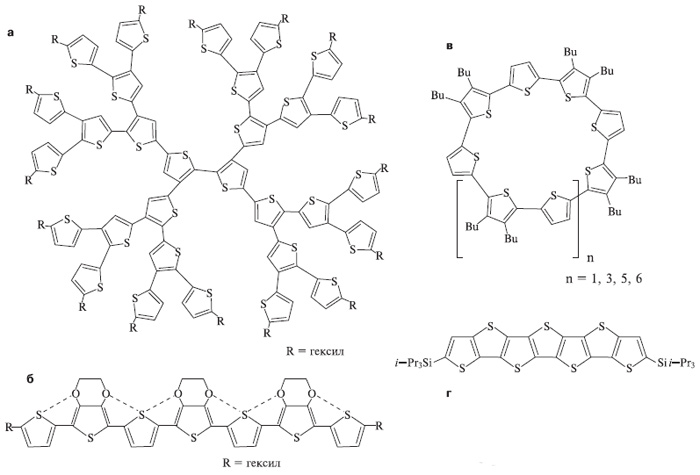
В соединениях, которые мы описали, тиофеновые циклы соединены между собой простой связью С—С. Но циклы тиофена могут быть и спаяны, то есть иметь два общих атома подобно тому, как соединены бензольные циклы в нафталине (слева) или антрацене. 
Такие циклы называют конденсированными. Химики-синтетики разработали методику для наращивания цепочки из тиофеновых циклов — в итоге получился фрагмент (рис. 3г) гипотетического полимера полидикарбосульфида, имеющего состав [C2S]n. Его считают многообещающим, предполагая, что это будет проводящий полимер со стабильными электрофизическими свойствами.
Атомы серы смотрят наружу
Современные возможности синтетической химии позволяют получить почти все, что нарисовано (при условии, что нарисовано грамотно). В макроциклах, напоминающих краун-эфиры, атомы серы расположены внутри циклов, в молекуле карбосульфида атомы серы направлены вверх и вниз относительно вытянутой цепи. Можно ли присоединить тиофеновые пятиугольники друг к другу так, чтобы атомы серы располагались снаружи? Простые геометрические соображения подсказывают, что тогда цепь должна замкнуться в кольцо.

К решению этой задачи приступил в 2004 году профессор С. Райка с коллегами из американского университета штата Небраска. Они взяли соединение, содержащее три тиофенильных фрагмента, расположенных нужным образом (рис. 4), с присоединенными атомами брома. Бутиллитий BuLi забрал по одному атому Br от каждой молекулы, затем действием литийсодержащего амида i-Pr2NLi в образовавшуюся молекулу ввели два атома Li, которые помогли сформировать новый тиофенильный фрагмент. Оставалось всего два атома Вr, казалось бы, вполне подходящие для того, чтобы полностью замкнуть цикл по той же методике, как с первыми двумя атомами брома. Однако собранная из семи тиофенильных фрагментов лента стала закручиваться в спираль, и в результате атомы брома далеко отошли друг от друга. Авторы продолжили достраивать намечающуюся спираль и получили две спиральные молекулы, закрученные в правую и левую стороны (рис. 5).
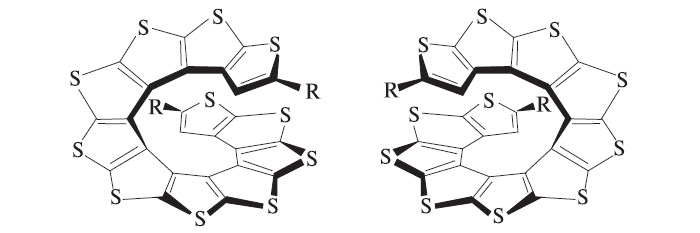

Спиральные молекулы называют гелиценами. Они особенно интересны, поскольку обладают исключительно высокой оптической активностью при вращении плоскости поляризованного света. Справедливости ради надо отметить, что даже здесь тиофену не удалось обойти бензол, который умеет делать то же самое, — впервые такие спирали были созданы из спаянных бензольных циклов (рис. 6). Впрочем, получение тиофеновых гелиценов — безусловно, серьезное достижение органической химии.
Однако задача (может быть, самая интересная) осталась нерешенной, ведь циклическую молекулу с атомами серы, смотрящими наружу, так и не получили!
Молекула-подсолнух
Химиков всегда привлекали соединения, которые возглавляли отдельное направление и символизировали целый класс себе подобных. Таких соединений немного, и они хорошо известны, например бензол, ферроцен, карборан, фуллерен (рис. 7). Они во многом определили развитие химии в XX веке. Отличительные признаки таких молекул: они стабильны, симметричны, сравнительно просто устроены, изящны и внешне привлекательны (поэтому часто становятся эмблемами конференций). Чисто эстетические аспекты, такие, как красота и элегантность молекулярных структур, всегда играли важную роль в развитии химии, и этому даже посвящены специальные статьи в серьезных научных журналах. По мнению нобелевского лауреата Р. Хофмана, эстетика — одна из движущих сил химии.

Впрочем, изящество структуры — не самое главное. Стабильную высокосимметричную молекулу несравненно проще изучать, и она дает существенно больше информации. Появление такой молекулы сразу привлекает внимание множества исследователей.

Отличительная черта работы современного химика — сочетание эксперимента и квантово-химических вычислений. Компьютерные программы позволяют химику-синтетику проводить многие расчеты самостоятельно. При решении задачи с тиофеном сначала надо было решить вопрос, из какого количества тиофеновых молекул собирать кольцо — ведь заранее ясно, что проще получить самое устойчивое соединение. А устойчива энергетически более выгодная структура. Исследователи провели предварительный расчет для циклов, содержащих от 5 до 12 тиофеновых фрагментов, и оказалось, что наиболее энергетически выгодны те циклы, в которых восемь и девять фрагментов (рис. 8). Обе эти молекулы практически плоские, в отличие от цикла из семи фрагментов, который стянут в виде корзины, и извитого десятифрагментного цикла (десяти тиофенам там тесновато).
Авторы начали с 8-звенного цикла. Была выбрана несколько иная тактика синтеза (в сравнении с той, которую использовали при сборке спиралей): вместо того чтобы собирать молекулу из нескольких блоков, они решили сразу использовать заготовку, содержащую восемь углеродных атомов (внутренний цикл), а затем достроить внешнюю часть, создавая в нужных местах тиофеновые фрагменты (рис. 9). Конечный продукт, эстетически совершенная структура органического соединения, брутто-формула которого поражает своей простотой — (C2S)8, оказался темно-красным порошком. Примечательно, что октатиофен очень устойчив (не разлагается вплоть до 500°С).
Поскольку форма молекулы напоминала цветок подсолнечника (англ. Sunflower), авторы назвали соединение «Sulflower» гибридом слова «sulfur» (сера) и «flower» (цветок). Итак, перед нами молекула-подсолнух, или сульфловер.

Осуществить синтез — половина работы, а вторая половина, не менее сложная, — доказать строение полученного соединения. Здесь сульфловер проявил коварство: он ни в чем не растворялся, что очень затруднило задачу. Впрочем, и для нерастворимых веществ существует набор методов, которые позволяют понять их строение. По результатам элементного анализа его состав соответствовал атомному отношению C:S = 2:1. Анализ масс-спектров дал молекулярную массу вещества — 448 (теоретическое значение 448,69). Спектр ЯМР показал, что в веществе присутствует два типа углеродных атомов в равном соотношении, а это полностью соответствует структуре сульфловера: восемь атомов С во внутреннем цикле и восемь на периферии. Казалось бы, структура подтверждена, однако современный уровень предполагает еще и рентгеноструктурный анализ, который буквально позволяет увидеть молекулу своими глазами. Но порошкообразное вещество для таких целей не годится, нужен небольшой одиночный кристаллик, который обычно выращивают из раствора. Как же быть, если сульфловер ни в чем не растворим?
Авторы все же опубликовали статью о синтезе сульфловера в авторитетном научном журнале без рентгеноструктурного анализа, и, как выяснилось позже, поступили правильно. Тем временем к исследованию сульфловера подключились ученые из ИНЭОС РАН (Л. А. Лейтес, К. А. Лысенко и С. С. Букалов). Они сублимировали сульфловер в высоком вакууме (10–5 мм рт. ст.) и получили нужные для рентгеноструктурного анализа одиночные кристаллы. Структура восьмилистного цветка полностью подтвердилась. Кроме того, рентгеноструктурный анализ показал, каким образом размещены молекулы в кристаллической ячейке и как распределена электронная плотность.
Две особенности сульфловера особенно заинтересовали авторов — его предельно низкая растворимость и красный цвет. Казалось бы, такие свойства имеют скорее прикладное, нежели научное значение, и все же внимание именно к ним было не случайным. Два этих свойства четко отличали сульфловер от похожих соединений: тиофеновые спирали, о которых мы уже рассказали, были бесцветны и хорошо растворимы. Окраска вещества, как правило, зависит от электронного строения молекулы, но теоретический расчет спектра поглощения в видимой области, проведенный для одиночной молекулы, показал, что она должна быть бесцветной...
Ответ на вопросы дало внимательное изучение расположения молекул сульфловера в кристалле. Плоские циклические молекулы образуют наклоненные колонны (рис. 10). Молекулы в колоннах сдвинуты вбок относительно друг друга таким образом, что расстояния C...S между атомами в молекулах, расположенных друг над другом, оказались короткими. При этом возникает сильное вандерваальсовское взаимодействие и соответственно резко снижается растворимость. Это же объясняет, почему вещество возгоняется при такой высокой температуре.

Также оказалось, что молекулы в соседних колоннах тесно контактируют друг с другом, причем это происходит при участии атомов серы и даже с частичным переносом заряда. Именно эти взаимодействия с переносом заряда приводят к тому, что поглощается определенная часть видимого света и вещество приобретает красный цвет. Таким образом, сама по себе молекула бесцветна, а окраска возникает только при образовании кристаллической структуры.
Ученые не просто пытались объяснить необычное сочетание свойств в веществе. Это помогло определить ту область, в которой сульфловер может проявить свои интересные качества — электрофизические и электрооптические свойства.
Мера ароматичности
Вполне естественно, что химик, глядя на плоскую циклическую структуру, собранную из ароматических молекул, задается вопросом, обладает ли она в целом ароматическими свойствами. Абсолютный эталон в этом плане бензол — он идеально воплощает все представления о таком классе соединений, поэтому постоянное сравнение с ним неизбежно. Это относится и к тиофену, исторически обнаруженному в складках плаща царственного бензола.

Ответ на вопрос об ароматичности, казалось бы, прост — надо проверить, отвечает ли структура правилу Хюккеля. Сложность состоит в том, что это правило можно применять не всегда. Если все атомы углерода находятся только в одном цикле или входят одновременно в состав двух циклов, как, например, в нафталине или антрацене, то правило применимо. Если же атом углерода входит в состав трех циклов, то правило не работает. Такое, например, происходит в коронене — цветке, собранном из шести молекул бензола (рис. 11). Один из шести атомов углерода, входящих одновременно в состав трех циклов, отмечен точкой.
Кроме того, правило Хюккеля только отвечает на вопрос «да — нет», иными словами, есть ароматичность или нет. Но когда ароматичность присутствует, она проявляется у разных соединений не в равной степени. Как ее определить? Сначала в качестве меры ароматичности использовали величину энергии, которая выделяется при гидрировании бензола (получается циклогексан), эту величину сравнивали с энергией, получаемой при гидрировании трех молекул этилена (три двойные связи) или разомкнутого аналога бензола — гексатриена H2C=CH—CH=CH—CH=CH2. Поскольку бензол стабилизирован за счет ароматичности, то выделяемая энергия ниже, чем у похожих неароматических соединений. Разница в величине сравниваемых энергий и есть мера ароматичности. Такой же результат получается при окислении бензола и сравниваемых соединений. Существует также метод, основанный на магнитных измерениях, при котором сравнивают величину кольцевого тока в ароматическом цикле. В последнее время исследователи чаще используют теоретические расчетные методы. Расчеты сульфловера показали, что каждый из тиофеновых циклов в молекуле ароматичен и имеет индекс –7,35 (для сравнения, индекс бензола –10,1). Интересно, что основное кольцо сульфловера, собранное из восьми тиофеновых циклов, не ароматично, также как и малый внутренний цикл. Здесь сульфловер проявил свою индивидуальность, поскольку ближайший предшественник коронен ароматичен полностью.

Эффектное и необычное соединение отметили многие химики, и сразу несколько групп исследователей начали изучать сульфловер. Прежде всего стал расширяться диапазон подобных молекул — синтезировали сульфловер, в котором часть атомов серы заменена селеном (рис. 12). Оба соединения — и сульфловер, и селеносульфловер — оказались полупроводниками. Кстати, коронен тоже упаковывается в колонны, но взаимодействия между ними такие слабые, что полупроводниковые свойства отсутствуют. Квантово-механические расчеты показали, что новые соединения — перспективное семейство материалов для молекулярной электроники. Есть и другая возможная область применения сульфловера, он может адсорбировать молекулы водорода. По расчетам, между плоскостями молекул сульфловера в кристалле может поместиться до пяти молекул H2. Безусловно, это будет интересно для развивающейся водородной энергетики.
Будущее сульфловера
Станет ли сульфловер символом нового направления, пока сказать нельзя, он еще очень молод, однако есть косвенные указания на то, что это возможно. При знакомстве с историей открытия других соединений, ставших символами, обращает на себя внимание одна деталь. Их строение было предугадано до того, как появилось надежное подтверждение объективными физическими методами. Речь идет прежде всего о рентгеноструктурном анализе. Август Кекуле предложил структуру бензола по крайней мере за 50 лет до того момента, когда его строение было подтверждено.
Необычную структуру ферроцена в виде сандвича из двух циклов с зажатым между ними атомом железа Роберт Вудворд предложил в 1952 году, имея весьма скромные сведения — результат ацилирования этого соединения, его магнитные свойства и исключительную стабильность. Рентгеноструктурный анализ подтвердил блестящую догадку через год. Относительно карборана также есть косвенные сведения, что его структура была предсказана. С фуллереном дело обстояло самым необычным образом. Гарольд Крото и Ричард Смолли знали о нем совсем немного — его молекулярную массу и то, что он состоит только из атомов углерода. Этого оказалось достаточным, чтобы предложить широко известный теперь шар из углерода, напоминающий футбольный мяч. Рентгеноструктурный анализ подтвердил их правоту лишь через шесть лет.

Вернемся к главному герою нашего рассказа, сульфловеру. Его автор В. Г. Ненайденко с коллегами имел заметно больше сведений о новом веществе, нежели Крото и Смолли о фуллерене. Тем не менее все доказательства были косвенными, а рентгеноструктурный анализ подтвердил истинность предположения через два года.
В каждом из этих случаев были свои особые обстоятельства, однако когда рассматриваешь их вместе, невольно приходишь к определенному выводу. Несмотря на то что физические методы исследования вещества постоянно совершенствуются, химики, как в прежние времена, так и сегодня, высоко ценят научную интуицию — миг, когда после напряженной работы и сосредоточенных раздумий перед глазами исследователя возникает новая структура, в истинности которой он уже не сомневается. Может быть, это одна из важнейших особенностей химической науки, объединяющая ученых многих поколений.












