Конец химии откладывается
Илья Абрамович Леенсон,
кандидат химических наук
«Химия и жизнь» №11, 2007
«Из семнадцати Нобелевских премий по химии за 1981–1997 годы семь были связаны с биохимией и молекулярной биологией. Это могли бы быть премии по физиологии и медицине», — писал пять лет назад О.В. Крылов в статье с провокационным названием «Конец химии?» (см. «Химию и жизнь», 2002, № 8). Сейчас к этим семи премиям «с биологическим уклоном» можно добавить еще четыре, а семь Нобелевских премий по химии были за это время присуждены работам, слабо связанным с химией. Они получены за разработку вычислительных методов (квантовая механика) либо приборов для изучения физических свойств (электронная микроскопия, спектроскопия ЯМР, фемтосекундная спектроскопия и другое).
И вот — подарок всем химикам: Нобелевская премия за 2007 год присуждена за исследования типичных химических реакций. Ее получил Герхард Эртль (Gerhard Ertl), работающий в берлинском Институте Фрица Габера Общества Макса Планка. В соответствии с официальной формулировкой Нобелевского комитета премия присуждена «за изучение химических процессов на твердых поверхностях».

Химия поверхности — далеко не новая отрасль науки. На эту тему опубликовано неисчислимое количество научных статей и монографий. Выходят периодические издания «Surface Science», «Applied Surface Science», «Surface Science Reports», «Progress in Surface Science», «Langmuir, Interface Science», «Advances in Colloid and Interface Science», «The Journal of Colloid and Interface Science», отечественный журнал «Поверхность. Рентгеновские, синхротронные и нейтронные исследования» и другие, проводятся Всероссийские и международные конференции. И это понятно: на поверхности раздела (чаще всего между твердым телом и газом) происходит масса самых разнообразных процессов. Прежде всего, с реакциями на поверхности неразрывно связан гетерогенный катализ — а это вся современная химическая промышленность, в том числе крупнейшая ее отрасль — синтез аммиака. Все большее распространение получают катализаторы дожига, без которых в большинстве стран с конвейера не сходит ни один автомобиль; эти катализаторы превращают вредные «СО/СН» и оксиды азота в безвредные СO2 и N2. Поверхностные явления стали ключевыми и в работе топливных элементов. В микроэлектронике основной процесс — это создание на поверхности тонких полупроводниковых слоев. Все методы защиты от коррозии связаны с поверхностными процессами. Реакции на поверхностях ледяных кристалликов в стратосферных облаках над Антарктикой во многом ответственны за разрушение озонового слоя (Нобелевская премия за 1995 год). Этот список можно продолжить. Отдельная область — химия привитых поверхностных соединений, которой посвящена изданная в 2003 году под редакцией Г. В. Лисичкина объемистая монография (М.: Физматлит, 2003). Очень интересны также проводящиеся на химическом факультете МГУ работы по получению свободных радикалов, привитых на поверхность в вакууме. В таком состоянии высокореакционные свободные радикалы «живут» долго, что позволяет исследовать их строение и химические свойства.
Разнообразие твердых поверхностей чрезвычайно велико: от идеально гладкой у скола монокристалла до чрезвычайно разветвленной, с множеством пор и каналов разной длины и диаметра — у активного угля или силикагеля. Но даже на самых гладких поверхностях всегда присутствуют неоднородности, дефекты решетки, адсорбированные частицы и поверхностные химические группы. Атомы на поверхности раздела могут взаимодействовать и с соседними поверхностными атомами, и с атомами внутри кристаллической решетки, и с любыми атомами, которые приближаются к поверхности из внешней среды. Отсюда ясно, что физика и химия поверхности исключительно сложны. Недаром еще в 1920 году физик Вольфганг Паули сказал: «The surface was invented by the devil» («поверхность придумал дьявол»), с чем согласятся все изучающие поверхность и физико-химические процессы на ней.
Химическая реакция на поверхности начинается с адсорбции — «прилипания» молекул к твердой частице. Молекула может быть связана с поверхностью лишь слабыми вандерваальсовыми силами. В этом случае она в основном сохраняет свою индивидуальность, а адсорбция этого типа называется физической. Если же между прилипшими молекулами и атомами на поверхности образуются ковалентные связи, имеет место химическая адсорбция — хемосорбция. При этом связи могут быть настолько прочными, что адсорбированная молекула диссоциирует. Понятно, что химические свойства адсорбированного вещества могут коренным образом измениться.
Основы термодинамики адсорбции и поверхностных явлений в целом были заложены еще в 70-е годы XIX века Дж. У. Гиббсом. При этом состояние поверхности изучали главным образом по изменению состава газа, который с этой поверхностью контактирует. Зависимость количества адсорбированного вещества от его давления в газовой фазе при данной температуре (изотерму адсорбции) выводили многие ученые, именами которых эти уравнения названы. Нобелевский комитет по химии тоже не впервые встретился с работами по исследованию поверхностных явлений. В 1912 году Нобелевскую премию по химии разделил с Виктором Гриньяром его соотечественник Поль Сабатье, в официальной формулировке — «за метод гидрирования органических соединений в присутствии тонко измельченных металлов, который обеспечил значительный прогресс органической химии за последние годы». Измельчение металлов значительно увеличивает их поверхность. Например, если сантиметровый кубик с поверхностью 6 см2 разрезать на множество мельчайших кубиков со стороной 0,1 мкм, то общая их поверхность увеличится до 60 м2. Последующие работы показали, что водород в опытах Сабатье адсорбировался на поверхности металла и диссоциировал на ней, образуя активные атомы водорода. Оказалось также, что в случае мелко раздробленных металлов дело не только в значительном увеличении поверхности, но и в особом состоянии атомов металла на ней.
В последующем за работы в области химии поверхностных явлений и катализа Нобелевские премии присуждались неоднократно. В 1909 году ее получил Вильгельм Оствальд, «в знак признания его работ по катализу»; в 1919 году — Фриц Габер, «за синтез аммиака из составляющих его элементов» (премия была присуждена за 1918 год), в 1932 году — Ирвинг Ленгмюр, «за открытия и исследования в области химии поверхностных явлений». С некоторой натяжкой к ним можно добавить премию за 1925 год, присужденную в 1926 году Рихарду Зигмонди «за установление гетерогенной природы коллоидных растворов». Так или иначе, премия за 2007 год была присуждена спустя ровно 75 лет со дня вручения последней премии в этой области химии.
Среди отмеченных достижений особенно выделяется, несмотря на скромную формулировку Нобелевского комитета, работа Габера. С 1903-го по 1919 год в поисках катализатора синтеза аммиака Габер испытал около 4000 различных веществ! Но эти исследования были беспрецедентны не только по научной значимости и затраченным усилиям; они имели важнейшие практические последствия и оказали исключительное влияние на мировую историю. Благодаря работам Габера к началу войны 1914 года завод БАСФ в Оппау близ Людвигсхафена (в 70 км к югу от Франкфурта) уже производил ежедневно по 20 тонн аммиака. Синтетический аммиак дал стране лекарства и красители, удобрения и, что особенно важно, — взрывчатые вещества (до этого необходимая для их производства селитра привозилась из Чили). В результате Германия получила возможность вести длительную войну, поскольку в 1914 году британский флот блокировал Германию и она лишилась чилийской селитры. А без пороха Германия не смогла бы продержаться и нескольких месяцев, так что, не будь работ Габера, она вообще вряд ли решилась вступить в войну! К 1918 году Германия производила по методу Габера — Боша уже более двух миллионов тонн связанного азота (сотрудник Габера Карл Бор получил Нобелевскую премию, совместно с Фридрихом Бергиусом, в 1931 году «за разработку и использование в химии методов высокого давления»).
После работ Ленгмюра в течение долгого времени не отмечалось особого прогресса в изучении химии поверхности. Работы носили в основном эмпирический характер, целью их было изучение изменений в составе газа, контактирующего с поверхностью. На основании этих данных делались более или менее обоснованные предположения о том, что происходит на самой поверхности. Здесь можно вспомнить теорию активных центров в катализе Э. Тейлора (20-е годы), теорию мультиплетов А. А. Баландина (1929–1930), теорию активных ансамблей Н. И. Кобозева (1939) и другие. Такое положение объяснялось прежде всего огромными трудностями в получении поверхности данного соединения с точно известными и воспроизводимыми свойствами, включая детальное строение в атомном масштабе. Ферми сказал: «Поверхности очень интересны, но ведь их так мало...» — считая, что действительно чистую поверхность получить почти невозможно. Но даже если бы это стало возможно, не существовало и приборов, позволявших контролировать состояние поверхности с необходимым нанометровым разрешением. И если бы такие методы появились, использовать их для изучения поверхности было бы сложно. Дело в том, что на воздухе (и даже при давлении в тысячи раз меньше атмосферного) любая поверхность, включая самые совершенные, немедленно покрывается слоем более или менее прочно адсорбированных на ней молекул, прежде всего — молекул воды.
Прорыв в химии поверхностных явлений произошел в последние десятилетия в технологии массового производства современных микросхем. Как писали специалисты в этой области, «по мере того как кремниевая пластинка — «чип», который служит основным элементом современных ЭВМ, становился все миниатюрнее, отношение его поверхности к объему быстро возрастало. Поэтому поверхность чипа, а не его объем, стала играть определяющую роль и при выполнении им логических функций, и при взаимодействии с другими элементами». И для создания чипов, и для изучения их «чистой» поверхности потребовалось развитие техники высокого и сверхвысокого вакуума. Одновременно начали появляться новые физические методы изучения поверхности. В их числе AES (Auger Electron Spectroscopy) — оже-электронная спектроскопия; FTIR (Fourier Transform Infrared Spectroscopy) — ИК-спектроскопия с фурье-преобразованием; HREELS (High Resolution Electron Energy Loss Spectroscopy) — спектроскопия потерь энергии электронов высокого разрешения; LEED (Low Energy Electron Diffraction) — дифракция электронов низкой энергии; РЕЕМ (PhotoEmission Electron Microscopy) — микроскопия с фотоэлектронной эмиссией; SIMS (Secondary Ion Mass Spectroscopy) — масс-спектроскопия вторичных ионов; UPS — УФ-фотоэлектронная спектроскопия (примечательно, что даже в специализированных англо-русских словарях по физике и химии, изданных сравнительно недавно, когда Эртль начинал свои исследования, ни один из названных методов не упоминается). Эти методы должны обладать особой чувствительностью, так как слой атомов или молекул на поверхности очень тонок, поэтому исследовать приходится очень малые количества вещества. Появление новых высокочувствительных и селективных методов привело к бурному развитию химии поверхности.

Лауреат этого года Герхард Эртль был одним из первых, кто понял потенциальные возможности новых методов исследования и в совершенстве овладел ими. Более того, он создал целую методологию их применения в каждом конкретном случае. Первые его работы в этой области были опубликованы в 1974 году на английском языке (в журналах «Surface Science» и «Journal of Chemical Physics»), что сразу привлекло к ним внимание во всем мире. Начал он с проблемы состояния водорода на поверхности металла — проблемы, давно волновавшей исследователей. Поскольку она тесно связана и с каталитическим гидрированием органических соединений, и с важнейшим технологическим процессом — синтезом аммиака, и с выделением или поглощением водорода на металлических электродах во многих электрохимических процессах, включая топливные элементы. Ученые подозревали, что водород на поверхности таких металлов, как платина или никель находится в высокоактивном атомном состоянии, но только Эртль сумел это доказать (рис. 1). Несмотря на большую энергию связи Н–Н, выигрыш в энергии в результате взаимодействия адсорбированных атомов Н с атомами металла на поверхности позволяет разорвать эту связь, причем реакция идет быстро.
Выяснив, как обстоит дело с водородом, Эртль приступил к давно известной проблеме механизма каталитической реакции синтеза аммиака: ![]() . Термодинамика этого процесса была исследована еще Вальтером Нернстом; сейчас это — «школьный» вопрос: в какую сторону сместится равновесие при изменении в ту или иную сторону температуры и давления? Практическое же решение проблемы, как отмечалось, осуществил Габер. В этой связи интересно отметить, что после многих безуспешных попыток Габер счел работу бесперспективной и прекратил ее. Однако в дело вмешался Нернст. Он сообщил, что результаты Габера не согласуются с его, Нернста, теоретическими расчетами и экспериментальными данными. Честолюбивый Габер был уязвлен. Он повторил измерения при высоких давлениях — и решил задачу.
. Термодинамика этого процесса была исследована еще Вальтером Нернстом; сейчас это — «школьный» вопрос: в какую сторону сместится равновесие при изменении в ту или иную сторону температуры и давления? Практическое же решение проблемы, как отмечалось, осуществил Габер. В этой связи интересно отметить, что после многих безуспешных попыток Габер счел работу бесперспективной и прекратил ее. Однако в дело вмешался Нернст. Он сообщил, что результаты Габера не согласуются с его, Нернста, теоретическими расчетами и экспериментальными данными. Честолюбивый Габер был уязвлен. Он повторил измерения при высоких давлениях — и решил задачу.
На основании многочисленных исследований кинетики этой реакции (по изменению давления в газовой фазе) были предложены разные ее механизмы, но ни один из них невозможно было доказать однозначно. В химической кинетике это обычное явление: несколько механизмов могут одинаково хорошо согласовываться с экспериментальными данными и для выбора требуются дополнительные данные. При этом никто не знал, что именно происходит на поверхности катализатора. Неизвестно было, атакуют ли атомы водорода адсорбированные молекулы азота, или с ними происходит то же, что и с молекулами Н2, — диссоциация на атомы. Ведь энергия связи N=N составляет 942 кДж/моль, это одна из наиболее прочных двухатомных молекул, которая более чем вдвое прочнее молекулы Н2.
Сначала Эртль изучил модельные системы, то есть чистые поверхности металлов, и доказал, что на чистой поверхности железа присутствуют изолированные атомы азота. Изучена была и кинетика процессов с участием азота. Оказалось, что энергия активации для реакции диссоциации N2 невелика и не сильно отличается для трех главных кристаллических плоскостей кристаллов железа (111), (110) и (100), так что реакция может идти на любой из них. Однако из-за очень малого предэкспоненциального множителя эта реакция идет крайне медленно. (Напомним читателям, что плоскость в кристаллической решетке обозначают координатами вектора, который перпендикулярен этой плоскости. Например, (100) — плоскость, перпендикулярная оси X декартовской системы координат. — Примеч. ред.)
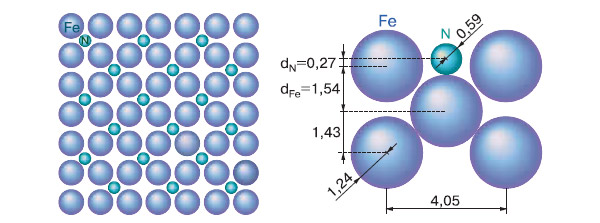
Можно ли на основании этих модельных процессов делать вывод о том, что происходит на поверхности катализатора в промышленном синтезе Габера—Боша? Катализатор этого важнейшего процесса — железо, промотированное К20 (его вводят в виде гидроксида калия) и другими оксидами. В 1979 году Эртль с сотрудниками начал изучать поверхность реального катализатора. Оказалось, что у вновь приготовленного катализатора она имеет очень сложную структуру. Но в ходе процесса при высоких давлениях восстановительная атмосфера видоизменяет эту поверхность, так что на ней доминируют лишь атомы железа и калия. И после удаления продукта реакции — аммиака, а также непрореагировавших исходных веществ на поверхности катализатора остаются только адсорбированные атомы азота.
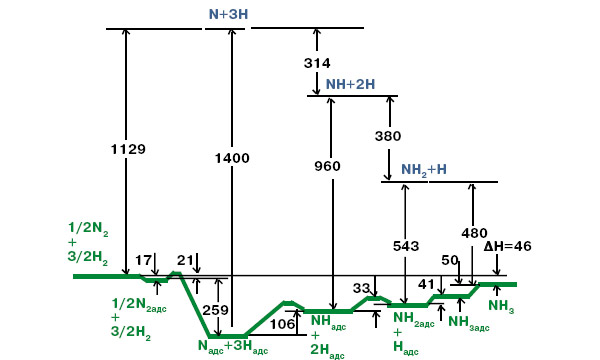
Эртль смог измерить также зависимость поверхностной концентрации этих атомов от давления водорода в газовой фазе. Оказалось, что чем больше введено водорода, тем меньше остается на поверхности атомарного азота. Таким образом, было доказано, что адсорбированные атомы водорода реагируют именно с атомарным, а не с молекулярным азотом, также адсорбированным на поверхности катализатора. А заодно подтвержден механизм, согласно которому адсорбированные на поверхности атомы азота, присоединяя поверхностные атомы водорода один за другим, образуют последовательно радикалы NH, NH2 и, наконец, молекулы NH3, которые десорбируются в газовую фазу. Причем все стадии, начиная с адсорбции исходных реагентов и кончая десорбцией аммиака, обратимы. Лимитирующая стадия для синтеза аммиака стадией — диссоциация молекулярного азота на атомы.
Так что же нового открыл здесь Эртль? Приведенный им механизм реакции водорода и азота на поверхности катализатора предлагался и ранее. Заслуга лауреата в том, что он фактически «увидел» все эти стадии, и теперь этот механизм из умозрительного превратился в твердо установленный. Более того, с помощью новых методов удалось измерить энергетику каждой элементарной стадии процесса, и это было весьма непросто. Ведь после медленной стадии N2 (адс.) = 2N (адс.) следующие реакции присоединения к атомам N атомов Н идут очень быстро. Чтобы их изучить, Эртль исследовал не только прямую, но и обратную реакцию — разложение аммиака на элементы (термодинамически этой реакции благоприятствуют низкие давления). Действительно, обратные реакции диссоциации гидридов водорода NH3, NH2 и NH идут на поверхности значительно медленнее, чем прямые, приводящие к аммиаку. Оказалось, что энергия связи молекулы NH3 с поверхностью невелика, поэтому в ходе промышленного процесса при температуре порядка 400°С образовавшиеся молекулы аммиака сравнительно легко десорбируются. Некоторые детали относительно скоростей образования и диссоциации промежуточных радикалов были выяснены путем замены водорода на дейтерий: промежуточный гидрид, например NH2, отщепивший атом водорода, затем быстроприсоединяет атом дейтерия с образованием NHD, и за этим можно следить.
Оставался невыясненным еще один вопрос: зачем в промышленный железный катализатор вводят промотор в виде ионов калия? Оказалось, что калий на поверхности облегчает адсорбцию молекул N2, увеличивая энергию этого процесса с 10 до 15 кДж/моль.
Итак, Эртлю удалось в деталях восстановить картину того, что происходит на поверхности катализатора при синтезе аммиака. Он идентифицировал все промежуточные частицы и доказал их участие в реакции, охарактеризовал структурные, энергетические и кинетические аспекты каждой элементарной стадии, используя самые современные методы. Теперь стало возможным связать воедино полученные многими исследователями в течение десятилетий кинетические данные для макроскопического процесса синтеза аммиака с кинетикой элементарных стадий. Нет нужды объяснять, насколько важны для практики подобные исследования. Следует отметить, что в последние годы Эртль вновь вернулся к изучению водорода на поверхности, применяя новейшие физические методы.
Эртль с сотрудниками, использовав свою методологию и накопленный опыт, изучил еще одну практически важную реакцию — окисление СO до СO2 на поверхности платины. Такой процесс происходит на катализаторах дожига (нейтрализаторах), превращающих угарный газ автомобильных выхлопов в углекислый. Эта же реакция идет в противогазных гопкалитовых патронах, очищающих воздух от смертоносного угарного газа. «Эта реакция проста, — писал в
Реакция окисления СО, в отличие от синтеза аммиака, необратима, и изучать ее намного труднее. В ходе исследований, проведенных в 1983–2004 годах, Эртль выяснил, чем вызвана нелинейная кинетика данной каталитической реакции. Измеряя работу выхода электронов с поверхности, можно было узнать степень заполнения поверхности адсорбированными молекулами. Метод FTIR дал информацию о взаимодействии между ними и поверхностью, а дифракция рентгеновских лучей — о состоянии самой поверхности. С помощью метода LEED можно было непосредственно наблюдать за структурными изменениями в ходе процесса, а методом РЕЕМ — за локальной работой выхода с высоким пространственным разрешением. Оказалось, что нелинейная динамика и колебания в системе связаны с периодической перестройкой (реконструкцией) самой поверхности. И вызываются эти перестройки адсорбированными молекулами реагентов. В результате колебаний скорости реакции возникают неоднородные пространственные эффекты на поверхности, когда на отдельных участках концентрация СО и O2 значительно выше, чем на соседних.
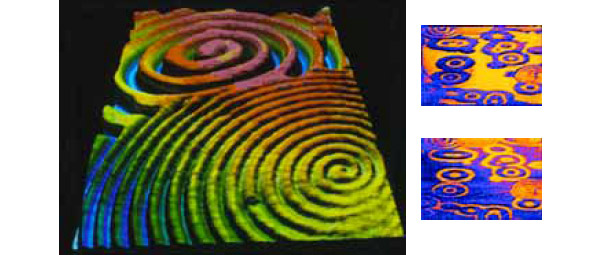
Следует отметить, что в катализаторах дожига применяются дорогие металлы платиновой группы, причем чувствительные к примесям серы в бензине. Поэтому ценны любые сведения о механизмах этого процесса, которые могли бы привести к увеличению активности катализаторов (и соответственно к снижению их массы) или к замене этих катализаторов более дешевыми.
Работы Эртля и его сотрудников оказали очень сильное влияние на всю обширную область современной химии — изучение явлений катализа. Более того, по мнению членов Нобелевского комитета профессоров Хокана Веннестрёма и Свена Лидина, работы Эртля задали стандарт для исследований в этой области. Более подробная информация (на английском языке), включая автобиографию лауреата и его лекцию на церемонии вручения премии, должна быть опубликована на сайте Королевской Шведской академии наук, а также nobelprize.org.













