Корона вируса
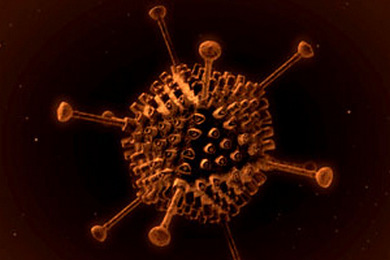
На этом рисунке американского ученого и художника Дэвида Гудселла (David S. Goodsell) изображен попавший в легкие коронавирус SARS-CoV-2 — точнее, одна его вирусная частица, или вирион. Она могла проникнуть в легкие со вдохом в составе аэрозоля, выделившегося в воздух при чихании или кашле зараженного человека, или же из верхних дыхательных путей, если вирус осел и размножился сначала там (при этом активно передаваясь другим людям).
Вирусную частицу окружили защитные белки межклеточного пространства легких — муцины (Mucins), интерфероны, иммуноглобулины и др. Их задача — не дать вирусу заразить новую клетку. Задача же вируса — загрузить в клетку свой геном (при этом вирион разрушается) и заставить ее собирать новые вирусные частицы. У SARS-CoV-2 носитель генома — одна длинная молекула РНК (изображенная как голубовато-белая лента). Она покрыта множеством копий белка N (на рисунке синий). Вместе они окружены липидной мембраной (белая), в которую в разных количествах встроены три белка — S, spike-белок (розовый), М (светло-оранжевый) и E (тоже розовый, так уж решил художник). Белка Е в вирионе меньше всего — сможете найти его на картинке? Если нет, вот ее подписанная версия (а если вы хотите раскрасить вирус иначе, на сайте Дэвида Гудселла можно скачать раскраску). Белки S, M, E и N называются «структурными», так как они формируют вирион. Они есть у всех коронавирусов (а у некоторых имеется еще и пятый структурный белок). В РНК вируса закодированы и другие белки, которые нужны будут для сборки вируса в клетке, но в вирион они не попадают — поэтому на рисунке их нет.
Самый заметный из белков коронавируса — S-белок (spike protein). Именно он отвечает за проникновение коронавируса в клетку. И именно благодаря шипам-пепломерам, образующим вокруг вирусной частицы ореол, под микроскопом напоминающий солнечную корону, коронавирусы получили свое название. (Впрочем, сам шип, образованный тремя S-белками, тоже похож на корону, только обычную, а не солечную. Но выяснилось это, конечно, позже.)
Диаметр вириона — 120–160 нм без учета шипов, длина шипа — 20 нм. SARS-CoV-2 почти на два порядка меньше клеток, которые он заражает.

Клетка (зеленая) в окружении вирионов SARS-CoV-2 (розовые). Многочисленные выросты клетки говорят о том, что она находится на конечной стадии апоптоза — программируемой клеточной смерти — и скоро будет фрагментирована. Заражение клетки вирусом — один из поводов для апоптоза. Раскрашенная фотография, полученная с помощью сканирующего электронного микроскопа, с сайта npr.org
Заражение клетки начинается с того, что вирус, с помощью шипов из S-белка, прикрепляется к «торчащим» из клеточной мембраны молекулам ангиотензинпревращающего фермента 2 (АПФ2, или ACE2 — от англ. Angiotensin-converting enzyme 2). Давно известно, что ACE2 экспрессируется в клетках легких, кровеносных сосудов, сердца, почек, кишечника (возможно, поэтому среди симптомов COVID-19 встречается понос). Но только в этом году выяснилось, что на поверхности клеток эпителия верхних дыхательных путей и глаз ACE2 тоже присутствует, хоть и в меньшем количестве. S-белок SARS-CoV-2 связывается с ACE2 в 10–20 раз прочнее, чем аналогичный белок его родственника и предшественника SARS-CoV, возбудителя атипичной пневмонии. Возможно, именно поэтому новый вирус может активно размножаться в верхних дыхательных путях, что делает его более заразным. Ведь, размножаясь в клетках на границе с внешней средой, вирус легче передается другим людям, чем когда он продуцируется в легких.

Эта пространственная модель шипа (вид сбоку и сверху) собрана на основе 3207 изображений, полученных методом криоэлекторонной микроскопии. Один из трех S-белков в составе шипа изображен цветными лентами. Участок, связывающийся с ACE2 (RBD, рецептор-связывающий домен), показан зеленым. Этот участок спонтанно «прячется» и «выставляется» на поверхности шипа, и у двух оставшихся молекул S-белка он как раз «спрятан» (RBD down). Изображение из статьи D. Wrapp et al., 2020. Cryo-EM structure of the 2019-nCoV spike in the prefusion conformation
Фермент ACE2 — важный компонент так называемой ангиотензин-рениновой гормональной системы. В норме он «ловит» и инактивирует пептидный гормон ангиотензин. В сосудах ACE2 способствует снижению кровяного давления, а в легких он успокаивает воспалительную реакцию, возникающую в ответ на повреждение тканей. Получается, что вирус не только эксплуатирует клетки, но и нарушает механизм защиты тканей. Возможно, это вносит свой вклад в тяжесть поражения легких у больных COVID-19.

SARS-CoV-2, связавшийся с ACE2 (голубой) на поверхности клетки. Трехмерная иллюстрация с сайта news-medical.net
Связывание вируса с ACE2 запускает в клетке процесс эндоцитоза: в месте контакта с вирусом клеточная мембрана вдавливается внутрь клетки, пока вокруг вируса не образуется пузырек. Внутри этого мембранного пузырька — эндосомы — вирус и попадает в клетку. Клетка использует эндоцитоз для поглощения крупных молекул, которые затем расщепляются и используются ею как сырье для синтеза нужных ей веществ. Поэтому в эндосомах есть свои «пищеварительные» ферменты — протеазы, которые разрезают белки, узнавая определенные последовательности аминокислот. На одной из внешних цепей S-белка как раз есть участок, который такие ферменты разрезают. Вирус только этого и ждет: под местом разреза обнажаются «пептиды слияния» (fusion peptides, см. Lipid bilayer fusion) — цепочки аминокислот, способные внедряться в мембрану эндосомы. Укороченный S-белок, одним концом связанный с мембраной вируса, а другим — с мембраной эндосомы, складывается, притягивая мембраны друг к другу. В результате мембрана вируса сливается с мембраной эндосомы, их целостность нарушается, и всё содержимое — включая геном вируса — выбрасывается наружу, в цитоплазму клетки.
С этого момента клетка уже заражена, а «троянский конь», доставивший в нее нитку вирусной РНК, — вирион с его короной из S-белков и тремя другими белками — сыграл свою роль и больше вирусу не нужен. Теперь уже сама клетка начнет делать то, ради чего вирус в нее внедрился, — производить копии его РНК и белков и собирать из них новые вирусные частицы. Но пока в клетке нет необходимого для этого аппарата: она умеет строить РНК на матрице ДНК (транскрипция) и белки на матрице РНК (трансляция), но не умеет «размножать» РНК. Следующий этап жизненного цикла вируса — сборка такого аппарата. Точнее, его самосборка из белков, которые клетка построит по вирусной РНК.
В самом начале этой РНК (на 5'-конце, см. 5'-end) находятся молекулярные структуры, характерные для матричных РНК клетки. Поэтому клеточные системы синтеза белков — рибосомы — принимают РНК вируса за свою и собирают на ее матрице длинную цепь аминокислот, прочитывая при этом примерно две трети вирусного генома. Эта длинная цепь — полипротеин ORF1ab — разрезается на 16 неструктурных (т. е. не образующих вирион) белков. Среди них есть и клеточные ножницы — протеазы; они еще в составе общей цепи правильно сворачиваются и начинают работать. Именно они и нарезают цепь на отдельные белки — получается, что полипротеин режет себя сам.

Подробный рассказ о белках, кодируемых вирусом SARS-CoV-2, см. в популярной статье из газеты New York Times Bad News Wrapped in Protein: Inside the Coronavirus Genome. На схеме из этой статьи видно, как гены неструктурных, структурных и вспомогательных белков расположены на РНК вируса от ее начала (слева) к концу
Благодаря тому, что предшественники SARS-CoV-2, очень похожие на него и также вызвавшие опасные эпидемии, активно изучались, мы уже довольно многое знаем о его неструктурных белках. Некоторые из них обманывают защитные механизмы клетки, другие блокируют сборку ее собственных белков. Но главное, из нескольких неструктурных белков собирается РНК-зависимая РНК-полимераза (РНК-репликаза) — белковый комплекс, способный синтезировать РНК по РНК (а не по ДНК, как это обычно происходит в клетке). Репликация РНК выполняется в два этапа, каждый из которых аналогичен транскрипции нитки ДНК в РНК. Сначала по принципу комплементарности на матрице геномной РНК синтезируется «антигеномная» РНК, которая уже служит матрицей для новых геномных РНК.
Вирусные РНК-полимеразы часто ошибаются и вставляют в РНК не те нуклеотиды — то есть вносят мутации. Это помогает РНК-содержащим вирусам быстро эволюционировать, однако из-за большой частоты мутаций они не могут позволить себе иметь длинный геном и много белков — всё время что-то будет ломаться. Поэтому средняя длина вирусных РНК-геномов — всего 9000 нуклеотидов. Но коронавирусы — исключение: длина их геномов достигает 30 000 нуклеотидов. Это связывают с тем, что у коронавирусов есть уникальный для РНК-вирусов белок, способный отрезать только что прикрепленный нуклеотид от синтезируемой цепи, если он не комплементарен матрице. Это помогает снизить процент ошибок при синтезе новых молекул РНК.

РНК-полимеразный комплекс коронавируса состоит из нескольких неструктурных белков (nsp, от англ. non-structural proteins). Nsp12 (собственно полимераза) — фермент, который осуществляет синтез РНК по матрице РНК. Nsp7 и nsp8 синтезируют для полимеразы «затравку» (primer), с которой начинается синтез новой цепи РНК. Nsp14 при содействии nsp10 контролирует, насколько аккуратно работает полимераза. Nsp9 держит матричную цепь в развернутом состоянии до прихода полимеразы. Схема из статьи E. C. Smith and M. R. Denison, 2013. Coronaviruses as DNA Wannabes: A New Model for the Regulation of RNA Virus Replication Fidelity
Как и все полимеразы, вирусная полимераза реплицирует РНК «задом-наперед»: не от начала (5'-конца), а с конца (от 3'-конца, см. 3'-end). Таким образом, репликация начинается как раз с той трети генома, по которой на первом этапе белки не собирались. В процессе синтеза «антигеномной» цепи РНК-полимераза проходит через специальные регуляторные последовательности нуклеотидов, расположенные между генами белков. От каждой из таких регуляторных последовательностей она с некоторой вероятностью может «перескочить» в самый конец своего пути по матрице, пропуская всё остальное. Если это происходит, образуются укороченные «антигеномные» матрицы, по которым затем собирается так называемая субгеномная мРНК. В ней есть 5'-конец со стандартным началом матричной РНК, затем все гены неструктурных белков (и некоторых структурных) пропущены, и сразу идут гены из конца вирусной РНК. Поскольку регуляторных последовательностей, способных вызвать перескок, в последней трети генома несколько, разных субгеномных РНК получается тоже несколько. Все они заканчиваются одинаково, и (если смотреть от конца) более короткие из них вложены в более длинные, а все вместе — в полную РНК. Вложены — по-английски nested (если переводить буквально, образуют гнездо); именно с этой особенностью связано название отряда, в который входят коронавирусы: нидовирусы (Nidovirales), от лат. nidus «гнездо».
Субгеномные РНК служат матрицей для производства четырех структурных белков (S, E, M и N) и еще нескольких вспомогательных, см. схему выше. Вспомогательные белки не входят в состав вириона. Некоторые из них взаимодействуют с иммунной системой организма или помогают готовым вирионам покинуть клетку, функции других пока не вполне ясны. Известно, что в лаборатории они не нужны вирусу для размножения, а в организме — просто необходимы.
С каждой субгеномной РНК транслируется только один или два белка, после чего трансляция останавливается (следующие белки транслируются уже со своих субгеномных РНК). Это позволяет вирусу четко регулировать количественное соотношение производимых белков: оно определяется вероятностями, с которыми РНК-полимераза перескакивает от их генов к началу генома.
Полные копии вирусной РНК запускают новые круги репликации вируса: с них считываются новые копии неструктурных белков, из которых опять собираются РНК-полимеразы. Они, в свою очередь, порождают новые копии вирусного генома и новые матричные субгеномные РНК, по которым рибосомы клетки синтезируют вирусные белки. Таким образом, в клетке накапливается всё необходимое для сборки новых вирусных частиц. Нам осталось понять, как они формируются и покидают клетку.

Жизненный цикл коронавируса SARS-CoV (у SARS-CoV-2 он такой же). Вирион проникает в клетку путем эндоцитоза; затем S-белок расщепляется, вследствие чего мембраны вируса и эндосомы сливаются и РНК выходит. Первые две трети генома транслируются в полипротеины (1ab или укороченный 1a). Они режутся (протеолиз) на неструктурные белки, из которых собирается вирусная РНК-полимераза (репликаза). С ее помощью формируются (транскрипция) копии РНК вируса и восемь видов субгеномной мРНК — шаблоны для генерации структурных и вспомогательных белков в просвете (ERGIC) между эндоплазматическим ретикулумом (ER) и аппаратом Гольджи. Вирионы собираются в цитоплазме и выходят из клетки путем экзоцитоза. Схема из статьи Компьютерные технологии против коронавируса: первые результаты (неадаптированная схема — в статье L. Du et al., 2009. The spike protein of SARS-CoV — a target for vaccine and therapeutic development)
Белки S, M и E — мембранные. Как и мембранные белки самой клетки, их синтезируют рибосомы, связанные с эндоплазматическим ретикулумом (ЭПР) — органеллой, представляющей собой совокупность мембранных полостей. С помощью специальных молекулярных комплексов белки внедряются в мембрану ЭПР прямо во время своего удлинения. Потом часть мембраны с новыми белками отпочковывается от ЭПР, получившийся транспортный пузырек отправляется к внешней клеточной мембране и впоследствии сливается с ней.
Вирусные белки, встроеные в мембрану пузырька, могут плавать по его поверхности и собираться вместе, так что из них складывается «мозаика». Молекулы белка М, связываясь друг с другом, образуют в стенке пузырька плотную решетку. Попутно, тоже связываясь с М, в решетку включаются копии белков E и S. Последние объединяются по трое и образуют шипы, смотрящие внутрь пузырька. Пока транспортный пузырек движется через клетку, с обращенными в цитоплазму участками белков М связываются многочисленные копии белка N, окружающие геномную РНК вируса. Все эти взаимодействия приводят к тому, что решетка смыкается вокруг вирусной РНК, и готовая вирусная частица — со свеженькой короной вокруг нее — оказывается внутри транспортного пузырька. А когда пузырек сливается с мембраной клетки, вирус оказывается снаружи.

Вирионы SARS-CoV-2 высвобождаются из одной из клеток лабораторной культуры. Электронная микрофотография с сайта modernhealthcare.com
Как видите, мы имеем дело с очень интересным вирусом. Несмотря на это, хочется всем пожелать не знакомиться с ним лично!
Рисунок © David S. Goodsell с сайта pdb101.rcsb.org.
Галина Клинк
-
Уже так много деталей известно об этом вирусе, а толку мало от этих знаний - реализуемый способ борьбы с эпидемией все равно единственный и топорный - закрыть всех дома - и больных, и здоровых. Совсем как тысячу лет назад, когда о микробах вообще ничего не знали. Очевидно, что вакцинация - это единственный прогресс, сделанный эпидемиологией с тех пор. С остальным всё глухо.
В данном случае аэрозоль не выделяется, а появляется (первый абзац).
Видимо я всё же дальтоник, так как на картинке не могу увидеть «голубовато-белую ленту, покрытую чем-то «синим». Вот разные тона сиреневого вижу. Это они имеются в виду? Наверное, цвет S и E белков тоже как-то должен отличаться, хотя по тексту оба «розовые». Спасибо, что прикрепили подписанный рисунок, а то без бутылки разобраться было бы невозможно 😉
Так S-белков три или один?
Очень интересная, подробная, хотя и очень затянутая заметка. Прямо коронавирусная онтология получилась. Теперь хоть можно понять, о чем в последнее время все говорят. Галина, большое спасибо!
-
Можно, но не нужно, т.к. свойства нового вируса придется всё равно изучать и испытывать на животных, потом на людях. И потом как-то объяснять публике, если вдруг окажется, что он опаснее оригинала или мутирует. Легче и безопаснее по старинке делать вакцину, чем играть во Франкенштейнов.
Есть предположение, что данный коронавирус именно так и родился. ;)
По крайней мере, рукотворные коронавирусные химеры уже были.
https://europepmc.org/article/pmc/pmc4797993
Есть предположение, что данный коронавирус именно так и родился. ;)Да и не одна... ))
По крайней мере, рукотворные коронавирусные химеры уже были.
https://europepmc.org/article/pmc/pmc4797993
Я просто оставлю это здесь: https://habr.com/ru/post/497956/
-
Вброшу свои пять копеек: г-н Кунин считает по другому и human sars-cov2 прекрасно встраивается в филогенетическое дерево коронавирусов.
https://www.biorxiv.org/content/10.1101/2020.04.05.026450v2
Странно, что автор своего опуса на хабре не упоминает данную работу.-
Спасибо и Вам за линк.
Но, как я поняла, в этом исследовании авторы искали сайты высокой патогенности у коронавирусов. Нашли (тот же фуриновый, как кажется) и пришли к выводу, что у них эти сайты появились независимо друг от друга. Что опять же не проливает свет на происхождение нынешнего вируса.-
Пожалуйста!
Да, основной фокус этой работы на поиске различий, определяющих патогенность в разных коронавирусах. Тем не менее, построенное филогенетическое дерево и встраивание sars-cov2 туда "как по маслу" добавляет очков за естественную эволюцию этого вируса и его естественное происхождение. К слову, по Кунину, упомянутый в материале с хабра по ссылке выше RaTG13 является сестринской ветвью для sars-cov2.
Еще в качестве контраргумента к материалу с хабра. Со слов же автора:Некоторые критики лабораторной гипотезы утверждают, что наблюдаемое ~ 4% генетическое различие между RaTG13 и CoV2 слишком велико, чтобы это могло произойти в лаборатории, если сам RaTG13 использовался в качестве основы. Наблюдаемые скорости мутаций для РНК-вирусов варьируются в широких пределах — от 10-6 до 10-4 нуклеотидов на репликацию in vitro, а у людей CoV2, по-видимому, мутирует со скоростью 25 мутаций в год. Таким образом, по логике критиков, потребовались бы годы, если не десятилетия, чтобы эти два штамма разошлись на 4%. Несмотря на то, что это резонное возражение, я вижу несколько проблем с ним.
Я прошел по ссылке на упомянутую статью 2004 года, клетки пассировались каждые три дня. Без оговорок, поссчитав в лоб: 600*3=1800 дней=5 лет. 5 лет - 2,1%; 10 лет - 4.2%. Вот и, описанные автором же, годы, если не десятилетия.
Во-первых, скорости мутаций in vitro намного выше чем in vivo, поскольку вы можете пассировать клетки гораздо чаще, чем заражать новых животных. Как показали эксперименты с SARS и MERS in vitro, существенные мутации могут наблюдаться уже после нескольких пассажей. Например, в статье 2004 года сообщалось, что после 600 пассажей уже наблюдалось 2,1% различий в геномных последовательностях шиповидный белков между исходным штаммом и его потомством:
Как источник ссылок пожалуй этот материал сгодится. Как аргумент со всеми приведенными сравнениями "на глаз"- посредственно.-
Построение филогенетического дерева вирусов основано на схожести их геномов. Правильно я понимаю?
В обсуждаемой статье, в частности, одно филогенетическое дерево авторы построили на сравнении сайта "preceding the first heptad repeat"шиповидного белка у всех используемых в работе коронавирусов, и другое дерево - на сравнении RBM сайта только у высокопатогенной выборки. Если предположить, что RaTG13 - это естественный штамм, а пресловутый sars-cov2 получен (лабораторно) на его основе, то филогенетически они таки и будут выглядеть как сестринские и располагаться рядом друг с другом на дереве, и sars-cov2 будет казаться родственным другим коронавирусам через своё генетическое сходство с RaTG13. Верно?
Если я ошибаюсь и упустила что-то из виду, поправьте меня.
-
-
-
Некий обобщенный ответ типа "у больных астмой, сердцем и т.д. ослаблен организм, вот их и поражает вирус" - кажется весьма поверхностным.
Коронавирус SARS-CoV-2
-
 27.12.2023Бедность и неравенство снижали устойчивость стран к пандемии коронавирусаМихаил Гопко • Новости науки
27.12.2023Бедность и неравенство снижали устойчивость стран к пандемии коронавирусаМихаил Гопко • Новости науки -
 26.05.2020Внутриклеточный театр боевых действийЮрий Гольцев • Библиотека • «Троицкий вариант» №8(302), 2020
26.05.2020Внутриклеточный театр боевых действийЮрий Гольцев • Библиотека • «Троицкий вариант» №8(302), 2020 -
 15.05.2020Корона вирусаГалина Клинк • Картинки дня
15.05.2020Корона вирусаГалина Клинк • Картинки дня -
 05.03.2020Коронавирус-2019: что это такое и как не заболетьАнна (Анча) Баранова • Видеотека
05.03.2020Коронавирус-2019: что это такое и как не заболетьАнна (Анча) Баранова • Видеотека






































Раскрашенная фотография SARS-CoV-2, полученная на просвечивающем электронном микроскопе. Хорошо видна корона из шипов (красная). Фото Национального института аллергии и инфекционных заболеваний (NIAID) с сайта flickr.com