Бактерия помогает амебе противостоять вирусам
Ученые из Австрии и Франции описали удивительный союз амебы и живущей внутри нее одноклеточной хламидии, благодаря которой амеба-хозяин становится защищенной от гигантских вирусов. Хотя молекулярные основы этого явления еще предстоит выяснить, эксперименты показали, что хламидия не дает гигантским вирусам разных видов размножаться в амебе-хозяине, хотя и не препятствует проникновению вирусов в клетку.
Гигантские вирусы — удивительная группа ДНК-содержащих вирусов эукариот, резко выделяющаяся среди прочих вирусов как по размерам вирионов, так и по длине геномов. Заражают они одноклеточных эукариот (протистов), в особенности, амеб. Многие гигантские вирусы беспощадны к своим хозяевам и вызывают быстрый лизис их клеток, благодаря чему наружу выходит множество новых вирионов, собранных внутри клеток-хозяев. Новые вирусные частицы заражают новых хозяев и все повторяется. Но не только вирусы могут портить жизнь протистам. Нередко внутри них поселяются бактерии, которые становятся самыми настоящими нахлебниками, отбирающими у своих хозяев АТФ и ценные метаболиты. Впрочем, роль таких приживальщиков иногда оказывается недооцененной...
Авторы исследования, опубликованного недавно в журнале PNAS, сообщили об открытии нового гигантского вируса, названного ими венавирус (Viennavirus) и отнесенного к семейству Marseilleviridae. Ученые выделили частицы нового вируса из сточных вод. Венавирус инфицирует амеб рода Acanthamoeba, в том числе, Acanthamoeba hatchettii (рис. 2). Интересно, что из того же образца воды, из которого был выделен венавирус, были изолированы клетки A. hatchettii, содержащие внутриклеточную бактерию-хламидию Parachlamydia acanthamoebae. Эта бактерия живет за счет хозяйской клетки и забирает у нее АТФ и промежуточные продукты метаболизма. Авторы исследования подтвердили, что наличие P. acanthamoebae отрицательно сказывается на жизненном тонусе амеб, в частности, они делятся существенно медленнее клеток без симбиотического «прицепа». Зачем же амебы продолжают содержать хламидию за свой счет, и почему они не выработали защиту от «квартирантов» в ходе эволюции?

Рис. 2. Вирусная фабрика (VF) венавируса в клетках амебы Acanthamoeba castellanii. Треугольником помечен созревающий вирион, полностью загруженный вирусной ДНК, стрелкой — загруженный наполовину. Изображение получено с помощью электронной микроскопии. Рисунок из обсуждаемой статьи в PNAS
Исследователи рассмотрели, как наличие в клетках амебы хламидии сказывается на течении инфекции, вызванной венавирусом. Сам по себе венавирус, как и другие гигантские вирусы из семейства Marseilleviridae, является остро-литическим: лизис амеб начинается уже спустя 12 часов после инфицирования, а к 55 часам после заражения от исходной популяции амеб ничего не остается.
А вот при наличии внутри амеб клеток бактерий P. acanthamoebae что-то в вирусном жизненном цикле идет не так: вирусные фабрики (особые участки цитоплазмы, в которых активно формируются новые вирионы) в зараженных амебах не образуются, новых вирусных частиц тоже не появляется. Чтобы подтвердить, что именно присутствие P. acanthamoebae дает амебам A. hatchettii возможность эффективно противостоять вирусу, ученые попробовали заразить хламидией клетки амебы другого вида, Acanthamoebae castellanii, а также другого штамма A. hatchettii (PRA-115), лишенного симбионтов, после чего подвергли их атаке венавирусом. Оказалось, что в отсутствие симбионтов и A. castellanii, и A. hatchettii PRA-115 эффективно лизировались венавирусом с образованием вирусного потомства. Но вот клетки, получившие заветную хламидию, оказались устойчивы к лизису. Таким образом, при наличии венавируса в среде P. acantamoeba вместо бесполезного нахлебника становится защитником, предотвращающим размножение вируса в бактериальных клетках.
Чтобы ответить на вопрос, каким именно образом хламидия защищает амеб от венавируса, нужно разобраться, какую стадию жизненного цикла вируса она блокирует. Для прояснения этого вопроса ученые инфицировали амеб либо одновременно вирусом и бактерией, либо сначала бактерией, а через некоторое время вирусом (рис. 3). Оказалось, что при одновременном заражении хламидией и венавирусом вирусные фабрики в амебах образовывались, их можно было детектировать в клетках через 12 и 24 часа после заражения. Тем не менее, репликация вируса в таких клетках шла на порядок менее интенсивно, чем в клетках без бактерии-симбионта. Авторы исследования заключили, что хламидия не мешает проникновению вируса в клетки, зато препятствует его репликации. Это предположение подтвердилось в эксперименте с другой схемой заражения. Выяснилось, что если заразить амеб сначала бактерией, а через 12 часов — еще и вирусом (именно к двенадцати часам после инфицирования бактерией «отношения» амебы-хозяина и хламидии становятся относительно стабильными), то вирусные фабрики также можно обнаружить через 12 часов после заражения венавирусом, а через 24 часа они уже не обнаруживаются. Авторы показали, что в этом случае вирусные фабрики все же формируются в клетках амеб, однако далее они не развиваются и постепенно исчезают, обрывая репликацию вируса.

Рис. 3. Визуализация поведения венавируса в клетках амеб. Слева — одновременное заражение вирусом и хламидией, справа — заражение хламидиями проводилось за 12 часов до введения венавируса. Вверху — клетки через 12 часов после инфицирования вирусом, внизу — через 24 часа. Клетки амеб окрашены пурпурным, ядро (N) и вирусные фабрики (VF) — желтым, бактерии — голубым. Видно, что через 24 часа в клетках, которые были сначала заражены бактерией, не остается активной вирусной фабрики, в отличие от клеток, которые были заражены и бактерией, и вирусом одновременно. Изображение получено при помощи флуоресцентная микроскопия. Рисунок из обсуждаемой статьи в PNAS
Удивительно, но защитный эффект P. acanthamoebae распространяется и на другие гигантские вирусы, в том числе и неродственные венавирусу! Аналогичные венавирусу результаты были получены и для амеб, инфицированных мимивирусом и тупанвирусом — гигантскими вирусами из другого семейства (Mimiviridae). Как и в случае с венавирусом, хламидия успешно сдерживала репликацию этих вирусов в клетках амеб (рис. 4). Таким образом, можно сказать, что бактерия P. acanthamoebae обеспечивает амеб-хозяев неспецифической защитой от эволюционно и структурно далеких гигантских вирусов.

Рис. 4. Внутриклеточная хламидия препятствует размножению в клетках амеб не только венавируса, но и двух других гигантских вирусов — мимивируса и тупанвируса. Вверху — клетки амеб без хламидии через 24 часа после инфицирования вирусом, внизу — клетки амеб с хламидией через 24 часа после инфицирования вирусом. Клетки амеб покрашены пурпурным, ядро (N) и вирусные фабрики (VF) — желтым, бактерии — голубым. Видно, что в амебах без бактерий формирование и функционирование вирусных фабрик не нарушено, а в амебах с бактериями они почти полностью разрушаются через сутки после заражения. Изображение получено при помощи флуоресцентная микроскопия. Рисунок из обсуждаемой статьи в PNAS
К сожалению, о механизмах защитного действия P. acanthamoebae пока нельзя сказать ничего определенного. Можно было бы предположить, что хламидия непосредственно контактирует с созревающей вирусной фабрикой или вирусными частицами, однако внутри амебы бактерия находится не сама по себе — она окружена мембраной, которую она получает при проникновении внутрь амебы. Гораздо более правдоподобным кажется вариант, при котором бактерия блокирует размножение вируса опосредованно, каким-то образом манипулируя сигнальными путями клетки-хозяина.
Источник: Patrick Arthofer, Vincent Delafont, Anouk Willemsen, Florian Panhölzl, and Matthias Horn. Defensive symbiosis against giant viruses in amoebae // PNAS. 2022. DOI: 10.1073/pnas.2205856119.
Елизавета Минина
-
Злой рок преследует амебу: чтоб не сдохнуть (от вируса) надо заболеть (хламидией заразиться)!
Как грицца, не обида, так оскорбление))
Интересно, есть ли иные в природе примеры, когда одна болезнь спасает от другой, более опасной?
Что-то вспоминается про глистов - они как будто, выравнивают работу человечьего иммунитета, снижают риск аллергий. Но это, кажется не совсем то же... хотя, быть может, что-то там в химии аналогичное?)-
Классический пример — серповидноклеточная анемия и малярия.
«У гетерозигот развивается анемия лишь в слабой форме, а зато в тех областях, где широко распространена малярия, особенно в Африке и Азии, носители аллеля серповидноклеточности невосприимчивы к этой болезни. Это объясняется тем, что ее возбудитель - малярийный плазмодий - не может жить в эритроцитах, содержащих аномальный гемоглобин» (Грин Н., Стаут У., Тейлор Д. 'Биология. В 3-х т. Т. 3' \\Пер. с англ./Под ред. Р. Сопера - Москва: Мир, 1990 - с.376 с, ил)-
-
Жить можно, но очень плохо. В детском возрасте отёки и боли в конечностях, в подростковом — в костях; задержка физического развития; постоянная слабость и головокружения; риск закупорки сосудов в любом месте тела, лёгочной и почечной недостаточности; повышенный риск осложнений при беременности и выкидышей… У гомозигот симптомы тяжелее, у гетерозигот легче. Но судя по распространённости этого аллеля в местностях, где ходит малярия, невосприимчивость любого носителя гена к малярии с лихвой покрывает хронические проблемы со здоровьем.
-
-
-
-
Сифилис лечили, заражая человека некоторыми штаммами малярии. Повышение температуры не давало ему развиваться.
-
Лечили... а вылечивали ли? )
И, мне кажется, если дело только в температуре - почему тогда именно малярия? Кажется, безопаснее можно иное что-то, температуру вызывающее... Или даже в баню париться сходить. По медицинским показаниям))-
Лечили не сам сифилис, а так называемый прогрессирующий паралич, являющийся одним из поздних осложнений сифилиса и постепенно превращающий человека сперва в сумасшедшего, а потом в овощ. В 1927 году за эту разработку дали Нобелевскую премию по медицине, потому что до открытия антибиотиков это был единственный действительно работающий способ борьбы с нейросифилисом, который был (в силу отсутствия лечения против самого сифилиса) весьма распространён.
-
На роль инфекций, препятствующих развитию онкологических процессов, медики обратили внимание довольно давно. Еще в Средние века описывались случаи «чудесного» исцеления от рака у заболевших тяжелыми гнойно-воспалительными заболеваниями, которые сопровождались лихорадкой. Хотя многим врачам приходила в голову мысль попробовать лечить опухоли с использованием болезнетворных бактерий, наибольший успех и признание в этом направлении, несомненно, принадлежит американскому хирургу В. Б. Коли (W. B. Coley; 1862–1936). Этот врач-исследователь длительное время с успехом лечил рак с помощью бактерий, спасая пациентов в тяжелейшем, часто безнадежном состоянии.
В 1891 г. Коли впервые добился полного излечения больного от рака, введя ему стрептококки в область опухоли (саркомы), а спустя год представил Американскому хирургическому обществу первые успешные результаты онколитической терапии сарком у значительной группы пациентов. До конца своей врачебной практики (в 20-х годах XX в.) Коли пролечил с использованием бактерий более 1,5 тыс. пациентов, достигая положительных результатов в 75% случаев, при этом спас 895 неоперабельных онкологических больных.
https://elementy.ru/nauchno-populyarnaya_biblioteka/434953/O_nas_i_nashikh_onkoliticheskikh_bakteriyakh
-
-
-
Там одна болезнь другую не лечила. Просто формируется перекрестный иммунитет. Человек не болеет оспой и полиомиелитом не потому, что в нем живут коровьи вирусы
-
Вопрос был такой:
Интересно, есть ли иные в природе примеры, когда одна болезнь спасает от другой, более опасной?
Вы написали:Там одна болезнь другую не лечила.
Совершенно верно:Оказалось, что при одновременном заражении хламидией и венавирусом вирусные фабрики в амебах образовывались, их можно было детектировать в клетках через 12 и 24 часа после заражения. Тем не менее, репликация вируса в таких клетках шла на порядок менее интенсивно, чем в клетках без бактерии-симбионта.
При одновременном заражении, хламидии только замедляют развитие вирусной инфекции, как и любое отравление. Для спасения клетки, заражение хламидиями производится заранее.
-
Интересно, есть ли иные в природе примеры, когда одна болезнь спасает от другой, более опасной?Да полно таких примеров! Такие явления как вирусная интерференция и колонизационная резистентность как раз на них и стоят.
Та же вакцина от бешенства на самом деле работает не через иммунитет, а через ту же самую интерференцию: живой вирус вакцины заражает нервные клетки и дикий уже не сможет в них зайти.
Колонизационная резистентность - это одна из главных причин, почему мы холим и лелеем свою нормальную (непатогенную) и даже условно-патогенную микробиоту (а в остальных биотопах кроме толстого кишечника - по сути главная и единственная).
Сами системы адаптивного иммунитета от бактериальных до животных имеют также вирусное происхождение.
Последние новости












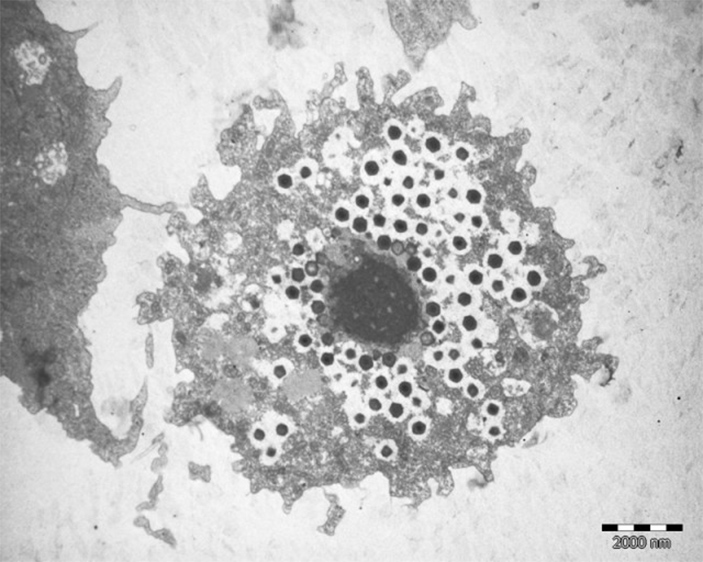
Рис. 1. Клетка амебы, заполненная частицами гигантского вируса. Изображение с сайта arstechnica.com