Стресс повышает сексуальную привлекательность гермафродитов C. elegans и их потомства
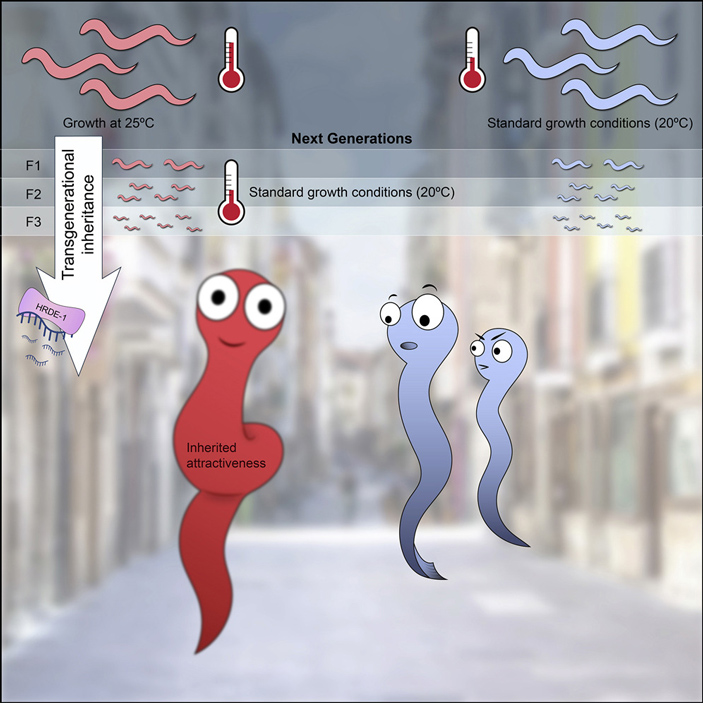
Нематоды Caenorhabditis elegans знамениты способностью использовать две альтернативных тактики размножения. Популяции этих червей состоят из самцов (X0), производящих только спермии, и особей-гермафродитов (XX), которые производят как яйцеклетки, так и спермии. Гермафродиты могут самооплодотворяться, но также могут быть оплодотворены и самцом. По мере старения гермафродитные особи перестают производить спермии, и одновременно начинают выделять феромоны, повышающие их привлекательность для самцов. В новом исследовании ученые показали, что если подвергать червей стрессу (держать их при повышенной температуре) в течение нескольких поколений, то время начала производства феромонов у гермафродитов сдвигается на более ранний срок. В итоге частота перекрестного оплодотворения заметно повышается. Регуляция описанных физиологических перестроек связана с работой малых РНК, которые подавляют работу генов, необходимых для сперматогенеза. Эти эффекты оказались наследуемыми в течение по крайней мере трех поколений червей, уже более не подвергавшихся воздействию стрессирующего фактора. Поскольку перекрестное оплодотворение является важным средством ускорения адаптации генофонда к новым условиям, описанное явление представляет интересный пример взаимовлияния механизмов эпигенетической регуляции и эволюционных процессов.
На «Элементах» уже не раз рассказывалось об исследованиях, проведенных на модельном виде круглых червей (нематод) Caenorhabditis elegans. На них изучают многие аспекты функционирования и физиологии организма: развитие тканей и органов в онтогенезе (Развитие червей начинается с хвоста, «Элементы», 23.11.2006), процессы старения (Быстрое старение у нематоды C. elegans поддерживается родственным отбором, «Элементы», 15.01.2019), физиологическую и генетическую адаптацию к разным условиям среды (Разнообразие пищевого поведения у нематоды Caenorhabditis elegans поддерживается балансирующим отбором, «Элементы», 09.11.2016; У нематод C. elegans связь успеха пищевого поведения с запахом сородичей зависит от прошлого опыта, «Элементы», 27.07.2021), формирование пола и размножение (Половое поведение и обучение у C. elegans регулируется пептидом, похожим на окситоцин, «Элементы», 31.10.2012; Чтобы превратить самок в гермафродитов, достаточно двух мутаций, «Элементы», 16.11.2009). Способность нематод использовать для размножения два альтернативных способа — самооплодотворение гермафродитными особями и оплодотворение гермафродитной особи самцом — позволяет исследовать вопросы выгоды и стоимости полноценного полового процесса с перекрестным оплодотворением, а также разбираться в том, какие регуляторные механизмы может производить эволюция для оптимизации стратегии размножения в тех или иных условиях.
Жизненный цикл нематод Caenorhabditis elegans
Жизнь червя, как любого многоклеточного животного, начинается с состояния зиготы — оплодотворенной яйцеклетки. Оплодотворение происходит в особом кармане взрослой гермафродитной особи — сперматеке. Одевшись в плотную оболочку, яйца выталкиваются из сперматеки во внешнюю среду, а внутри них развиваются эмбрионы (Embryos). Через 7–10 часов из яиц появляются личинки. Они проходят через четыре стадии (L1–L4), каждая из которых завершается линькой — личинка освобождается от кутикулы, из которой она уже выросла и формирует кутикулу заново.
Жизненный цикл C. elegans. Рисунок с сайта ncbi.nlm.nih.gov
На последней стадии (L4) в гонадах у червя — будущего самца или гермафродита — формируется полный комплект спермиев — мужских половых клеток (у червей это именно спермии, а не сперматозоиды, поскольку движутся они не при помощи жгутиков, а при помощи псевдоподий, наподобие амеб). Яйцеклетки же, которые присутствуют только у гермафродитов, продолжают постоянно формироваться на протяжении всей жизни особи уже в следующей, половозрелой (взрослой) стадии. Прохождение всех четырех личиночных стадий занимает около трех суток. Далее наступает взрослая стадия — с этого дня гермафродиты начинают откладывать яйца, а самцы могут оплодотворять гермафродитов.
Взрослые особи имеют длину чуть более 1 мм, причем самцы мельче гермафродитных особей. Пол нематод можно определить визуально по форме заднего конца тела: у гермафродитов он заостренный, а у самцов формирует что-то вроде хвостового плавника рыб. С генетической точки зрения самцы — это особи с одной X-хромосомой (кариотип Х0), а гермафродиты — с двумя (ХХ). Гермафродиты не оплодотворяют друг друга — они могут либо оплодотворить свои собственные яйца сами, либо быть оплодотворенными самцами. Самцы у С. elegans в обычных условиях — редкость: один самец встречается примерно на 200 гермафродитов, так что большинство червей родятся именно от самооплодотворения (само собой, от самооплодотворения появляются только гермафродиты).
Одна смена поколения у этих червячков занимает немногим более трех суток (что очень удобно в экспериментальной работе). Тем не менее, взрослые черви могут жить достаточно долго, в среднем около двух недель, но рекордсмены живут и по 30–40 дней. И все это время гермафродит остается способным производить новые яйца (до 10 штук в час). Однако весь запас спермиев для самооплодотворения заканчивается примерно за первые трое суток начала взрослой жизни, так что дальше все зависит от шанса на встречу с самцом.
На рисунке также показана дауэровская личинка (Dauer larva) — это покоящаяся стадия, в которую личинки могут перейти на длительное время (месяц и больше) при очень неблагоприятных условиях (недостаток питания и т. д.). В этом состоянии личинка не растет, не питается и не линяет до момента, пока что-нибудь не стимулирует ее к выходу из спящего состояния и продолжению жизненного цикла.
Исследование, опубликованное в свежем номере журнала Developmental Cell, было выполнено коллективом ученых из США и Израиля. Замысел эксперимента отталкивался от ранее полученных свидетельств того, что перекрестное оплодотворение — более эффективный способ размножения в сложных и переменчивых условиях среды для Caenorhabditis elegans. Это объясняется тем, что при перекрестном оплодотворении в потомстве формируется более высокое разнообразие генотипов, некоторые из которых оказываются более успешными в адаптации к стрессогенным условиям по сравнению с генотипами родительских особей (Опыты на червях доказали, что самцы — вещь полезная, «Элементы», 23.10.2009).
С учетом этого обстоятельства можно ожидать, что в ходе эволюции у C. elegans мог бы сформироваться какой-либо механизм для уменьшения частоты самооплодотворения и повышения частоты перекрестного оплодотворения. В статье 2014 года было описано интересное открытие, объясняющее особенности поведения самцов в отношении гермафродитных особей у этих нематод (D. H. W. Leighton et al., 2014. Communication between oocytes and somatic cells regulates volatile pheromone production in Caenorhabditis elegans). Было установлено, что соматические клетки гонад половозрелых гермафродитных особей способны выделять летучее вещество (пока неустановленной химической природы), действующее как хемоаттрактант (феромон) на самцов. Выделение феромона зависит от регуляторных сигналов, производимых яйцеклетками в ответ на их контакт со спермиями (не важно, собственными или другой особи-самца). Самооплодотворение начинает происходить уже с первого дня жизни гермафродитной особи, поэтому продукция феромона оказывается сразу же подавлена. Но на третий день запас собственной спермы гермафродита истощается, а значит самооплодотворение сходит на нет. В результате к 5–6 дню гонады гермафродитов начинают обильно выделять хемоаттрактанты, привлекая к оплодотворению самцов. Самцам же для восприятия этого феромона нужен специальный белковый рецептор srd-1, встроенный в мембрану нейронов.
Авторы обсуждаемого исследования выдвинули предположение, что подвергшиеся стрессу особи будут раньше начинать выделять хемоаттрактанты, повышая тем самым свою привлекательность для самцов и шанс на перекрестное оплодотворение. В качестве положительного контроля в экспериментах использовали мутантную линию червей, в которой гермафродиты в принципе не способны производить спермии. Поэтому они выделяют феромон в высокой концентрации и привлекают самцов с первого же дня достижения половозрелости.
В качестве стрессогенного стимула ученые попробовали использовать три варианта воздействий: культивирование червей при 25°C (эта температура не слишком критичная для червей, но все же она выше оптимальной), кратковременное (6 дней) голодание на ранней личиночной стадии (L1 — до первой линьки), либо продолжительное голодание (40–45 дней), стимулирующее формирование «спящей» (дауэровской) личинки (подробнее о том, что это такое, можно прочитать в новости Параллелизмы — результат быстрой эволюции сенсорных рецепторов, «Элементы», 20.09.2011).
По завершении личиночной стадии черви вступают в фазу половозрелости, то есть в ту стадию жизни, когда особь производит готовые к оплодотворению яйцеклетки и/или спермии. В первый же день достигших зрелости гермафродитов подвергали следующему испытанию. Некоторое количество таких особей помещали на несколько часов в небольшую капельку питательной среды. В этой капле должны были концентрироваться феромоны, которые служат средством привлечения самцов. Эту жидкость (кондиционную среду) собирали и использовали в эксперименте, схема которого показана на рис. 2, А. Самцы (несколько десятков особей) помещаются в центральную полосу (шириной 3 см) чашки Петри (диаметром 9 см). На крышечку чашки с нижней стороны почти у самого бортика наносится капелька кондиционной среды. На противоположном краю крышечки наносили капельку такой же среды, но чистой. На следующий день производили подсчет самцов с двух сторон от центральной полосы и на основании этих подсчетов вычисляли индекс хемотаксиса (отражающий силу привлечения самцов феромонами кондиционной среды).
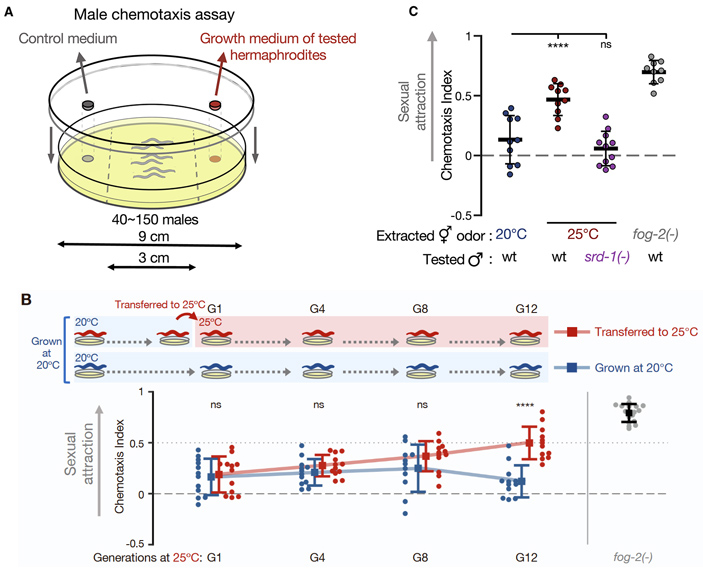
Рис. 2. Эксперименты по определению секреции феромонов гермафродитами и реакции самцов на эти вещества. А — схема эксперимента по оценке поведения самцов в ответ на присутствие феромонов от гермафродитов. В — результаты экспериментов по оценке привлечения самцов (Sexual attraction) феромонами кондиционной среды от червей, культивируемых при температуре 20 и 25°C. Оценочным критерием служит индекс хемотаксиса (chemotaxis index). Показаны значения для гермафродитов 1, 4, 8 и 12 поколений. Видно, что в ряду поколений различия накапливаются по нарастающей, становясь достоверными после 10 поколений культивирования в тех или иных условиях. C — значения индекса хемотаксиса после 10–15 поколений, выращенных в определенных условиях. Слева направо: у гермафродитов, выращиваемых при 20°C; у гермафродитов, выращиваемых при 25°C; у гермафродитов, выращиваемых при 25°C, но с использованием самцов с дефектом гена рецепторного белка Srd, посредством которого нормальные самцы «чуют» феромон; у гермафродитов с генетически обусловленным нарушением сперматогенеза (с дефектом гена fog-2). Рисунок из обсуждаемой статьи в Developmental Cell
Можно представить разочарование, испытанное экспериментаторами, увидевшими, что ни один из вариантов стрессогенного воздействия не заставил червей производить больше феромонов и как-либо изменить стиль поведения при размножении. Но ученые набрались терпения и продлили эксперимент. Прежде всего они попробовали поддерживать постоянно высокую температуру в течение роста червей. Когда их стали выращивать при таких условиях поколение за поколением, что-то действительно стало меняться: к двенадцатому поколению взрослые молодые особи стали гораздо эффективнее производить феромоны, привлекающие самцов (эти результаты отражены на рис. 2). Отметим, что самцы отвечают хемотаксисом лишь в том случае, если на их нейронах присутствует соответствующий рецепторный белок.
Часть червей, отобранных в последовательных поколениях, гомогенизировали и выделяли из них РНК, чтобы определить изменения в экспрессии генов. Но об этой части исследования подробнее будет рассказано чуть ниже.
Авторы провели и другой эксперимент по оценке привлекательности гермафродитов — испытание в соревновании за спаривание. Суть в следующем. На чашку Петри помещали 11 самцов и две конкурирующих группы «самок» (в каждой группе было по 7 особей). Чашку оставляли в покое ровно на час, а затем смотрели, сколько «самок» оказались оплодотворены в каждой из конкурирующих групп. Схему и результаты этого эксперимента можно видеть на рис. 3, А. Чтобы понимать, какие гермафродиты подверглись перекрестному оплодотворению, в этом эксперименте ученые использовали генно-модифицированных самцов, сперматозоиды которых светятся благодаря наработке в них зеленого флуоресцирующего белка. Каждая пара точек на графике, соединенных линией — результат одного отдельного конкурентного эксперимента. Видно, что в большинстве случаев гермафродиты линии червей, выращиваемой при повышенной температуре, значительно чаще оплодотворялись самцами, чем черви контрольной линии, выращиваемой при 20°C.

Рис. 3. Исследование сексуальной привлекательности у червей, подвергшихся температурному стрессу и у их потомков, которые стрессовым условиям не подвергались. А — эксперимент с конкуренцией самок за спаривание с самцами. На графике с результатами по вертикальной оси указана доля самок (в %), оплодотворенных самцами. В — исследование эпигенетического наследования индуцированных температурой изменений у червей. Производилась оценка индекса хемотаксиса, индуцируемого феромонами гермафродитных потомков шести поколений (F1-F6), полученных от стрессированной (красный цвет на схеме вверху и на графике с результатами внизу) или контрольной (синий цвет) линии червей, которых выращивали уже в одинаково комфортных условиях. Рисунок из обсуждаемой статьи в Developmental Cell
Ученые также имели основания предполагать, исходя из некоторых более ранних работ с C. elegans, что вызванные воздействием температуры изменения могут отразиться и на поведении потомства от подвергавшихся стрессу червей при устранении самого стрессирующего фактора . Для проверки этого ожидания опять-таки использовали описанный выше тест на продукцию летучего феромона и индукцию хемотаксиса у самцов. Схема и результаты этого эксперимента показаны на рис. 3, В. Очевидно, что потомки родителей из экспериментальной линии с температурным стрессом продолжали наследовать фенотип «молодых и привлекательных» от родителей. Степень проявления фенотипа все же постепенно убывает от первого к шестому поколению при выращивании в нормальных температурных условиях. Различия между потомками экспериментальной и контрольной линий оставались достоверными только на протяжении первых трех поколений.
Ранее уже было показано, что у нематод есть несколько механизмов эпигенетического наследования. Один из них связан с явлением РНК-интерференции и в нем главную роль играют малые РНК (small RNA), состоящие из не более чем 200 нуклеотидов (R. Posner et al., 2019. Neuronal Small RNAs Control Behavior Transgenerationally). Другой — с модификацией гистонов (Эпигенетическое наследование через гистоны хромосом сперматозоидов доказано экспериментально, «Элементы», 20.05.2019). Опираясь на некоторые более ранние исследования по изучению воздействия температуры на экспрессию генов у C. elegans, авторы обсуждаемой работы предположили, что в данном случае задействован именно первый механизм. Так что на следующем этапе они занялись проверкой этого предположения. Кстати, само явление и молекулярный механизм РНК-интерференции, за изучение которых в 2006 году была вручена Нобелевская премия по физиологии и медицине, были расшифрованы в экспериментах на все тех же червячках C. elegans.
Чтобы убедиться, что механизм наследования стресс-индуцированной привлекательности связан с наследованием РНК, авторы использовали экспериментальную линию, в которой этот механизм можно искусственно блокировать. В прошлых исследованиях был установлен белок, необходимый для передачи малых РНК от родителей к потомкам через половые клетки, — это белок HRDE-1 из семейства Argonaute. Он участвует во взаимодействии малых РНК с новосинтезированными матричными РНК, причем местом его дислокации является клеточное ядро. Если сделать ген белка HRDE-1 полностью нефункциональным (нокаутировать), черви становятся совершенно стерильными (не могут производить потомство). Но если блокировать его работу лишь на время, то фертильность особей не нарушается, а вот передача признаков, наследуемых посредством малых РНК, прекращается. Для такого временного блокирования использовали систему ауксин-индуцируемой деградации белка (A. J. Holland et al., 2012. Inducible, reversible system for the rapid and complete degradation of proteins in mammalian cells). У специально полученной линии червей геном был преобразован таким образом, что при добавлении на чашку раствора ауксина (это природный гормон растений) — в течение одного часа все молекулы белка HRDE-1 подвергаются убиквитинированию и деградации посредством протеасом. Эта система позволяет очень быстро, контролируемо и обратимо блокировать функционирование изучаемого белка в клетках.
В этой серии экспериментов выращивали 10–15 поколений нематод при 25°C, формируя фенотип «молодых и привлекательных», затем потомство первого поколения от них получали уже при 20°C, кратковременно добавляя ауксин. В итоге родительский фенотип в потомстве следующих трех поколений уже не воспроизводился. Это видно на рис. 4.
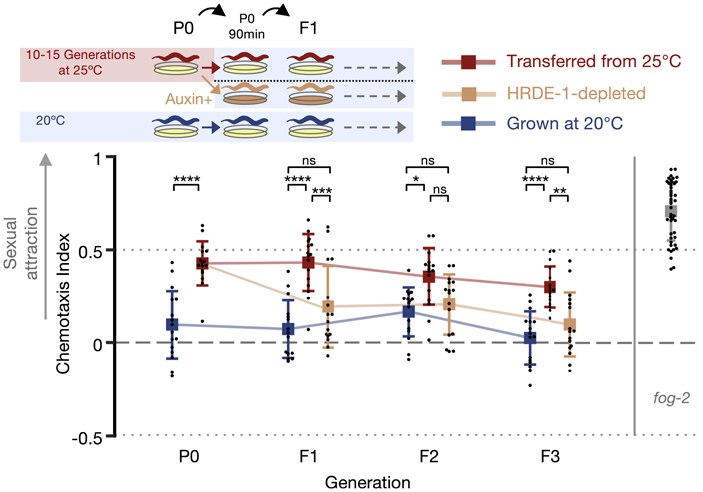
Рис. 4. Схема и результаты экспериментов по оценке роли гена HRDE-1 в эпигенетическом наследовании признака ранней сексуальной привлекательности (оцененной по активации хемотаксиса самцов летучим феромоном) у родительского поколения C. elegans (P0) и у потомков, не подвергавшихся стрессовому воздействию (F1–F3). Красным цветом отмечены значения для линии, подвергшейся протяжении 10–15 поколений воздействию повышенной температуры; оранжевым — для такой же линии, в которой родительские особи кратковременно (в течение часа) подверглись воздействию ауксина, обеспечившему полную деградацию белка HRDE-1; синим — для контрольной линии, выращиваемой постоянно при комфортной температуре 20°C. Звездочки над планками вверху графика указывают на наличие достоверного различия между сравниваемыми данными. Справа для сравнения показан индекс хемотаксиса для линии с мутацией fog-2 (положительный контроль). Рисунок из обсуждаемой статьи в Developmental Cell
Также авторы проверили роль некоторых других белков, участвующих в регуляции системы РНК-интерференции и процессинга молекул РНК у C. elegans. Белки meg-3 и meg-4 известны как необходимые структурные компоненты для формирования особых телец, присутствующих в норме в цитоплазме генеративных клеток (кстати, такие тельца выявляются в клетках зародышевой линии не только у круглых червей, но и у множества других видов животных из разных групп, включая позвоночных). Эти тельца образованы рибонуклеопротеиновыми комплексами, включающими в себя большое количество белков, матричных РНК и малых РНК. Предположительно, в этих тельцах осуществляется процессинг молекул РНК и их функционирование влияет на то, какие именно наборы малых РНК присутствуют в клетке. Культивирование червей в стрессовых условиях (повышенная температура) производило такой же эффект снижения количества цитоплазматических телец в генеративных клетках, как и искусственно внесенные нокаутирующие мутации генов meg-3 и meg-4. Эксперименты показали, что гомозиготные мутанты по генам meg-3 и meg-4 демонстрируют такой же фенотип «молодых и привлекательных», как и особи, подвергшиеся воздействию высокой температуры на протяжении 10–15 поколений. Причем потомство дикого типа (полученное последовательным скрещиванием гермафродитов-мутантов с немутантными самцами) сохраняло повышенную привлекательность для самцов на протяжении последующих шести поколений. В наследовании был задействован тот же механизм, что и в случае температурного воздействия, — его опять же можно было прервать при помощи временного блокирования работы белка HRDE-1.
Другие эксперименты с использованием линий с нокаутом тех или иных генов также подтвердили предположение о том, что признак поддерживается в потомстве именно посредством РНК-интерференции, опосредованной малыми РНК. Малые РНК со временем разрушаются. Постоянное сохранение и обновление этих молекул зависит от работы фермента РНК-зависимой РНК-полимеразы, которая у C. elegans осуществляет копирование и размножение присутствующих в клетке малых РНК.
Поскольку малые РНК регулируют деградацию белок кодирующих матричных РНК, исследователи проверили, на экспрессию каких именно генов влияет тепловой стресс. Как выяснилось, тепловое воздействие, равно как и нокаутирующие мутации генов meg-3 и meg-4 оказывает наибольшее влияние на уровни экспрессии генов, характерных для клеток зародышевой линии, и в особенности, связанных с развитием и функциональной активностью спермиев. Это в полной мере согласуется с тем, что мы знаем о системе регуляции факторов сексуальной привлекательности у этого вида червей, описанной выше. Изменения в экспрессии некоторых генов, кодирующих белки, нарастали кумулятивно по мере роста числа поколений, выращиваемых при повышенной температуре (таких генов было около 320). Именно закономерные изменения экспрессии этих генов, вероятно, объясняют кумулятивный эффект в изменении фенотипа гермафродитных особей (в частности, подавление сперматогенеза и рост концентрации выделяемых хемоаттрактантов).
Повышение доли событий перекрестного оплодотворения влияет на генетическую структуру и воспроизводство популяции в силу нескольких причин. Во-первых, в кладке самооплодотворившейся гермафродитной особи яиц значительно меньше, чем в кладке особи, оплодотворенной самцом. Это означает, что особи, активнее привлекающие самцов и успешно ими оплодотворяемые, будут эффективнее распространять свои гены в популяции. Во-вторых, потомство, формируемое при самооплодотворении, представлено исключительно гермафродитными особями, в то время как при перекрестном оплодотворении примерно половина потомков — это самцы. Таким образом, перекрестное оплодотворение благоприятствует дальнейшему росту количества перекрестных оплодотворений, хотя вместе с тем, непосредственно гермафродитных особей, производящих потомство следующего поколения, при этом становится меньше (это тот аспект полового размножения, который получил название проблемы «двойной цены самцов»). В-третьих, поскольку перекрестное оплодотворение подразумевает комбинирование геномов двух особей в зиготе, потомство от перекрестного оплодотворения оказывается генетически более разнородным, и это важное преимущество, когда речь идет о необходимости адаптироваться к изменяющимся стрессовым факторам среды. Здесь наглядно проявляется ситуация, когда эволюция создает эффективные регуляторные механизмы для адаптации, которые, в свою очередь, оказывают влияние на последующую эволюцию. И конечно, в такого рода исследованиях особо интригует та идея, что какие-то аспекты регуляции, выявленные на червячках Caenorhabditis elegans, могут в действительности иметь аналоги у гораздо более широкого круга организмов.
Источник: Itai Antoine Toker, Itamar Lev, Yael Mor, Yael Gurevich, Doron Fisher, Leah Houri-Zeevi, Olga Antonova, Hila Doron, Sarit Anava, Hila Gingold, Lilach Hadany, Shai Shaham, Oded Rechavi. Transgenerational inheritance of sexual attractiveness via small RNAs enhances evolvability in C. elegans // Developmental Cell. 2022. DOI: 10.1016/j.devcel.2022.01.005.
Татьяна Романовская
Последние новости





















Рис. 1. Графическое резюме обсуждаемой статьи. В ответ на стресс (развитие из яиц при повышенной температуре) нематоды Caenorhabditis elegans увеличивают выработку феромонов, привлекающих самцов, и повышают тем самым свою половую привлекательность (а значит и шансы оставить побольше потомства). Если последовательно подвергать такому стрессу 10–15 поколений нематод, то они начнут передавать эту приобретенную повышенную привлекательность по наследству: даже если их потомков выращивать в нормальных условиях, то они все равно будут вырабатывать феромоны на повышенном уровне. Правда, этот эффект работает всего несколько поколений и постепенно сходит на нет. Ученые разобрались в молекулярно-биологических и генетических деталях этого процесса. Рисунок с сайта cell.com