Как общаются амфибии
Евгений Панов
«Природа» №12, 2014
Изучая коммуникативное поведение животных, некоторые ученые склонны придавать особое значение акустическим сигналам, и зачастую при этом игнорируют другие каналы связи — зрительный, запаховой и тактильный. Тому, на мой взгляд, есть несколько причин. Первая из них — ложная аналогия между звуковой сигнализацией животных и речью людей, возникшая на основе наивного заблуждения, что звуки, издаваемые братьями нашими меньшими, непременно «означают» нечто конкретное. Именно на этой почве в середине прошлого века родилось дезориентирующее словосочетание «язык животных». Так, в частности, озаглавлена книжка (Animal language) за авторством знаменитого эволюциониста Д. Хаксли (J. Huxley) и его менее известного коллеги Л. Коха (L. Koch), вышедшая в свет в 1964 г. (на русский язык переведена в 1968 г.). Авторы мимоходом упоминают о том, что в общении животных важны самые разные сигнальные средства (например, специфические позы в брачном поведении птиц), но вся книга посвящена именно звуковой сигнализации, приравненной, таким образом, к «языку животных».
Вторая причина приоритета, отдаваемого этологами рассмотрению акустического поведения в ущерб всем прочим способам оповещения индивида о своем присутствии и о «своих намерениях», объясняется большей простотой получения первичных данных о звуковом оснащении животных. Показательно в этом смысле название первой главы книги Хаксли и Коха: «С микрофоном по зоопарку». С появлением портативных звукозаписывающих устройств в первой половине ХХ в., а также совершенных анализаторов звука, многие воспользовались отпавшей необходимостью изучать поведение животных, часами напряженно глядя в бинокль и фиксируя в блокноте тонкие детали происходящего. Гораздо проще стало выставить на территории самца того или иного вида птиц магнитофон и записать столько его песен, сколько требуют каноны статистической репрезентативности первичных данных. Далее можно было спокойно обрабатывать эти записи количественно в комфортной обстановке биоакустической лаборатории.
Все сказанное привело к формированию у некоторой части научного сообщества идеи, согласно которой именно в вокализации позвоночных вообще и млекопитающих в частности следует искать предтечу речи людей. Эта точка зрения наиболее последовательно проводится в недавней книге У. Фитча «Эволюция языка», где автор ратует за развитие новой, на его взгляд, области знаний, именуемой им биолингвистикой. Весь раздел книги, посвященный коммуникации животных, явным образом сводится к вопросу об использовании ими акустического канала связи. Из этого текста читатель может вынести ошибочное представление, что эта модальность лежит в основе главного и универсального инструмента обмена жизненно важной информацией между особями, по крайней мере у позвоночных.
Однако при более широком взгляде на происходящее выясняется, что это не так. Оказывается, существуют целые, весьма обширные, подразделения животных, где акустическая сигнализация либо отсутствует полностью, либо обнаруживается в виде исключения у немногих отдельных видов. Насколько известно сегодня, она нехарактерна в целом для огромного класса рыб, включающего более 20 тыс. видов. Не используется она и представителями отряда хвостатых амфибий, к которым относятся около 430 видов. В этом отношении они резко отличаются от своих близких родичей — бесхвостых земноводных, у которых акустическое поведение почти всегда хорошо развито. Наконец, «немыми» оказываются почти все рептилии (около 6 тыс.), которые по видовому разнообразию превосходят млекопитающих (примерно 4,5 тыс. видов) и лишь немногим уступают птицам (8,6 тыс. видов). Все это говорит о том, что жизненное благополучие в животном мире может прекрасно поддерживаться при полном отсутствии возможностей использования акустической сигнализации.
Далее речь пойдет о том, что известно сегодня о разнообразии процессов обмена акустической информацией в одном из крупных подразделений животного мира — у бесхвостых амфибий*.
Первопроходцы в освоении наземного образа жизни
Около 370 млн лет назад, в девонском периоде, начался процесс освоения суши позвоночными. Это стало возможным благодаря тому, что некоторые первоначально водные формы смогли постепенно перейти от жаберного дыхания к легочному. Становление этого нового способа потребления кислорода и использования его в качестве ресурса, без которого существование на суше немыслимо, произошло в результате формирования у видов-первопроходцев принципиально новой системы органов. Ее главным компонентом стали легкие — полые резервуары, которые через эластичную трубку-трахею могли свободно обмениваться газовым содержимым с массами воздуха во внешней среде.
Именно такие структуры стали в дальнейшем основой для формирования голосовых аппаратов у всех тех ныне живущих наземных позвоночных, которым в той или иной мере оказалось свойственно акустическое поведение. Эта черта ныне присуща подавляющему большинству представителей всего лишь трех крупных подразделений позвоночных. Это бесхвостые амфибии, птицы и млекопитающие.
Среди ныне живущих позвоночных кандидатом на роль ближайшего прямого предка амфибий до последнего времени считали кистеперых рыб. По идее, их лопастевидные плавники могли постепенно преобразоваться в конечности, обеспечивающие передвижение по твердому субстрату (ноги амфибий, рептилий и млекопитающих, относимых вместе с птицами к животным «четвероногим», по-научному — к тетраподам).
Такой общепринятой точке зрения противоречил, казалось бы, один очень важный факт. Дело в том, что из всех ныне живущих рыб дыхание кислородом воздуха свойственно другой, родственной кистеперым, группе — двоякодышащим рыбам. Обитают они в пресноводных водоемах и способны существовать в обедненной кислородом воде. Они могут даже переживать в состоянии анабиоза периоды временного высыхания этих акваторий.
Помимо жабр, двоякодышащие располагают своеобразными органами легочного дыхания — одним либо двумя пузырями, которые открываются в пищевод на его нижней стороне. Двоякодышащие известны палеонтологам с девонского периода (около 400 млн лет назад). Именно в то время, как полагают, некая предковая группа рыб разделилась на две ветви — двоякодышащих и кистеперых. Обе процветали на протяжении последующих примерно 150 млн лет, до начала триасового периода. Изучены ископаемые останки представителей 11–12 семейств двоякодышащих, из которых дожили до наших дней лишь два семейства с шестью видами. Один из них — обитающий в Австралии рогозуб, или баррамунда (Neoceratodus forsteri), — обладает одним легким, у пяти других их по два. Та же судьба угасания постигла и весьма многочисленных некогда кистеперых, с той разницей, что из них до нашего времени смогли дожить всего лишь два вида латимерий.
Предположение о том, что именно кистеперые, а не двоякодышащие были непосредственными предками амфибий, основывалось на ряде соображений сравнительно-анатомического характера, в частности на особенностях строения их черепа. Считали, что амфибии произошли от древних, ныне вымерших кистеперых рыб, таких в частности, как относящиеся к родам Eusthenopteron и Sauripterus. Однако молекулярно-генетическое исследование, проведенное совсем недавно обширным международным коллективом ученых, позволило выдвинуть гипотезу, альтернативную этой устоявшейся точке зрения. Исследователи пришли к выводу, что двоякодышащие исторически моложе кистеперых и, таким образом, стоят ближе них к той эволюционной ветви, которая дала начало всем наземным позвоночным, и амфибиям в том числе [1].

Современные амфибии подразделяются на три отряда. Наименее многочисленный из них по числу выживших форм — это амфибии безногие (около 190 видов), которые, как следует уже из их названия, внешне напоминают змей. Другой отряд — хвостатые, к которым относятся тритоны и саламандры (около 250 ныне живущих видов). Наконец, третье подразделение — бесхвостые (лягушки и жабы) — оказалось со временем наиболее процветающим. По числу видов они составляют примерно 90% от общего числа современных нам видов амфибий (около 7 тыс.).
Предполагается, что разделение древних амфибий на эти три группы началось около 250 млн лет назад, на рубеже палеозойской и мезозойской эр. Однако типичный облик представителей каждого из этих отрядов сформировался существенно позже — примерно 165 млн лет назад. Способность же генерировать звуки и использовать их во внутривидовой коммуникации появилась лишь у бесхвостых амфибий. Она свойственна подавляющему большинству (хотя и не всем) представителей этого отряда. Именно об акустическом поведении лягушек и жаб речь пойдет далее.
Дыхание и генерация звуков
Лягушки и жабы дышат не так, как все прочие наземные позвоночные. У них отсутствует система мышц (брюшных, межреберных и диафрагмы), которая обеспечивает механизм вдоха-выдоха, скажем, у млекопитающих. То, что можно назвать «вдохом», происходит следующим образом. Лягушка опускает нижнюю стенку ротовой полости, увеличивая тем самым ее объем. За счет этого воздух затягивается в полость через ноздри. Они затем замыкаются, дно ротовой полости поднимается, и воздух устремляется в легкие через открытую голосовую щель. При выдохе сокращение мышц тела выталкивает воздух из легких наружу и его струя заставляет вибрировать парные голосовые связки, ограничивающие просвет голосовой щели.
У самца, издающего звук, рот и ноздри закрыты. Это приводит к тому, что под давлением струи воздуха расширяется полость рта, поэтому у некоторых видов она превращается в надутый пузырь, сильно выступающий вниз и вперед. В данном случае он играет роль резонатора, вибрирующего с определенной частотой и усиливающего интенсивность именно этой акустической составляющей звукового сигнала. Другой вариант резонаторов представлен двумя тонкостенными пузырями, которые раздуваются под напором воздуха по углам сомкнутых челюстей.

Резонаторы разных типов: у самцов шлемоголовой жабы (слева) и краснопятнистой, или чернопятнистой квакши. Здесь и далее фото (за исключением специально отмеченных) А. Н. Гуржия
Эксперименты, выполненные на лягушках Micrixalus saxicola, обитающих по берегам стремительных водных потоков, где весьма высок уровень зашумленности, показали, что раздувающийся резонатор самца может сам по себе служить для конспецификов важным оптическим стимулом. По мнению авторов работы, он в сочетании с характерными движениями задних ног должен усиливать заметность самца для конкурентов и потенциальных половых партнеров. Здесь перед нами еще и яркий пример полимодальности сигнального поведения [2].

Вокально-оптическая сигнализация самцов лягушек Micrixalus saxicola и Staurois parvus. Фото Д. Прейнингера (D. Preininger)
Интересно, что присутствие резонаторов, которое выглядят как приспособление, резко увеличивающее эффективность дистантной звуковой сигнализации, присуще далеко не всем видам бесхвостых амфибий. Пожалуй, еще любопытнее тот факт, что даже в группах близкородственных видов у одних самцов резонаторы хорошо развиты, тогда как у других — они лишь в зачаточном состоянии либо вообще отсутствуют. Более того, описана изменчивость этого признака даже в пределах одного вида. Изучение этого вопроса на примере шести близких видов лягушек рода Rana из западных районов Северной Америки показало, что такая ситуация имеет место у трех из них. Например, у R. pretiosa, по данным трех разных авторов, резонаторы либо отсутствуют, либо слабо развиты, либо представлены парными структурами внутри ротовой полости. В одних популяциях R. draytonii самцы лишены усилителей звука, в других они обладают парными наружными резонаторами. У двух видов резонаторы отсутствуют полностью [3]. Нет их и у представителей некоторых таксонов бесхвостых (например, австралийских роющих лягушек родов Heleioporus и Neobatrachus), которые, тем не менее, способны издавать достаточно громкие звуки. Это пытались объяснить тем, что у них сама ротовая полость увеличена в объеме (в высоту) и, значит, сама играет роль резонатора.
Считается, что произнесение дистантных сигналов с закрытыми ртом и ноздрями приводит к сужению спектра частот и, соответственно, к акцентированию несущей частоты. Такой сигнал лучше воспринимается в присутствии фоновых шумов, и тем самым увеличивается дальность его действия. Рекламную вокализацию некоторых видов можно услышать на расстоянии более километра.
Самцы лягушки Leptodactylus albilabris, обитающей в Карибском бассейне, во время вокализации частично погружаются в мягкий грунт, так что сильно развитый резонатор приходит в тесное соприкосновение с ним. В результате наряду со звуком, распространяющимся в воздухе, воспроизводится также вибрация, передаваемая через почву. Эти инфразвуковые колебания распространяются на дистанцию до 3–6 м, то есть охватывают все персональное пространство самца (около 1–2 м в диаметре) внутри хорового скопления нескольких особей этого пола.
Репертуар звуковых сигналов и их акустические характеристики
Как правило, вокальные сигналы дальнего действия издают только самцы. У большинства видов их репертуар ограничивается немногими типами звуков, каждый из которых используется в разных ситуациях. Чаще всего выделяют: рекламную песню, служащую для обозначения границ индивидуальной территории самца и привлечения сюда самок, и звуки, сопутствующие непосредственным агрессивным контактам самцов. Во взаимоотношениях между самцами вокализация первого типа способствует их рассредоточению в пространстве. Это так называемое антифональное пение (дуэт, в котором партии партнеров чередуются), позволяющее каждому получать текущую информацию о местонахождении потенциальных конкурентов. Сказанное относится как к тем видам, самцы которых держатся более или менее изолированно, так и к таким, у которых они образуют компактные группировки, именуемые «хорами». Во время прямых столкновений между хозяевами соседних участков «агрессивный сигнал» второго типа нередко служит попросту концовкой рекламной песни. У ряда видов звуки, которые наблюдатель расценивает в качестве звуков угрозы, оказываются включенными, более или менее регулярно, в рекламную песню. В целом звуки, о которых идет речь, достаточно стереотипны, а вокализация каждого их исполнителя, длящаяся порой часами, воспринимается как весьма монотонная.
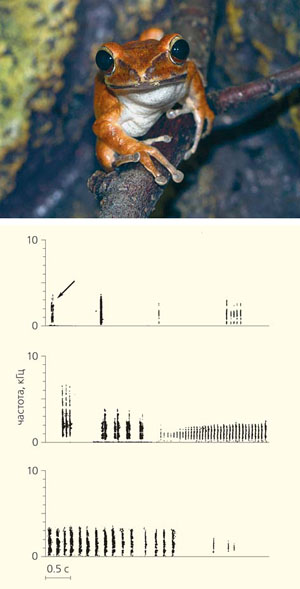
Разнообразие вокализации лягушки Polypedates leucomystax [4]. Стрелкой на верхней сонограмме показан «нормальный крик»
Известно лишь несколько исключений из этого общего правила. Например, акустический репертуар самцов южно-азиатской древесной лягушки Polypedates leucomystax (семейство Rhacophoridae) включает 12 типов звуков. Правда, почти половина (49%) из 1344 проанализированных звуков были однотипными; авторы отнесли их к категории «нормальных криков» [4]. Этот сигнал самец, находящийся в одиночестве, повторял реже трех раз в минуту. Дальность его действия составляла около 50 м. Это, по сути дела, и есть рекламная песня самцов данного вида, которая служила для привлечения самок. По наблюдениям авторов статьи, самки молча двигались направленно к источнику этого звука. Все прочие звуки сопровождали конфликты между самцами.
Чемпионом по разнообразию вокализации среди бесхвостых амфибий считают мадагаскарский вид Boophis madagascariensis, относящийся, что показательно, к тому же семейству Rhacophoridae. В репертуаре самцов насчитали 28 вариантов элементарных звуков, которые складываются по меньшей мере в восемь различных акустических конструкций. Анализ последовательностей звуков в сеансе вокализации самца показал, что разные их варианты следуют, в общем, в случайном порядке. Интересно, что не удалось обнаружить никаких морфологических особенностей голосового аппарата, которые были бы ответственны за столь уникальный характер вокализации у этого вида [5].

Лягушка Boophis madagascariensis и разнообразие ее вокализации. Показаны осциллограммы и сонограммы сигналов [5]. Вверху — самец (фото H. Cook, Австралия) и пара в амплексусе (фото L. Denes)
Помимо сигналов, именуемых рекламными и агрессивными, в репертуарах многих видов присутствует еще один звук — так называемый сигнал протеста, или высвобождения. Его издает самка, не готовая в данный момент к копуляции, в ответ на попытку самца охватить ее передними лапами, что предшествует нормальному спариванию (амплексусу). Тот же тихий звук можно слышать и от самца, которого по ошибке пытается схватить другой самец — ситуация, вполне обычная у видов, где сексуально активные самцы образуют плотные скопления. Протестный звук, в отличие от рекламных и агрессивных, производится с открытым ртом и слышен лишь на небольшом расстоянии.
У большинства видов амфибий, чья вокализация изучена достаточно полно, самки, как полагают, не издают никаких других звуков, помимо сигнала протеста. Однако у очень немногих видов описана вокализация самок, приуроченная к моментам ухаживания за ними самцов и нормального амплексуса. О редкости этого явления свидетельствует тот факт, что такие сигналы обнаружены лишь у 4 из 19 исследованных видов рода Rana семейства Ranidae. Известны они также у отдельных видов жаб рода Alytes (семейство Discoglassidae) [6]. По своей акустической структуре эти звуки более сходны с рекламной песней самцов, нежели с сигналом протеста.
Частотные характеристики звуков варьируют в широких пределах, как по высоте, так и по ширине спектра заполнения. При этом очень близкие параметры часто характеризуют систематически неродственные виды, тогда как близкие виды, относящиеся к одному роду, могут существенно различаться по названным параметрам. Это явление весьма широко распространено среди бесхвостых амфибий, причем речь может идти не только о частотных характеристиках звуков, но также об их временной организации и прочих структурных параметрах [7, 8].
Роль рекламной вокализации самцов
В многочисленных современных исследованиях, посвященных вокализации бесхвостых амфибий, внимание сконцентрировано на том, как именно она обеспечивает контакт половых партнеров в период размножения. Ученые пытаются выявить принципы, в соответствии с которыми самки лягушек или жаб могут отдавать предпочтение тем или иным характеристикам звуковых сигналов, поступающих от разных потенциальных половых партнеров.
Первоначально большая часть таких работ была выполнена в лаборатории. Через два динамика самке одновременно транслировали магнитофонные записи голосов разных самцов данного вида. Один из выводов, сделанных на основе этой методики, состоял в том, что самки склонны отдавать предпочтения звукам с преобладанием низких частот. Известно, что низкочастотность сигналов характерна для крупных особей, поэтому последовало заключение — самки выбирают в качестве половых партнеров именно таких самцов.
В дальнейшем, когда исследования были перенесены из лаборатории в природу, эта простая идея была поставлена под сомнение, как и сама способность самок осуществлять направленный поиск конкретного самца. Все более преобладает точка зрения, высказанная, в частности, в следующей цитате. «Поиски самками половых партнеров у видов бесхвостых амфибий... резко лимитированы в естественных условиях, где рекламные сигналы самцов заглушаются средовыми шумами, которые генерируются вокализацией других видов лягушек и жаб, не говоря уже о хорах самцов-конспецификов. Поскольку самка в состоянии оценить характер звуков, издаваемых лишь немногими самцами, ближайшими к ней, возможности ее поисков ограничены лишь малой выборкой (subsample) потенциальных половых партнеров» [9]. Авторы добавляют, что основная задача самки в таких условиях состоит в поисках конспецифического самца, дабы избежать нежелательного межвидового спаривания.
То, что дело обстоит именно так, теперь уже подтверждено экспериментально. Например, самки Hyperolius marmoratus в тестах на одновременный выбор из нескольких видоспецифических сигналов с разными частотными характеристиками действительно отдают предпочтение тем, которые лежат в нижней зоне спектра. Однако при увеличении числа самцов, участвующих в хоровой вокализации, реакции тестируемых самок меняются — они становятся не столь разборчивыми и могут остановить свой выбор на половом партнере, издающем звуки иной структуры [10]. То же самое показано в отношении самок квакши Hyla ebraccata. В отсутствие шума (соотношение сигнал / шум >25 дБ) они предпочитают низкочастотные видоспецифические сигналы. При умеренных уровнях шума (6 и 9 дБ) возможность распознавать звуки снижается. При высокой зашумленности предпочтения самок к низкочастотным сигналам уступают место поискам источников таких, которые по частотным характеристикам соответствуют модальным для изученной популяции. Таким образом, у самок снижается способность к распознаванию частотных характеристик рекламной вокализации самцов даже при умеренных уровнях зашумленности акустического канала связи [11].
Понятно, что истинный ход событий может быть различным у разных видов, в зависимости от общих особенностей их биологии размножения. Наиболее важным фактором здесь оказывается характер размещения самцов в пространстве в период размножения. В этом плане все виды можно разделить на две основные категории.
К одной из них относятся те, у которых размножение не приурочено к какому-то краткому периоду времени. Самцы остаются, постоянно или эпизодически, в пределах своих индивидуальных участков и активно рекламируют свое присутствие видоспецифическими сигналами, по большей части (хотя и не всегда) акустическими. Эти участки посещают готовые к спариванию самки. Образ жизни разных видов, относящихся к этой категории, может быть принципиально различным — главным образом, в зависимости от того, насколько сильно взрослые особи и особенно личинки нуждаются в воде. Это обстоятельство определяет в значительной степени и характер взаимоотношений между полами у разных видов, например, в сфере заботы о потомстве. У большинства видов особи обоих полов остаются в период размножения привязанными к открытым акваториям. Но есть виды, которые приспособились обходиться в это время вообще без воды, либо нашли способ пользоваться лишь ограниченными ее количествами, иначе личинки-головастики не смогли бы выжить.
У видов второй категории период размножения ограничен сжатыми сроками. Подавляющее большинство привязаны в период размножения к акваториям большей или меньшей площади, где самцы вынуждены концентрироваться, формируя плотные агрегации. В результате численность самцов и плотность их размещения в водоеме оказываются весьма значительными. Из-за этого конкурентные взаимоотношения между ними принимают хаотичный характер. Контакты становятся преимущественно неупорядоченными, что придает происходящему характер непрекращающейся свалки. Такие системы получили название «взрывных».
Посмотрим теперь на нескольких примерах, что же все-таки удалось узнать о роли вокализации самцов как показателя их привлекательности для самок.
Лягушки древолазы
Эти амфибии семейства Dendrobatidae замечательны тем, что существенно продвинулись в направлении сугубо наземного образа жизни. К семейству относятся около 250 видов этих ядовитых древесных лягушек, обитающих в Южной Америке. Их образ жизни детально изучен на примере 12 видов [12]. Это типичные представители первой категории, поскольку размножение у них идет круглый год. У девяти изученных видов территориальны только самцы, у одного — только самки, а у двух (предположительно) особи обоих полов. Площадь территорий особи обычно не превышает 5 м2, но для некоторых приводятся значительно большие величины (до 7, 11, 16 и даже 44 м2). Для девяти видов описана вокализация самцов, служащая для охраны территории и привлечения самок.
После спаривания на влажном субстрате кто-либо из родителей охраняет кладку, а после вылупления головастиков этот член временной пары переносит их на спине туда, где есть хоть немного воды. Многие виды дендробатид используют для этой цели розетки листьев эпифитных растений из семейства бромелиевых (Bromeliaceae), в которых скапливается дождевая вода. Это свойственно, в частности, амазонским лягушкам вида Dendrobates ventrimaculatus, у которых головастиков в эти розетки транспортируют самцы, а самки подкармливают свое потомство яйцами, если появляется опасность высыхания личинок [13].
У этого вида территории самцов локализованы в местах с наибольшей плотностью бромелий. Самки, участки обитания которых больше территорий самцов, должны быть хорошо осведомлены о распределении на местности колыбелей для будущих головастиков. Поскольку в данном случае, в отличие от ряда других видов дендробатид, самцы не практикуют широковещательную рекламную вокализацию, очевидно, что самки выбирают территории тех самцов, где бромелии произрастают в наибольшем количестве. После появления самки на территории самца она следует за хозяином участка, обходящим последовательно известные ему экземпляры бромелий. Эта церемония, сопровождаемая вокализацией самца, может длиться несколько часов. Нередко один и тот же экземпляр растения пара посещает несколько раз. Вокализация самца может привлечь на место действия самца-соперника. В таких случаях хозяин участка отвлекается от взаимодействий с самкой, пытаясь изгнать пришельца с помощью угрожающих вокальных сигналов и прямого физического контакта с ним. Иногда пришлому самцу удается увести самку на свою территорию. Все это говорит о том, что при поисках полового партнера самка может ориентироваться главным образом на качество его территории, а не на характер его вокализации.
У амазонского вида D. pumilio самцы занимают участки обитания площадью до 25–55 м2 (в среднем в разных популяциях 11,0–16,5 м2), охраняя внутри них территории величиной от 0,3 до 5 и более квадратных метров посредством рекламной вокализации. Дистанция между кричащими самцами может составлять 2–3 м. Когда чужак приближается к территории хозяина, тот сменяет рекламное пение на агрессивный сигнал, воспроизводя его в форме антифонального дуэта с пришельцем.
Как выяснила Х. Прол, на протяжении девяти месяцев половой активности количество спариваний самца варьирует в разные годы от нуля до 18 или даже 26. Самец может спариваться подряд с двумя и тремя самками. Прол поставила своей задачей оценить зависимость репродуктивного успеха самца от характера его вокализации и пришла к выводу, что единственный показатель, коррелирующий с успехом самца, — это уровень его акустической активности, которая выражается в высокой, устойчивой повторяемости сигналов во времени [12, 14]. Физические параметры сигнала (такие, как его частотные характеристики и длительность отдельных криков) можно в этом плане не принимать во внимание.
В то же время, как пишет автор, сомнительно, чтобы самка могла оценивать качество партнеров, основываясь только на уровне их акустической активности. Во-первых, самка не в состоянии оценить значение этого параметра за длительное время. Во-вторых, тот факт, что она может отвергнуть самца, уже пребывая на его территории, говорит, по мнению автора, о том, что ее выбор основывается на иных стимулах, действующих на небольших расстояниях (очевидно, химических). Кроме того, поскольку участок обитания самки перекрывает территории обитания двух-шести самцов, она вынуждена ограничиваться этой небольшой выборкой, что не дает возможности вывести строгие корреляции между особенностями вокализации самца и его репродуктивным успехом.
Прослеживание судеб одних и тех же самцов на протяжении двух лет показало, что их успех у самок повышается с возрастом и связан с длительностью удержания ими территорий. В отличие от многих других исследований по вокализации бесхвостых амфибий, не удалось найти корреляции между доминантной частотой сигнала и размерами и массой самцов, а также указаний на то, что при выборе полового партнера эти лягушки ориентируются на его общие размеры.
Гиперолииды, квакши, филломедузы
Амфибии этих таксонов отличаются от прочих видов лягушек с растянутым сезоном размножения лишь тем, что у этих амфибий самцы присутствуют на своих индивидуальных участках эпизодически, а не постоянно, как у древолазов-дендробатид. Таковы, в частности, мелкие лягушки из семейств Hyperoliidae и Hylidae (куда относятся квакши рода Hyla и филломедузы рода Phyllomedusa). Все они ведут наземно-древесный образ жизни, концентрируясь только эпизодически вблизи водоемов и/или на полупогруженной в воду растительности из-за потребности оставить потомство. Группировки самцов этих видов принято называть «хоровыми сборищами».
В тех исследованиях по этим видам, где обсуждается тема успеха самцов у самок, важное значение придают временным показателям присутствия самца в такого рода агрегациях. Как пишут М. Дайсон с соавторами, «...некоторые фенотипические особенности самца, такие как настойчивость в эманации вокальных сигналов и их длительность, существенно влияют на частоту спариваний самца. Но в качестве наиболее важного фактора считают время его пребывания в группе кричащих соперников» [15].
В брачных агрегациях квакши Hyla regilla дистанции между самцами варьируют от 40 до 130 см, максимально — до 190 см. Модальное значение равно 90–100 см. Средняя дистанция между кричащими самцами квакши Hyla goiana составляет 2,7±1,5 м, значения менее 1 м наблюдали редко [16]. У вида Hyperolius marmoratus, особи которого примерно такой же величины (до 4,5 см в длину), средняя дистанция между самцами в агрегациях еще значительнее, в среднем 7,58±6,45 м (в 75% случаев менее 10 м) [17]. В отличие от этих видов, хоровые сборища которых формируются на поверхности акватории, у филломедуз самцы концентрируются на ветвях деревьев или кустарников, нависающих над водой. Здесь самец филломедузы Phyllomedusa rohdei перемещается между своими песенными постами в радиусе около метра (101,7±50,0 см) [18].
Поведение африканской раскрашенной лягушки (Hyperolius marmoratus) группа исследователей во главе с М. Дайсон изучала на протяжении всего сезона размножения, с сентября по февраль. Самцы, участвующие в хоре, держатся в водоеме на выступающей из воды растительности. Они активны только в темное время суток, когда можно слышать их хоровую вокализацию. Чем многочисленнее самцы в составе агрегации, тем меньше дистанция между ними. В среднем в радиусе 10 м вокруг самца присутствуют 5–7 других.
Состав самцов в данном фрагменте водоема непостоянен. Время пребывания здесь самца составляет от одной до 11 ночей (в среднем 2,4±1,6). 79,5% самцов присутствовали в составе хора три ночи или менее. В среднем только 20% самцов были встречены две ночи подряд. Те, которых отмечали повторно, оставались неподалеку от места своего пребывания в предыдущую ночь: 80% на расстоянии не более 8 м от него и почти 50% — вдвое ближе.
Удалось показать, что у самца, который спарился однажды, повышается вероятность добиваться успеха в дальнейшем. Выяснили также, что продолжительность вокализации у таких самцов в каждую данную ночь меньше (в среднем на 2,5 часа), чем у тех, которые не получили доступа к самкам. Первые транслируют в среднем 2137 звуковых сигналов (разброс от 9 до 7286), вторые — 6110 (1852–11281) [17]. Авторы не объясняют причин этих различий, но можно думать, что участие в спаривании ведет к снижению половой мотивации и, соответственно, к снижению интенсивности саморекламирования.

Вокализирующий самец листолаза Энтони (Epipedobates anthonyi)
У филломедуз самки откладывают яйца в свернутый лист дерева или куста, нависающего над водой. Сворачивание листа осуществляется или самкой, готовой к спариванию, или обоими партнерами после садки самца на самку [18–20]. Вышедшие из яиц головастики падают в воду и там завершают свое развитие.
Группа зоологов во главе с Х. Фогель исследовала в деталях брачное поведение вида Phyllomedusa rohdei в Бразилии, на пересыхающем водоеме площадью около 170 м2 [18, 19]. Число кричащих самцов варьировало в разные ночи от 8 до 61 (в среднем 26,6±14,3). При сравнительно невысокой плотности самцов в хоре выявлена очевидная тенденция к неслучайному, контагиозному, их размещению. Число самцов в кластерах составляло от 2 до 6 (3,2±1,0).
Самцы держались на ветвях прибрежной растительности на высоте около полуметра и не далее 70 см от воды. Здесь они перемещались с ветки на ветку в радиусе около метра, оставаясь на той или иной присаде по 6–7 мин. При остановках они вертели головой или поворачивались всем телом в разные стороны, изучая окружающую обстановку. Самцов подразделяли на две группы: «державшихся вместе» (ДГ) и «изолированных» (И). К числу первых относили тех, от которых в радиусе 1 м присутствовал хотя бы еще один самец. И-самцы находились на расстоянии более метра от всех прочих. Вокализация самцов не была одновременной и постоянной. Интервалы между сериями сигналов длились по несколько минут. И-самцов можно было видеть в хорах любой величины.
В зоне хора на протяжении ночи находилось не более 10 самок. Каждая из них, приближаясь к скоплению самцов, перемещается с ветки на ветку, явно разыскивая нависающий над водой лист, пригодный для постройки гнезда. Найдя подходящий лист, она пробует его пригодность и может переместиться на другой. Когда самка свертывает лист, работая всеми четырьмя лапами, к ней быстро приближается самец, иногда издавая при этом тихий вариант рекламного звукового сигнала. Если активных самцов более одного, они начинают конфликтовать друг с другом, что подчас переходит в подобие драки. Самец, оказавшийся первым рядом с самкой, сразу же делает садку на нее. После того, как произошел амплексус, самка начинает откладывать яйца, одновременно оплодотворяемые самцом.
Двадцать семь (55%) спариваний из 49 осуществили ДГ-самцы, 18 (37%) — И-самцы. При этом показано, что те и другие не различались достоверно ни по размерам (39,2±1,7 и 38,4±2,9, соответственно), ни по массе тела. Единственным показателем, коррелирующим с успехом самцов, оказалось число ночей, проведенных тем или иным из них в составе хора.
Следует заметить, что у Hyperolius marmoratus и квакш рода Hyla (в отличие от филломедуз) самка, идущая на крики самца, движется очень медленно и целенаправленно, с остановками. Самец H. marmoratus, опознающий самку с расстояния около 20 см, остается неподвижным и лишь увеличивает темп вокализации. Только после того, как самка коснулась его, он делает садку. Создается впечатление, что самки избегают тех самцов, которые проявляют двигательную активность в момент сближения потенциальных партнеров. Аналогичную картину мы видим у европейской квакши. Даже когда самка оказывается в нескольких сантиметрах от самца, он продолжает кричать и никогда не делает садку, пока она не коснется его мордой. Также и самцы, кричащие на расстоянии в несколько сантиметров от пары в амплексусе, не предпринимают попыток сместить самца, добившегося успеха. Исследователи никогда не наблюдали у этого вида активного поиска самцами самок [9]. Совершенно аналогичное поведение партнеров в преддверии амплексуса описано также у зеленой лягушки R. clamitans, относимой к категории территориальных видов [21] — в противоположность тому, что мы видим у «территориальных» филломедуз.
Виды с взрывной системой размножения
Период размножения таких видов занимает обычно от нескольких дней до двух недель, как это описано, например, для пяти видов американских лягушек рода Rana. У них икрометание происходит весьма синхронно, так что большая часть самок откладывает яйца на протяжении одной ночи [22]. В репродуктивных агрегациях этих амфибий дистанции между самцами сопоставимы с размерами их тела. Агрегации самцов часто бывают очень плотными, состоящими из сотен особей. Например, у озерной лягушки R. ridibunda насчитывали от 25 до 30 особей на м2, при дистанциях между самцами в 10–20 см. Самцы пытаются делать садку на ближайших к ним особей, вне зависимости от их пола. Иногда до пяти-шести самцов борются за обладание одной самкой [22]. Естественно поэтому, что в ситуации хаотической «борьбы без правил» всех со всеми (scramble competition) преимущество получают, хотя и не всегда, более крупные в среднем самцы старших возрастных групп, способные отбить самку у меньших по размерам конкурентов. При этом победитель может даже вытеснять самца, уже схватившего самку, и занять его место. Такое явление описано для 10 из 14 видов жаб рода Bufo, детально изученных в этом отношении, и для двух из четырех видов лягушек рода Rana.
Важно заметить, что как только внешние условия позволяют удлинить период размножения, взрывная система уступает место более или менее четко выраженной территориальности. Последняя описана у двух североамериканских видов зеленых лягушек: R. catesbeiana и R. clamitans. Как показал Т. Вайвандт, три наиболее активно кричавших самца первого из этих видов занимали широко разнесенные в пространстве участки пруда площадью 30×25 м и охраняли от посягательств конспецификов фрагменты береговой линии длиной от 9 до 25 м [23]. У второго вида размеры участков самцов зависят от плотности водной растительности. В плотных зарослях камыша, где видимость ограничена, самцов-соседей разделяли дистанции в 1,0–1,5 м. Там, где участки водной глади были обширнее, самца охраняли зоны диаметром 4,0–6,0 м, стараясь не выходить за их границы и не вступать в конфликты с соседями [21]. Этот автор не обнаружил очевидных поведенческих различий между самцами и пришел к выводу, хорошо обоснованному эмпирически, согласно которому самки ориентируются не на размеры и/или акустическую активность самцов, но на качество их территорий. После посещения нескольких из них самка останавливается, как правило, на участках с наиболее плотными зарослями элодеи, создающими наиболее благоприятные условия для развития яиц.
Можно было бы привести немало примеров того, какую важную роль в коммуникации лягушек и жаб играют другие сигнальные средства — окраска половых партнеров, обонятельные стимулы и тактильные ощущения во время амплексуса. У некоторых видов степень развития этих каналов связи такова, что животные попросту обходятся без обмена звуковыми сигналами на расстоянии. Но это — уже совсем другая тема.
Литература
1. Amemiya C. T., Alföldi J., Lee A. P. et al. The African coelacanth genome provides insights into tetrapod evolution // Nature. 2013. V. 496. № 7445. P. 311–316. DOI: 10.1038/nature12027.
2. Preininger D., Boeckle M., Freudmann A. et al. Multimodal signaling in the Small Torrent Frog (Micrixalus saxicola) in a complex acoustic environment // Behav. Ecol. Sociobiol. 2013. V. 67. № 9. P. 1449–1456. DOI: 10.1007/s00265-013-1489-6.
3. Hayes M. H., Krempels D. M. Vocal sac variation among frogs of the genus Rana from western North America // Copeia. 1986. V. 4. P. 927–936.
4. Christensen-Dalsgaard J., Ludvig T. A., Narins P. M. Call diversity in an Old World treefrog: Level dependence and latency of acoustic responses // Bioacoustics. 2002. V. 13. № 1. P. 21–35. DOI: 10.1080/09524622.2002.9753484.
5. Narins P. M., Lewis E. R., McClelland B. E. Hyperextended call note repertoire of the endemic Madagascar treefrog Boophis madagascariensis (Rhacophoridae) // J. Zool. Lond. 2000. V. 250. P. 283–298.
6. Emerson S. B., Boyd S. K. Mating vocalizations of female frogs: Control and evolutionary mechanisms // Brain Behav. Evol. 1999. V. 53. P. 187–197.
7. Rand S. Tradeoffs in the evolution of frog calls // Proc. Indian Acad. Sci. (Anim. Sci.) 1985. V. 94. № 6. P. 623–637.
8. Fears B. A. C. Laryngeal apparatus and call structure in North American hylids // A Thesis for the Degree master of science, Missouri Uniiv. of Science and Technology. 2010.
9. Friedl T. W. P., Klump G. M. Sexual selection in the lek-breeding European treefrog: body size, chorus attendance, random mating and good genes // Anim. Behav. 2005. V. 70. P. 1141–1154.
10. Telford S. R., Dyson M. L., Passmore N. I. Mate choice occurs only in small choruses of Painted Reed Frogs Hyperolius marmoratus // Bioacoustics: The International Journal of Animal Sound and its Recording. 1989. V. 2. № 1. P. 47–53.
11. Wollerman L., Wiley R. H. Background noise from a natural chorus alters female discrimination of male calls in a Neotropical frog // Anim. Behav. 2002. V. 63. P. 15–22.
12. Pröhl H. Territorial behavior in dendrobatid frogs // J. Herpetol. 2005. V. 39. № 3. P. 354–365. DOI: 10.1670/162-04A.1.
13. Poelman E. H., Dicke M. Space use of Amazonian poison frogs: Testing the reproductive resource defense hypothesis // J. Herpetol. 2008. V. 42. № 2. P. 270–278.
14. Pröhl H. Variation in male calling behaviour and relation to male mating success in the Strawberry Poison Frog (Dendrobates pumilio) // Ethology. 2003. V. 109. № 4. P. 273–290. DOI: 10.1046/j.1439-0310.2003.00863.x.
15. Dyson M. L., Henzi S. P., Halliday T. R., Barrett L. Breeding success in mating male reed frogs (Hyperolius marmoratus) // Proc. R. Soc. Lond. 1998. V. 265. P. 1417–1421.
16. Menin M., Silva R. A., Giaretta A. A. Reproductive biology of Hyla goiana (Anura, Hylidae) // Iheringia. Sér. Zool. 2004. V. 94. № 1. P. 49–52.
17. Dyson M. L., Passmore N. I., Bishop P. J. Male behavior and correlates of mating success in a natural population of African Painted Reed Frogs (Hyperolius marmoratus) // Herpetologica. 1992. V. 48. № 2. P. 236–246.
18. Wogel H., Abrunhosa P. A., Pombal J. P. Jr. Breeding behaviour and mating success of Phyllomedusa rohdei (Anura, Hylidae) in south-eastern Brazil // J. Nat. Hist. 2005. V. 39. № 22. P. 2035–2045.
19. Wogel H., Abrunhosa P. A., Pombal J. P. Jr. Choruses organization in the leaf-frog Phyllomedusa rohdei (Anura, Hylidae) // Herpetol. J. 2006. V. 16. P. 21–27.
20. Rodrigues D. J., Uetanabaro M., Lopes F. S. Breeding biology of Phyllomedusa azurea Cope, 1862 and P. sauvagii Boulenger, 1882 (Anura) from the Cerrado, Central Brazil // J. Nat. Hist. 2007. V. 41. № 29–32. P. 1841–1851.
21. Wells K. D. Territoriality and male mating success in the Green Frog (Rana clamitans) // Ecology. 1977. V. 58. № 4. P. 750–762.
22. Wells K. D. The social behaviour of anuran amphibians // Anim. Behav. 1977. V. 25. № 3. P. 666–693.
23. Wiewandt T. A. Vocalization, aggressive behavior, and territoriality in the bullfrog, Rana catesbeiana // Copeia. 1969. P. 276–285.
* О коммуникативном поведении других животных можно прочесть в книге автора «Эволюция диалога. Коммуникация в развитии: от микроорганизмов до человека», номинированной в 2014 г. на конкурс «Просветитель». Подробнее о книге см. в разделе «Новые книги», с. 89.
















Филогения тетрапод и место в ней амфибий [1]