Синтезирован суперантибиотик, к которому не вырабатывается резистентность
Химики из Научно-исследовательского института Скриппс, модифицировав антибиотик ванкомицин, получили вещество, проявляющее по отношению к устойчивым к ванкомицину энтерококкам в сотни раз более высокую противомикробную активность, чем у применявшихся ранее производных ванкомицина. Помимо высокой противобактериальной активности достоинство нового вещества еще и в том, что патогенные микроорганизмы не смогли выработать к нему резистентность даже за 50 поколений, в то время как устойчивость ко многим другим антибиотикам появляется уже в десятом поколении «знакомых с ним» бактерий.
Последняя линия обороны человечества от патогенных бактерий (см. Lines of therapy), возможно, скоро пополнится новым антибиотиком «последнего резерва», или «последней надежды», — так называют лекарства, используемые тогда, когда все остальные медикаменты не помогли (см. Drug of last resort). Синтезированное в Научно-исследовательском институте Скриппс вещество, получившее пока обозначение «ванкомицин 3.0», успешно борется с самыми опасными для цивилизации патогенными микроорганизмами — микробами, устойчивыми к действию классических антибиотиков «первой линии обороны» (то есть таких, которым отдается предпочтение при борьбе с конкретной инфекцией).
С момента появления антибиотиков первого поколения ситуация с разработкой препаратов против инфекционных заболеваний напоминает гонку вооружений (см. Evolutionary arms race). Схема каждый раз одна и та же. Специалисты по медицинской химии запускают в производство «новую надежду» — антибиотик, работающий более эффективно, чем предыдущие версии препаратов. Однако микроорганизмы вырабатывают резистентность (устойчивость к действию того или иного фармацевтически активного вещества; см. Антибиотикорезистентность) к нему и «наносят ответный удар». Такую перспективу еще в 1945 году в своей Нобелевской речи предсказывал изобретатель пенициллина Александр Флеминг.
В наши дни патогенные микроорганизмы, резистентные к действию антибиотиков, становятся причиной смерти от инфекционных заболеваний не только в развивающихся государствах, но и в странах с развитой медицинской инфраструктурой (более подробно о проблемах, которые ставит перед человечеством устойчивость бактерий к антибиотикам, можно прочитать в статье Антибиотиковый апокалипсис).
Врачи стараются применять антибиотики последней линии обороны («последнего резерва») только в крайнем случае. Почему? Во-первых, чаще всего эти вещества сложны для промышленного производства, что не может не оказать влияние на их стоимость. Во-вторых, после терапии такими мощными антибиотиками пациенту обычно приходится проходить дополнительный курс лечения, чтобы восстановить организм. В-третьих, частое применение антибиотиков «последнего резерва» может способствовать выработке у патогенных микроорганизмов резистентности к их действию, что, очевидно, сделает препарат бесполезным.
В 1958 году в списке антибиотиков «последнего резерва» появился ванкомицин (или ванкомицин 1.0; см. рис. 1), показавший свою эффективность в борьбе с метициллинрезистентным золотистым стафилококком (Methicillin-resistant Staphylococcus aureus, MRSA) (см. McCormick MH et al., 1955–1956. Vancomycin, a new antibiotic. I. Chemical and biologic properties). Из-за появления штаммов, устойчивых к действию ванкомицина 1.0, эффективность этого препарата значительно упала. Однако через полвека после начала его применения специалисты по медицинской химии разработали ряд его производных, получивших общее обозначение «ванкомицин 2.0» (см. B. M. Crowley, D. L. Boger, 2006. Total synthesis and evaluation of [Ψ[CH2NH]Tpg4]vancomycin aglycon: Reengineering vancomycin for dual D-Ala-D-Ala and D-Ala-D-Lac binding). Не дожидаясь, когда станет бесполезным и ванкомицин 2.0, исследователи предложили третью модификацию этого антибиотика — ванкомицин 3.0. Изменениям подверглось три элемента структуры антибиотика, и за счет этого он получил способность наносить тройной, комбинированный удар по бактериям. Исследователи подбирали модификации, опираясь на знания о механизме работы ванкомицина 1.0.
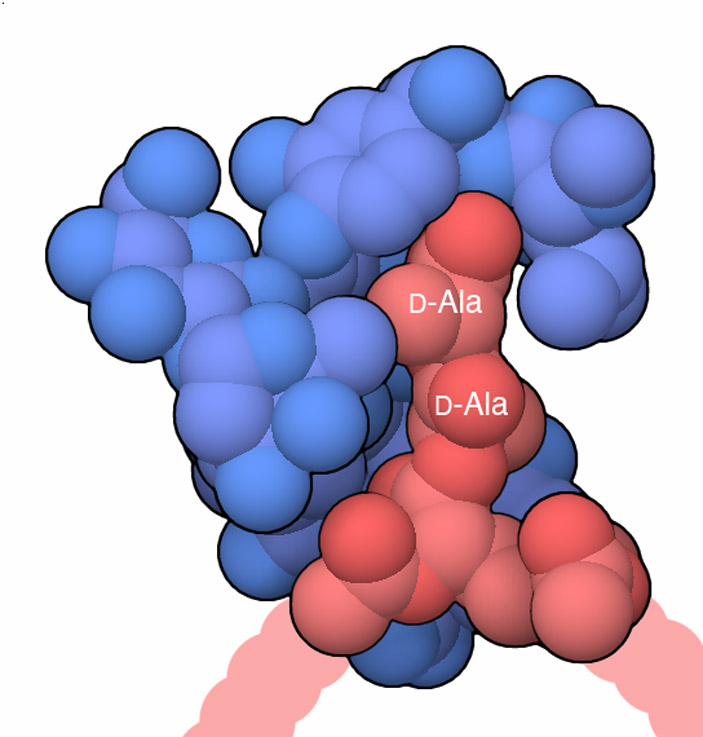
Ванкомицин убивает бактерии, препятствуя строительству их клеточных стенок. Известная с 1958 года версия антибиотика способна связываться с расположенным на N-конце белка фрагментом, состоящим из двух остатков аминокислоты D-аланина (D-Ala-D-Ala). Поскольку такой N-концевой фрагмент характерен сразу для двух вовлеченных в строительство клеточных мембран ферментов — трансгликозилазы (см. Гликонеогенез) и транспептидазы (см. Пептидогликан), «секретное оружие» ванкомицина было способно убивать сразу двух зайцев, затрудняя работу сразу обоих ферментов. Однако эволюция бактерий привела к тому, что в некоторых штаммах N-концевой D-аланильный остаток трансгликозилазы и транспептидазы сменились на остатки D-молочной кислоты (D-Lac), что значительно понизило способность ванкомицина распознавать свою мишень. Резистентность к ванкомицину привела к появлению двух опасных штаммов: появились ванкомицинрезистентные энтерококки (VRE) и ванкомицинрезистентный золотистый стафилококк (VRSA). Они наряду с другими «супербактериями», устойчивыми к действию других антибиотиков, являются причиной около 25 000 случаев смерти из всех ежегодно регистрируемых в США. Правда, какая доля из этих 25 тысяч происходит по вине микроорганизмов, устойчивых именно к ванкомицину, выяснить довольно сложно.
Для решения проблемы резистентности, связанной с появлением у ферментов, отвечающих за синтез клеточных стенок бактерий, N-концевой группы D-Lac, ученые из группы Дейла Боджера (Dale Boger), работающие в Научно-исследовательском институте Скриппс, решили синтезировать модификацию ванкомицина, нацеленную сразу на две молекулярные мишени и, таким образом, обладающую двойным действием. Предполагалось, что эта версия антибиотика (ванкомицин 2.0) будет способна связываться и с нормальными ферментами, последовательность которых оканчивается фрагментом D-Ala, и с их мутировавшими аналогами, на N-конце которых локализован остаток D-Lac. Антибиотик, обладающий двойным действием и способный связываться с обеими версиями трансгликозилазы и транспептидазы, был получен в 2011 году (см. Xie J. et al., 2011. A redesigned vancomycin engineered for dual D-Ala-D-ala And D-Ala-D-Lac binding exhibits potent antimicrobial activity against vancomycin-resistant). Параллельно и независимо от группы Боджера способы борьбы с ванкомицинрезистентными штаммами разрабатывали и другие исследовательские группы — и они тоже достигли в этом успеха. Так, еще одно производное ванкомицина — оритаванцин — могло бороться с бактериями, обладающими «сверхспособностями», взаимодействуя непосредственно с фосфолипидной мембраной бактериальной клетки, изменяя ее надмолекулярную организацию. Такое взаимодействие разрыхляет мембрану клетки, делая ее более проницаемой и неспособной обеспечивать ее целостность (см. O. Domenech et al., 2009. Interactions of oritavancin, a new lipoglycopeptide derived from vancomycin, with phospholipid bilayers: Effect on membrane permeability and nanoscale lipid membrane organization).
В новом препарате (ванкомицине 3.0, см. рис. 2) Боджер с коллегами решил объединить сразу три оружия против резистентных бактерий:
1) способность блокировать работу нормальных трансгликозилазы и транспептидазы;
2) способность ингибировать строительство клеточных стенок мутировавшими ферментами;
3) способность разрыхлять клеточную мембрану супербактерии, делая ее органеллы более уязвимыми к действию веществ, находящихся снаружи клетки.
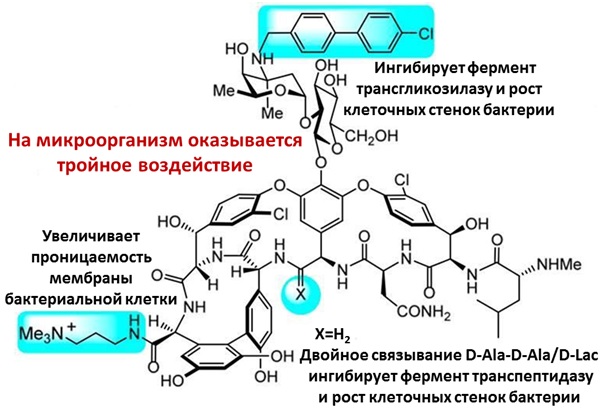
Рис. 2. Новый кандидат в антибиотики «последнего резерва» — «ванкомицин 3.0» — оказывает на патогенные организмы тройное действие, в результате чего проявляет большую противомикробную активность, а также не дает микроорганизму выработать резистентность к своему действию. Рисунок из обсуждаемой статьи в PNAS
Решить поставленную задачу удалось: оказалось, что новое вещество оказывает в 10 000 раз более сильное действие на ванкомицинрезистентные энтерококки по сравнению с ванкомицином 1.0. Кроме того, оно в 250 раз мощнее оритаванцина. Судя по косвенным данным, ванкомицин 3.0 также примерно в 250 раз эффективнее таких антибиотиков, как далбаванцин и телаванцин (см. Telavancin), но прямых экспериментальных доказательств этого факта пока еще не получено. Столь высокая эффективность нового препарата, по всей видимости, обеспечивается тем, что в новом препарате Боджер с коллегами решил объединить сразу три оружия против резистентных бактерий. Ванкомицин 3.0 способен разрушать клеточные стенки, а также препятствовать их росту, ингибируя действие ферментов трансгликозилазы и транспептидазы.
Правда, момента появления ванкомицина 3.0 в аптеках и арсенале больниц пока придется подождать. Для начала Боджер планирует понизить число стадий, необходимых для синтеза нового антибиотика, ведь чем меньше этапов нужно пройти в синтезе фармацевтически активного препарата, тем меньше его себестоимость. Также необходимы испытания нового антибиотика на лабораторных животных, а затем и на людях-добровольцах. В том случае, если все эти планы удастся реализовать, последняя линия обороны человечества от опасных инфекций значительно укрепится.
Источник: Akinori Okanoa, Nicholas A. Isleya, Dale L. Boger. Peripheral modifications of [Ψ[CH2NH]Tpg4]vancomycin with added synergistic mechanisms of action provide durable and potent antibiotics // PNAS. 2017. DOI: 10.1073/pnas.1704125114.
См. также:
Картинка дня Ванкомицин.
Аркадий Курамшин
-
Радует, что пока в гонке вооружений у нас есть ответы. А почему среди врачей и исследователей бактериофаги пользуются такой относительно низкой популярностью? Про них что-то мало слышно, хотя они могут быть альтернативой антибиотикам.
-
Два года назад я задала этот вопрос Константину Мирошникову (дхн, зав. лабораторией молекулярной биоинженерии Института биоорганической химии им. М. М. Шемякина и Ю. А. Овчинникова РАН). Он ответил так:
"Самое важное препятствие внедрения бактериофагов – экономическое. Бактериофаги – это природные организмы, их нельзя запатентовать. Фаговые препараты нуждаются в постоянной адаптации и обновлении состава. Всякий раз обновленный препарат нужно сертифицировать. Это слишком дорого, да и фагопрепарат в итоге устаревает, так как за время испытаний клиническая картина в мире успевает измениться. Показательный пример. В 2011 году произошла эпидемическая вспышка энтерогеморрагической кишечной палочки, множественно устойчивой к антибиотикам. Погибло больше 50 человек. После выявления возбудителя буквально через неделю три независимые научные группы – франко-бельгийская, швейцарская и грузинская – предложили подобранные из коллекций и протестированные на мышах фаговые составы, надежно уничтожающие именно этот штамм E. coli O104:H4. Но проведение всех положенных регламентных испытаний, составление документации и сертификация препарата потребовали бы миллионы евро, и испытания продолжались бы по сегодняшний день. Поэтому из ситуации европейские медики как могли выпутались с привлечением антибиотиков реанимационного резерва. Можно считать этот случай сигналом на будущее.
Кроме того, для успешной фаготерапии требуется очень точная диагностика бактериального патогена. Это очень важно и для антибиотиков, но не в такой степени. А вот неправильно подобранные фаги совершенно бесполезны."-
-
И чего? Врачам за спасибо работать? Без страха помереть, тем более будучи здоровым и пока гром не грянет, никто копейку не вложит. Без патентного права не будет и мед.компаний, желающих что-то разработать. Коммунизм и в медицине тоже - до добра не доведёт, будет стагнация и бактерии победят. Стоимость разработки нового препарата на 90% - это уйма тестов на отсутствие существенных побочных эффектов, так уже очень давно. Кто проделал эти тесты, тому и принадлежит "право". Почитайте, почти все препараты запрещены при беременности - это как раз по причине что на беременных их просто не успели дОлжным образом протестировать, а не фактически выявлено что-то плохое.
-
-
-
"неправильно подобранные фаги совершенно бесполезны."
Если они безвредны для людей наверно можно и не сертифицировать, написать на упаковке БАД и все.
-
1. Они привередливые. Антибиотику зачастую достаточно, чтобы бактерия была просто грамположительная, а бактериофагу вынь да положь конкретный род, вид и штамм. На текущем этапе развития практической медицины определять в каждом конкретном клиническом случае штамм и подобрать фаг очень дорого, долго и не очень надо, если есть антибиотики.
2. Бактерии быстро приобретают устойчивость к фагам. В случае ремиссии возбудитель уже может быть частично или полностью устойчивым к старому фагу и придется подбирать новый.
3. Нерентабельные. С учетом специфичности и быстрой «привыкаемости» к ним бактерий, придется производить огромное количество различных линий бактериофагов чтобы бороться с инфекциями «по-взрослому». Причем доехав до аптечного склада многие из них будут невостребованы или маловостребованы, а аптекам и клиническим лабораториям придется решать проблему их хранения и частого обновления. По сравнению с антибиотиками бактериофаги более скоропортящиеся. Они же живые.
4. In vivo vs. In vitro. При попытках лечения кишечных инфекций выяснилось, что штаммы фага могут эффективно армагедонить бактериальную культуру в чашке Петри и при этом не иметь лечебного эффекта в страдающем от этой же бактерии живом больном. По видимому, прохождение по ЖКТ действует на бактериофаги деморализующе.
Звучит как реклама туалетного утёнка :)
...Сколько ж стадий-то в цепочке? Цена вообще заоблачная должна быть сейчас у этого чуда 3.0...
-
А вообще статья порадовала. Надеюсь, что цена выступит достаточным сдерживающим фактором на пути промышленного использования данного антибиотика.
-
Если там свыше 30 стадий в синтетической цепочке, то даже снизив до 15, цену в 2 раза не уронить, ни то, что в 10. У меня в голове рисуются цифры в районе от 0.1 до 1 млн долларов за грамм. (Конечно, интервал в порядок - это ни о чём, это вангование; но кто может точнее - пусть скажет, я только за.) Ещё интересно, сколько надо на курс в оных граммах. Потому как если надо 100 мг на курс, то выйдет от 10 до 100 тыс. долларов, что уже подъёмно для более широкого круга пациентов. Ну а уж если 10 мг - то текст мой провисает и прошу его серьёзно не воспринимать...
== Надеюсь, что цена выступит достаточным сдерживающим фактором на пути промышленного использования данного антибиотика. ==
Простите за нескромный вопрос, Вы переживаете, что рано или поздно при классическом разгильдяйском подходе к антибиотикам наши маленькие друзья выработают к нему резистентность, что поставит под удар широкие слои больных? Или у Вас речь о кассовополноценных и кассовонеполноценных?-
Конечно, первое! Это можно проследить по истории с Полимиксином В, который являлся антибиотиком "последней линии обороны". Неграмотное и массовое использование антибиотика в китайском (возможно не только) животноводстве привело к образованию полирезистентных штаммов бактерий. В последствии, эти признаки были переданы посредством горизонтального переноса другим видам бактерий.
-
Химия - последняя линия обороны. Её, конечно, микробы сломают. Дело за биохимическими методами, за генетической модификацией клеток иммунной системы и т.п. Но этим методам надо войти в практику, а они пока только входят, хотя уже вышли за стены лабораторий. Антибиотики "последней линии обороны" - как бы отряд смертников, сдерживающий врага, пока идёт перегруппировка сил за его спиной. (Чёрт, пафосно получилось, сорри.)
-
-
-
Последние новости












Рис. 1. Структура антибиотика ванкомицина (синий), связанного со своей мишенью (красная) — конкретными аминокислотами в составе бактериальных ферментов, обеспечивающих синтез клеточной стенки (D-alanine-D-alanine peptide — пептид с двумя остатками аланина в D-форме). Несколько десятилетий ванкомицин помогал бороться с микроорганизмами, которые оказывались устойчивыми к другим антибиотикам. Однако со временем бактерии выработали резистентность и к нему, и сейчас разработан уже представитель третьего поколения его производных. О «ванкомицине 3.0» и рассказывается в этой заметке. Рисунок с сайта pdb101.rcsb.org