Перспективное лекарство против болезни Альцгеймера — компонент клеточной стенки бактерии сальмонеллы
Болезнь Альцгеймера связана с отложением агрегатов белка бета-амилоида в головном мозге человека. Одно из возможных направлений борьбы с этими отложениями — поиск веществ, стимулирующих фагоцитарную активность клеток микроглии — главного компонента иммунной защиты головного и спинного мозга, — то есть их способность поглощать чужеродные частицы, в том числе и амилоидный белок. Группа ученых из Канады, Бельгии и США предложила в качестве такого вещества монофосфорил-липид A (MPL) — модифицированный липополисахарид клеточной стенки бактерии Salmonella minnesota. Раствор MPL уменьшает количество и площадь амилоидных бляшек в мозгу трансгенных мышей и улучшает их способность к запоминанию.
Более 35 миллионов человек по всему миру живут с диагнозом «болезнь Альцгеймера». И хотя основным фактором риска является преклонный возраст, эту болезнь также диагностируют и у людей 30–40 лет. Из-за прогрессирующего ухудшения памяти и развивающегося слабоумия такие больные прикованы к госпиталям и домам престарелых, проживая остаток жизни без надежды на выздоровление.
Патогенез болезни Альцгеймера связан с накоплением нерастворимых бляшек β-амилоидных пептидов (см. Beta amyloid, amyloid β, Aβ) в тканях головного мозга, которое возникает из-за спонтанного нарушения баланса превращений предшественника бета-амилоида — белка, встроенного в клеточные мембраны нейронов.
Белок — предшественник амилоида (Amyloid precursor protein, APP) обнаружен во многих тканях организма, где он является нормальным трансмембранным белком, однако его функции до сих пор окончательно не установлены. В зависимости от доступности специфических участков молекулы белка для своеобразных белков-«ножниц» — ферментов секретаз (см. Secretase), APP может вступать на один из двух возможных путей преобразования — амилоидогенный или неамилоидогенный (см. обзорную статью Querfurth & LaFerla, 2010. Alzheimer's Disease). Оба пути характерны для нормальных клеток (рис. 1). Нас интересует амилоидогенное преобразование белка, поскольку неамилоидогенный путь, связанный с расщеплением белка ферментом α-секретазой, не может привести к образованию опасного для клеток амилоидного белка Aβ42, так как уже на первой стадии происходит расщепление внутри последовательности Aβ.
Амилоидогенное преобразование предшественника начинается с отщепления его внеклеточного фрагмента под действием фермента β-секретазы. Оставшийся фрагмент подвергается дальнейшему расщеплению γ-секретазой с образованием β-амилоида. β-амилоидные пептиды, состоящие из 36–43 аминокислот, являются естественными продуктами метаболизма; при этом в норме мономерных пептидов длиной 40 аминокислот образуется значительно больше, чем склонных к агрегации повреждающих более длинных пептидов (обычно их размер составляет 42 аминокислоты: Aβ42). Нарушение баланса между двумя путями преобразования APP, образованием, разрушением и агрегацией (слипанием) пептидов, приводит к накоплению Aβ42, что может стать пусковым фактором в развитии болезни.
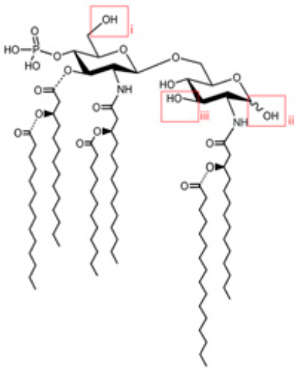
Рис. 2. Химическая структура производного клеточной стенки бактерии Salmonella minnesota — монофосфорил-липида A. Рисунок из обсуждаемой статьи в PNAS
Ученые из научно-исследовательского клинического центра Университета Лаваля (Квебек, Канада), совместно с коллегами из Бельгии и США предположили, что перспективным направлением поиска возможного лекарства против болезни Альцгеймера являются вещества, стимулирующие фагоцитарную активность клеток микроглии — главного компонента активной иммунной защиты головного и спинного мозга.
Характерная для многих типов иммунных клеток фагоцитарная активность, то есть способность клетки захватывать и перерабатывать твердые частицы (в том числе бактерии, вирусы, агрегированные белки), — это первая линия защиты от многих заболеваний. Ее можно стимулировать при помощи различных компонентов вирусов и бактерий. В клетках микроглии, как и в других клетках иммунной системы, есть специальные сенсоры молекул, характерных для патогенов, — так называемые Толл-подобные рецепторы (Toll-like receptors, TLRs). Когда в организм попадает патоген, клетки иммунной системы мобилизуются на защиту организма за счет активации этих рецепторов. Увеличение фагоцитарной активности микроглии важно также для защиты от агрегатов белка-амилоида, образующихся при болезни Альцгеймера.
К таким специфическим для патогенов молекул, по которым организм может распознать инфекцию и мобилизовать иммунную систему, относится липополисахарид (Lipopolysaccharide) — компонент клеточной стенки грамотрицательных бактерий (см. также: Bacterial cell walls). Проблема состоит в том, что липополисахарид патогенных бактерий может быть токсичным для организма человека. Поэтому авторы статьи решили использовать для стимуляции клеток микроглии безвредный химически модифицированный липополисахарид клеточной стенки бактерии Salmonella minnesota — монофосфорил-липида A (Monophosphoryl lipid A, MPL) (рис. 2).
В качестве модели, позволяющей изучать механизм отложения Aβ, в экспериментах in vivo использовалась линия трансгенных мышей с химерным белком (Chimeric protein) — предшественником амилоида. К 9 месяцам жизни в мозгу таких животных обнаруживается большое число бляшек β-амилоида, напоминающих те, что образуются в мозгу пациентов, страдающих болезнью Альцгеймера. Способность к запоминанию у таких мышей с возрастом снижается и ухудшается по сравнению с мышами, у которых в мозгу нет бляшек.
Результаты, полученные после инкубации клеток микроглии этой линии мышей с раствором MPL, подтвердили стимулирующее действие монофосфорил-липида A на фагоцитарную активность (рис. 3).

Рис. 3. MPL стимулирует фагоцитоз в клетках микроглии мыши. А — и MPL, и немодифицированный липополисахарид (LPS) стимулируют фагоцитоз флуоресцирующих бусин (Beads) Escherichia coli. B — внутриклеточная локализация этих гранул (зеленый) подтверждена данными конфокальной микроскопии. Длина масштабной линейки — 10 мкм. Рисунок из обсуждаемой статьи в PNAS
Для оценки эффективности MPL in vivo, трансгенным мышам из трех экспериментальных групп в течение длительного времени вводили растворы исследуемых веществ. Контрольной группе делали инъекции биологически нейтрального натрий-фосфатного буфера (Phosphate buffered saline, PBS), экспериментальным группам вводили растворы MPL или немодифицированного липополисахарида. Оказалось, что по сравнению с контрольной группой, которой вводили раствор натрий-фосфатного буфера, количество и общая площадь β-амилоидных бляшек в коре головного мозга мышей, которым был введен раствор MPL, значимо снижены (рис. 4). Кроме того, в отличие от исходного крайне токсичного липополисахарида сальмонеллы, инъекция MPL не приводила к развитию воспаления, опасного для жизни.

Рис. 4. Количество (D) и общая площадь (E) β-амилоидных бляшек в коре головного мозга мышей, которым был введен раствор MPL, найтрий-фосфатный буфер (PBS) или немодифицированный липополисахарид (LPS). На рисунке видно, что количество бляшек снижается после инъекции MPL. Интересно, что в случае немодифицированного липополисахарида наблюдается очень большой разброс значений. Рисунок из исходной статьи в PNAS
Результаты поведенческих тестов также показали значительные улучшения у животных показателей обучаемости и памяти по сравнению с контролем. Для определения способности мышей к запоминанию использовали водный T-образный лабиринт. В таком лабиринте животное должно выбрать между двумя рукавами, в одном из которых размещена невидимая платформа, на которую животное может залезть (мышь, попав в воду, стремится оказаться снова на суше). Авторы сначала «научили» мышь систематически выбирать левый рукав, в котором всё время находилась платформа. После этого оценивалось, сколько нужно попыток для того, чтобы мышь начала выбирать правый рукав, в который переместили платформу. Критерием обучения считали 5 правильных выборов подряд. Оказалось, что для трансгенных мышей, которых использовали в работе, нужно в среднем около 17 попыток, чтобы запомнить, что платформа находится в правом рукаве. При этом мышам, которым вводили MPL, было достаточно 10 попыток.
Результаты проведенной работы представляют монофосфорил-липид A как многообещающий препарат для безопасного и эффективного лечения болезни Альцгеймера.
Источник: Jean-Philippe Michauda, Maxime Hallé, Antoine Lampron, Peter Thériault, Paul Préfontaine, Mohammed Filali, Pascale Tribout-Jover, Anne-Marie Lanteigne, Rachel Jodoin, Christopher Cluff, Vincent Brichard, Rémi Palmantier, Anthony Pilorget, Daniel Larocque, and Serge Rivest. Toll-like receptor 4 stimulation with the detoxified ligand monophosphoryl lipid A improves Alzheimer's disease-related pathology. // Proc Natl Acad Sci USA. January 29, 2013. V. 110. No. 5. P. 1941–1946. Doi: 10.1073/pnas.1215165110.
Анастасия Горелова
-
Действительно, изучению функциональной роли белка-предшественника амилоида уделяется довольно много внимания. Однако на данный момент функции этого белка окончательно не установлены.
Вероятно, основные функции АРР в нормальных условиях - контроль роста, развития и миграции нейронов, в том числе поддержание структуры синапсов и участие в процессе межклеточной адгезии.
Подробнее о функциях АРР можно прочитать в отличном обзоре "Amyloid Precursor Protein Trafficking, Processing, and Function"
http://www.jbc.org/content/283/44/29615.long
http://www.infox.ru/science/human/2012/02/09/Lyekarstvo_ot_r
«Лекарство от рака вылечило мышей от Альцгеймера»
Писали, что после введения бексаротена (таргретина) у мышей через 6 часов уменьшилось количество бета-амилоида на 25%, а через 3 суток ещё на 50% и мыши стали вести себя как здоровые.
http://dx.doi.org/10.1126/science.1217697
Видео:
http://youtu.be/-ypZbFRMSAU
С этим как?
Что эффективнее?
-
На мой взгляд, методология описываемой в новости работы более правомочна, поскольку фактически ученые изучали процесс, который вполне вероятен и в физиологических условиях, ведь введение токсичного липополисахарида также приводило к уменьшению числа и общей площади амилоидных бляшек (однако вызывало очень сильный воспалительный ответ). Использовав модифицированный LPS, исследователи снизили проявления воспалительного ответа, однако эффект вещества на очищение амилоидных бляшек остался неизменным.
Важно, что механизм активации клеток микроглии в данном случае не зависит от вида животного - Толл-рецепторы есть и у мыши, и у человека; и те, и другие будут активироваться при введении липополисахарида (как интактного, токсичного, так и модифицированного).
При этом, в работе, которую Вы упомянули, исследователи опирались на достаточно частный механизм вычищения амилоидных бляшек под действием аполипопротеина Е. Слабым местом этого подхода, является то, что исследователи не учли наличие различий в аминокислотных последовательностях apoE у мышей и человека. Вполне возможно, что аполипопротеин Е у человека не так эффективен в отношении индукции фагоцитоза амилоида, как у мышей.
Что касается поведения, в критике упомянутой Вами статьи (http://www.sciencemag.org.sci-hub.org/content/335/6075/1447.long) приводится альтернативное объяснение улучшения поведения и памяти при введении бексаротена. Согласно ему, улучшение поведенческих показателей связано с тем, что препарат повышает чувствительность нервных клеток к инсулину, который влияет на показатели обучаемости. То есть эффект бексаротена на поведение, возможно, связан не столько с вычищением бляшек.
Таким образом, поскольку в обсуждаемой в новости работе использовался более общий фундаментальный подход, на мой взгляд, он имеет больше перспектив для будущего клинического применения.-
Мало чего понял из сказанного. :-)
Бексаротен, значит, довольно быстро (за 72 часа) и сильно (то ли на 50% то ли на 75%) уменьшил количество амилоидных бляшек.
При этом мыши стали вести себя как здоровые ("значительно улучшились мышление, обоняние и социальное поведение").
Но эти события, значит, возможно, не связаны?
Несмотря на то, что, как пишут, "улучшение сохранялось в течение как минимум трех месяцев после приема бексаротена"?
Не понятно ещё вот что: бексаротен, как я понял, препарат испытанный и вполне безопасный ("хорошо переносится и имеет минимум побочных эффектов"). Это вроде бы очень важно: людям его можно принимать.
Его до сих пор не пробовали испытывать на людях с болезнью Альцгеймера?-
Вы процитировали статью в Science, вот я и решила ответить Вам супер-серьезным языком :)
Да, вполне возможно, что и не связаны, а если и связаны - то косвенно. В одном из обзоров работы, о которой Вы говорите, даже пишут, что после 3х месяцев применения размер и количество амилоидных бляшек вернулось обратно к уровню контроля! И, опять же, непонятно почему и с чем это может быть связано. Так что здесь все очень неоднозначно...
На самом деле, исследования на токсичость для человека - чуть ли не первое, что проверяется. MPL, например, тоже считается безопасным и входит в состав вакцин против папилломавируса.
Бексаротен пробовали испытывать, но особенных успехов в клинических исследованиях не отмечено. Последняя статья о возможном применении бексаротена вышла в августе 2012. Хотя, кто знает, может быть уже начали получать потрясающие результаты, которые вот-вот опубликуют...
-
-
1. Предлагаемое лечение - это что-то вроде одноразовой очистки накопившихся отложений амилоидных бляшек? Т.е. процедуру нужно будет проводить с какой-то периодичностью?
2. Как я понял, лекарство мобилизует иммунную систему, в результате чего фагоциты начинают нападать на то, что обычно они не трогают. Нет ли здесь риска развития аутоиммунных заболеваний?
-
На данный момент сложно предсказать, будет ли представленный метод вообще введен в практику, поэтому говорить о непосредственном применении еще, конечно, рано.
Как и всегда, важен правильный подбор дозировки, поэтому в зависимости от поставленной цели (или, например, от стадии заболевания) можно решать, необходимо ли повторять процедуру, или нет.
И, да, здесь, безусловно, есть тонкость: подобрать дозировку, которая была бы эффективной, но не вызывала аутоиммунный процесс :)
Последние новости













Рис. 1. Пути преобразования белка-предшественника амилоида (APP). Рисунок из обзора Querfurth & LaFerla, 2010. Alzheimer's Disease