Приобретенный иммунитет у бактерий может быть связан с механизмами РНК-интерференции
Европейские ученые расшифровали один из этапов работы иммунной системы CRISPR у бактерий. Хотя эта система и широко распространена среди бактерий и архей, ее компоненты во многих случаях оказывались высокоспецифичными. Кроме того, ферменты, участвующие в оформлении иммунного ответа, были никак не связаны с другими участками бактериального метаболизма. Теперь ученые показали, что на одном из необходимых этапов работы CRISPR бактерии используют, во-первых, универсальный фермент РНКазу, а во-вторых, распространенный у эукариот механизм подготовки иммунного ответа, схожий с РНК-интерференцией. Таким образом, появилась возможность более содержательно интерпретировать происхождение и эволюцию иммунитета у бактерий.
Ученые всё основательнее погружаются в микро- или даже наножизнь, открывая всё новые механизмы ее функционирования. Каждый раз, обдумывая обсуждаемое исследование, не перестаешь удивляться полноте, многообразию и упорядоченности устройства жизни на том, недоступном обыденному восприятию, уровне. Между тем задачи, стоящие перед организмами любого масштабного уровня, более или менее общие — разнится лишь инструментарий.
Иногда для выполнения той или иной задачи используется универсальный набор инструментов, которыми владеют самые разные клетки или которые годятся для многих задач. Но чаще используется строго специфический набор для конкретной задачи. На уровне клеточных задач в качестве инструментов используются различные метаболические пути и связанные с ними ферменты. Нахождение универсальных клеточных инструментов всегда большая удача. Если таковые находятся, то можно рассуждать об их происхождении и эволюции, о важности решаемых с их помощью задач и т. д. Если же инструмент специфичный и нацелен на конкретную функцию у конкретной клетки, о его происхождении трудно заключить нечто определенное.
Новое исследование, представленное европейскими биохимиками из университетов Умео (Швеция), Вены (Австрия) и Вюрцбурга (Германия), связано с обсуждением именно таких универсальных инструментов клетки. Исследование посвящено расшифровке работы CRISPR-системы, которая призвана обеспечивать защиту от инфекции.
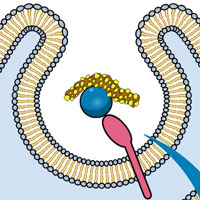
CRISPR (clustered regularly interspaced short palindromic repeats ) — это особые участки геномов бактерий и архей, занятые защитой от вирусных и плазмидных атак и выработкой иммунитета. «Элементы» уже обращались к этой теме (см. Бактерии наследуют приобретенный иммунитет, 21.01.2010), поэтому лишь кратко суммируем базовые положения. CRISPR-кассета представляет собой участок генома, на котором помещаются, во-первых, короткие палиндромные последовательности, во-вторых, кусочки последовательности вирусной ДНК/РНК, так называемые спейсеры, в-третьих — серия специфических белков-нуклеаз, именуемых «Cas-белки» (CRISPR associated proteins). Спейсеры и палиндромы строго чередуются, и эта цепочка, собственно, и называется CRISPR.
При проникновении вируса в клетку участок его ДНК/РНК копируется и вставляется в геном бактерии. Вставка этого нового спейсера происходит при участии Cas-белков. Потомки такой клетки будут нести в своем геноме данный вирусный спейсер. Участок генома, несущий вставленный спейсер, будет нормально считываться и производить в конечном итоге короткие РНК, включающие палиндром и этот спейсер. Если вирус снова попадет в клетку, то с помощью полученной короткой РНК произойдет распознавание чужеродного комплементарного фрагмента ДНК (или РНК), и клетка уничтожит нуклеотидную цепочку паразита. Последовательность CRISPR постоянно достраивается по мере инфицирования новыми вирусами, а спейсеры, которые долгое время не использовались, мутируют, выходят из употребления и исчезают из цепочки. Это своего рода динамичная система приобретенного иммунитета, останавливающая инфекцию на уровне транскрипции и, таким образом, обеспечивающая устойчивость клеток к вирусным инфекциям.
Сама задача, которую решает система CRISPR, — универсальна, а схема ее решения логически четкая, поэтому, казалось бы, и инструменты для ее выполнения должны быть более или менее единообразными у прокариот. Но в действительности ученые пока не могут похвастаться расшифровкой базовых принципов работы CRISPR. Так, лекция Ирены Артамоновой, посвященная CRISPR, была названа «Адаптивный иммунитет прокариот, основанный на crispr-системах: много вопросов и мало ответов». Один из важных вопросов связан с филогенией Cas-белков. Считается, что они обслуживают все операции и приобретения новых спейсеров и их успешное функционирование. Число Cas-белков в кассете очень различается у разных бактерий и архей: оно варьирует от 20 до 4. Они могут быть сходными по составу у разных семейств бактерий, а у других бактерий различаться даже в пределах одного штамма. Это говорит о том, что никакие из белков Cas или их отдельные домены не могут претендовать на звание универсального инструмента CRISPR-иммунитета. Возможно, никакого универсального инструмента и нет, и бактерии каждый раз изобретают нечто, подходящее случаю. Но также возможно, что искать следует другим способом и в другом месте.
Европейская команда исследовала CRISPR систему у бактерии Streptococcus pyogenes. У этой бактерии два CRISPR-комплекта, один из которых находится, по-видимому, в нерабочем состоянии. Рабочий, судя по последовательностям спейсеров, направлен на защиту от лизогенных (умеренных) фагов. В рабочей кассете помимо палиндромов и спейсеров имеются еще 4 гена Cas-белков. Все они вовлечены только в процесс работы CRISPR. Первичное считывание приводит к появлению цепочек РНК из 511 нуклеотидов. Это так называемый предшественник crispr-РНК, который именуется pre-crРНК. Потом эта длинная РНК нарезается на нужные фрагменты «палиндром—спейсер», так называемые crРНК, которые, собственно, и занимаются распознаванием фаговых последовательностей. Иными словами, происходит процесс созревания — превращение первичного транскрипта в рабочие фрагменты crРНК.

Однако, как выяснилось, при считывании pre-crРНК с CRISPR-кассеты появляется еще одна короткая РНК, прежде неизвестная участница CRISPR иммунитета. Ее последовательность расположена на противоположной цепочке ДНК немного впереди самой кассеты. Эта РНК в ходе созревания тоже нарезается определенным образом. Ученые назвали ее буквально «супротив-активируемая crРНК» (trans-activating CRISPR RNA или, коротко, tracrRNA). Она и стала главной героиней их научного сюжета.
Основная особенность обнаруженной tracrRNA — это наличие участка из 25 нуклеотидов, который комплементарен всем палиндромным повторам CRISPR. Это означает, что tracrRNA связываются с повторами, и этот процесс зачем-то необходим для образования рабочих crРНК. Подтвердить эту гипотезу удалось, создав бактерий, мутантных в области tracrRNA. У таких бактерий созревания crРНК не происходило. Если же к таким ущербным бактериям добавить нормальную tracrRNA, то процесс созревания возобновлялся, продуцируя нормальные crРНК. Очевидно, что tracrRNA, спариваясь с палиндромами, образует двухцепочечные фрагменты РНК, концы которой так или иначе определяют границы будущих crРНК.
И тут, естественно, нельзя не вспомнить, как происходит процесс РНК-интерференции у эукариот. Двухцепочечная вирусная РНК опознается ферментом Dicer, разрезается на фрагменты из 25 нуклеотидов, двойная цепь фрагмента расплетается на одноцепочечные РНК. Затем одна из нитей — антисмысловая siРНК (siRNA) — прикрепляется к комплексу RISC. Эта конструкция находит чужеродные матричные РНК с участком, комплементарным ведущей siРНК. Спаривание двух нитей активизирует фермент, разрезающий чужеродную матричную РНК на куски. Фермент Dicer опознает только двухцепочечные РНК, и хотя РНК вирусов может состоять и из одной цепочки, всё равно в их жизненном цикле обязательно имеется двухцепочечная фаза.
В нашей CRISPR-системе тоже организуется двухцепочечная РНК из 24 нуклеотидов, но за счет наложения tracrRNA, которая имеется у запасливых Streptococcus pyogenes. Затем этот двухцепочечный комплект должен быть опознан эндонуклеазой. Фермента Dicer у бактерий нет — что же служит его бактериальным аналогом? Оказалось, что его роль выполняет бактериальная РНКаза III. Помогает ей один из Cas-белков — белок Csn1. Он заякоривает tracrRNA на длинной pre-crРНК, позволяя эндонуклеазе включиться в работу. РНКаза III весьма консервативна, не имеет специфической связи с CRISPR-системой и участвует во многих процессах, в частности обеспечивает созревание рибосомальной РНК. Здесь же этот фермент включился в оборонные мероприятия против фагов. Так что черты универсального инструмента, возможно, следует искать не среди Cas-белков, а анализируя общие черты РНК интерференции и CRISPR защиты, а также среди прочих инструментов для работы с РНК.

Таким образом, для успешной подготовки иммунной защиты бактерии необходимы tracrRNA, РНКаза III и Csn1. Два из них — tracrRNA и Csn1 — относятся к CRISPR системе, а один — неспецифический фермент для работы с РНК. tracrRNA вместе с Csn1 нашлись еще у пяти видов бактерий, но пока из-за недостатка данных трудно определить их реальную распространенность среди бактерий.
Источник: Elitza Deltcheva, Krzysztof Chylinski, Cynthia M. Sharma, Karine Gonzales, Yanjie Chao, Zaid A. Pirzada, Maria R. Eckert, Jörg Vogel, Emmanuelle Charpentier. CRISPR RNA maturation by trans-encoded small RNA and host factor RNase III // Nature. 2011. V. 471, P. 602–607.
Елена Наймарк
-
Елена, спасибо за интересную статью!
Кстати, если верить Blast-у, ВИЧ содержит дальнего родственника csn1. Возможно, это не случайно, ведь вирусу СПИД-а тоже нужно разрезать синтезированные ранее с его матрицы полипротеины на более мелкие функциональные белки. Может быть, даже его происхождение как-то связано со стрептококами?
CRISPR-Cas
-
 29.07.2025«Генетические ножницы»: прорыв или нет?Ирина Якутенко • Библиотека • «Троицкий вариант» №11(430), 2025
29.07.2025«Генетические ножницы»: прорыв или нет?Ирина Якутенко • Библиотека • «Троицкий вариант» №11(430), 2025 -
 18.06.2019Систему CRISPR можно использовать для аккуратного встраивания генов в нужное местоАлександр Марков • Новости науки
18.06.2019Систему CRISPR можно использовать для аккуратного встраивания генов в нужное местоАлександр Марков • Новости науки -
 13.07.2017Подведены итоги первого десятилетия изучения CRISPRЕлена Наймарк • Новости науки
13.07.2017Подведены итоги первого десятилетия изучения CRISPRЕлена Наймарк • Новости науки -
 22.07.2016Homo sapiens: работа над ошибкамиАлександр Панчин • Библиотека • «Популярная механика» №5, 2016
22.07.2016Homo sapiens: работа над ошибкамиАлександр Панчин • Библиотека • «Популярная механика» №5, 2016
-
 30.06.2016CRISPR/Cas-системыВера Мухина • Картинки дня
30.06.2016CRISPR/Cas-системыВера Мухина • Картинки дня
-
 18.04.2016Ученые выяснили, почему бактериофагам трудно бороться с иммунной системой бактерийАлександр Марков • Новости науки
18.04.2016Ученые выяснили, почему бактериофагам трудно бороться с иммунной системой бактерийАлександр Марков • Новости науки
-
 22.05.2015Мир победивших биотехнологийДенис Тулинов • Библиотека • «Популярная механика» №12, 2014
22.05.2015Мир победивших биотехнологийДенис Тулинов • Библиотека • «Популярная механика» №12, 2014
-
 07.12.2014Умные ножницы для ДНКДмитрий Джагаров • Библиотека • «Химия и жизнь» №7, 2014
07.12.2014Умные ножницы для ДНКДмитрий Джагаров • Библиотека • «Химия и жизнь» №7, 2014
-
 12.03.2013Прокариотическая система иммунитета поможет редактировать геномВера Башмакова • Новости науки
12.03.2013Прокариотическая система иммунитета поможет редактировать геномВера Башмакова • Новости науки
-
 06.04.2011Приобретенный иммунитет у бактерий может быть связан с механизмами РНК-интерференцииЕлена Наймарк • Новости науки
06.04.2011Приобретенный иммунитет у бактерий может быть связан с механизмами РНК-интерференцииЕлена Наймарк • Новости науки
Последние новости