CRISPR-Cas
-
 29.07.2025«Генетические ножницы»: прорыв или нет?Ирина Якутенко • Библиотека • «Троицкий вариант» №11(430), 2025
29.07.2025«Генетические ножницы»: прорыв или нет?Ирина Якутенко • Библиотека • «Троицкий вариант» №11(430), 2025
-
15.08.2022Эволюция генетического разнообразия бактерий направляется внутривидовой конкуренцией и гонкой вооружений с фагами

Эволюционный эксперимент показал, как совместное действие двух факторов — внутривидовой конкуренции и гонки вооружений с паразитами — направляет эволюцию внутривидового разнообразия у бактерий. Подтвердилась классическая гипотеза «убей победителя», согласно которой паразиты поддерживают разнообразие способов защиты у жертв, поражая особей с самым частым вариантом защиты.
Александр Марков • Новости науки
-
28.04.2022Две системы бактериального «иммунитета» помогают друг другу бороться с вирусами

Американские ученые показали, что системы CRISPR-Cas и рестрикции-модификации могут действовать сообща. Система рестрикции-модификации заточена на опознание вирусной ДНК по специфическим участкам и внесение разрезов в них. Работа эндонуклеаз рестрикции повышает эффективность системы CRISPR-Cas, облегчая подготовку маленьких кусочков вирусной ДНК для вставки в локус CRISPR.
Елизавета Минина • Новости науки
-
21.09.2021Системы типа CRISPR-Cas9 широко распространены и имеют множество вариантов

Американские генетики исследовали свойства и работу эндонуклеаз, родственных Cas9. Системы с участием этих эндонуклеаз функционируют примерно так же, как и CRISPR-Cas9, и в ней направляющая РНК тоже может менять таргетные участки. Такие комплексы «РНК + эндонуклеаза» чрезвычайно широко распространены у микроорганизмов, что указывает на их востребованность в работе генома.
Елена Наймарк • Новости науки
-
20.07.2021Методом редактирования оснований удалось вылечить модельные генетические заболевания у мышей и макак

Недавно группе американских исследователей удалось исправить мутацию в гене β-глобина, ответственную за развитие серповидноклеточной анемии, а другой международной группе ученых — создать мутантный вариант гена PCSK9, который снижает уровень липопротеинов низкой плотности. Обе работы используют модернизированные версии метода редактирования оснований ДНК.
Екатерина Грачева • Новости науки
-
09.12.2020Компоненты CRISPR/Cas9 для лечения рака доставили в опухоль с помощью липидных наночастиц

Исследователи показали, что систему точечного редактирования генома CRISPR/Cas9 можно использовать для направленного уничтожения раковых клеток. Для этого ее компоненты, настроенные на вырезание гена PLK1, помещали в липидные наночастицы, которые вводили мышам в опухоли. Терапия показала хорошие результаты против глиобластомы и аденокарциномы яичника, увеличивая продолжительность жизни мышей и сокращая размер опухолей.
Екатерина Грачева • Новости науки
-
 10.11.2020Генных дел мастерицыИрина Масулис • Библиотека • «Троицкий вариант» №21(315), 2020
10.11.2020Генных дел мастерицыИрина Масулис • Библиотека • «Троицкий вариант» №21(315), 2020
-
12.10.2020Нобелевская премия по химии — 2020

В этом году Нобелевская премия по химии присуждена американке Дженнифер Дудне и француженке Эммануэль Шарпантье «за исследование метода редактирования генома». Они сыграли важнейшую роль в изучении CRISPR — природной системы приобретенного иммунитета у микроорганизмов, — доведя понимание о том, как она работает, до такой четкости, что смогли создать ее искусственный аналог, позволяющий выполнять операции над ДНК с поразительной точностью.
Елена Наймарк • Новости науки
-
29.10.2019Новый метод редактирования генома аккуратнее и эффективнее, чем CRISPR/Cas9

Ученые из Гарварда опубликовали описание нового подхода к редактированию генома, который позволяет делать любые однонуклеотидные замены и более крупные вставки и делеции, но отличается от классического CRISPR/Cas9-редактирования большей аккуратностью. Это стало возможным благодаря тому, что новый редактор обходится без двухцепочечных разрезов ДНК и самостоятельно достраивает редактируемую цепь.
Вера Мухина • Новости науки
-
 26.09.2019Глухоту можно вылечить до рожденияДенис Ребриков • Библиотека • «Коммерсантъ Наука» №33, август 2019
26.09.2019Глухоту можно вылечить до рожденияДенис Ребриков • Библиотека • «Коммерсантъ Наука» №33, август 2019
-
18.06.2019Систему CRISPR можно использовать для аккуратного встраивания генов в нужное место

Система CRISPR-Cas защищает бактерии и археи от вирусов и других генетических паразитов: фрагменты ДНК паразитов вставляются в геном хозяйской клетки и затем используются как образцы для поиска и уничтожения молекул ДНК или РНК с такой же нуклеотидной последовательностью. Американские биологи обнаружили, что некоторые мобильные генетические элементы научились использовать эту систему в собственных интересах. Это исследование открывает перед генной инженерией новые заманчивые перспективы.
Александр Марков • Новости науки
-
 18.05.2019Исправленные детиВалериан Хуторецкий • Библиотека • «Химия и жизнь» №4, 2019
18.05.2019Исправленные детиВалериан Хуторецкий • Библиотека • «Химия и жизнь» №4, 2019
-
25.04.2019Программирование на ДНК

О революционных методах изменения ДНК, позволяющих программировать невиданные доселе признаки; о том, как приручить вирус и заставить его на себя работать; как поломать ген, починить ген, вставить новый ген и даже внедрить целый организм — всё это в лекции «Как программировать ДНК».
Максим Казарновский • Видеотека
-
22.02.2019CRISPR/Cas: как и зачем редактировать геномы
 Лекция состоялась 22 февраля 2019 года в московском парке Зарядье в рамках совместного проекта с «Курилкой Гутенберга». Биологи мечтают редактировать геном человека. Биоэтики бьются в истерике от предложений биологов. Отважные китайские родители записываются к местному генному инженеру «проапгрейдить» будущих детей. Что происходит в этом мире, трудно ли редактировать геномы и зачем это может быть нужно, рассказывает Анна Урум.Анна Урум • Видеотека
Лекция состоялась 22 февраля 2019 года в московском парке Зарядье в рамках совместного проекта с «Курилкой Гутенберга». Биологи мечтают редактировать геном человека. Биоэтики бьются в истерике от предложений биологов. Отважные китайские родители записываются к местному генному инженеру «проапгрейдить» будущих детей. Что происходит в этом мире, трудно ли редактировать геномы и зачем это может быть нужно, рассказывает Анна Урум.Анна Урум • Видеотека
-
 14.01.2019Трансгенные люди. Первый блин комомАлексей Дейкин • Библиотека • «Коммерсантъ Наука» №63(4), декабрь 2018
14.01.2019Трансгенные люди. Первый блин комомАлексей Дейкин • Библиотека • «Коммерсантъ Наука» №63(4), декабрь 2018
-
20.12.2018От бактериального иммунитета к геномному редактированию
 Лекция была прочитана 20 декабря 2018 года в Москве, в рамках совместного проекта Парка «Зарядье» и Сколтеха. Какова природа генетических болезней, и сможем ли мы лечить их в ближайшем будущем? Что такое система CRISPR-Cas, и как бактерии используют её для борьбы с вирусами? Как изучение этого необычного механизма привело к созданию мощного инструмента геномного редактирования? Молекулярный биолог Константин Северинов отвечает на эти и другие вопросы, а также подробно рассказывает о недавнем эксперименте китайского ученого Хэ Цзянькуя по клонированию генно-модифицированных близнецов, затрагивая вопрос этичности проведения подобных опытов.Константин Северинов • Видеотека
Лекция была прочитана 20 декабря 2018 года в Москве, в рамках совместного проекта Парка «Зарядье» и Сколтеха. Какова природа генетических болезней, и сможем ли мы лечить их в ближайшем будущем? Что такое система CRISPR-Cas, и как бактерии используют её для борьбы с вирусами? Как изучение этого необычного механизма привело к созданию мощного инструмента геномного редактирования? Молекулярный биолог Константин Северинов отвечает на эти и другие вопросы, а также подробно рассказывает о недавнем эксперименте китайского ученого Хэ Цзянькуя по клонированию генно-модифицированных близнецов, затрагивая вопрос этичности проведения подобных опытов.Константин Северинов • Видеотека
-
 03.09.2018CRISPR: битва титанов и новая надеждаЕлена Клещенко • Библиотека • «Химия и жизнь» №7, 2018
03.09.2018CRISPR: битва титанов и новая надеждаЕлена Клещенко • Библиотека • «Химия и жизнь» №7, 2018
-
 10.05.2018«Редакторы геномов». От «цинковых пальцев» до CRISPRВалентин Власов, Сергей Медведев, Сурен Закиян • Библиотека • «Наука из первых рук» №2(56), 2014
10.05.2018«Редакторы геномов». От «цинковых пальцев» до CRISPRВалентин Власов, Сергей Медведев, Сурен Закиян • Библиотека • «Наука из первых рук» №2(56), 2014
-
06.12.2017Систему CRISPR-CAS9 удалось заснять в действии

Несмотря на уже более чем десятилетнюю историю изучения системы CRISPR-Cas и применения ее для редактирования генома, до сих пор никто не наблюдал ее за работой. Японские ученые устранили этот пробел и первыми в мире получили видео этого процесса, используя высокоскоростной атомно-силовой микроскоп. При этом выяснилось, что элементы системы связываются с молекулами ДНК не так, как считалось ранее.
Анастасия Пашутова • Новости науки
-
 07.11.2017CRISPR/Cas против болезни ГентингтонаТуяна Маланханова, Сурен Закиян • Библиотека • «Наука из первых рук» №4(75), 2017
07.11.2017CRISPR/Cas против болезни ГентингтонаТуяна Маланханова, Сурен Закиян • Библиотека • «Наука из первых рук» №4(75), 2017
-
31.10.2017Методом искусственной эволюции создан новый фермент для редактирования геномов
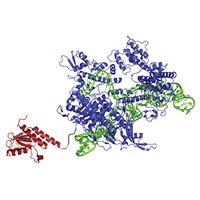
Методы редактирования геномов, разработанные на основе системы CRISPR-Cas, предполагают разрезание обеих цепей геномной ДНК с последующей починкой двойных разрывов, что чревато ошибками. Биоинженеры из Гарвардского университета при помощи искусственной эволюции создали аденозиндезаминазу, которая может работать с ДНК. Благодаря этому резко расширились возможности «редактирования оснований» — химической модификации нуклеотидов без создания двойных разрывов.
Александр Марков • Новости науки
-
13.07.2017Подведены итоги первого десятилетия изучения CRISPR

10 лет назад было доказано наличие приобретенного иммунитета у прокариот и продемонстрирована его работа на основе транскриптов CRISPR. За это десятилетие приобретенный иммунитет бактерий и архей из разряда экзотических явлений в мире микробов перешел в их неотъемлемые свойства.
Елена Наймарк • Новости науки
-
03.11.2016Змеи потеряли ноги из-за выключения гена Sonic hedgehog

Сразу два коллектива авторов из США опубликовали исследования, посвященные интригующему вопросу утраты конечностей змеями. Оказалось, что эволюция змей сопровождалась существенными изменениями в высококонсервативном регуляторном участке, отвечающем за включение экспрессии гена SHH (Sonic hedgehog). Эксперименты по редактированию генома мыши позволили получить убедительные свидетельства в пользу рассматриваемой гипотезы.
Татьяна Романовская • Новости науки
-
 22.07.2016Homo sapiens: работа над ошибкамиАлександр Панчин • Библиотека • «Популярная механика» №5, 2016
22.07.2016Homo sapiens: работа над ошибкамиАлександр Панчин • Библиотека • «Популярная механика» №5, 2016
-
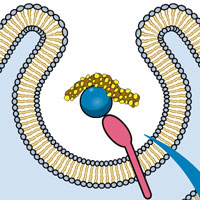
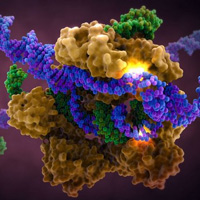 30.06.2016CRISPR/Cas-системыВера Мухина • Картинки дня
30.06.2016CRISPR/Cas-системыВера Мухина • Картинки дня
-
18.04.2016Ученые выяснили, почему бактериофагам трудно бороться с иммунной системой бактерий

Эффективность системы наследуемого приобретенного иммунитета CRISPR-Cas, широко распространенная у прокариот, обеспечивается тем, что благодаря ее работе разные бактерии учатся распознавать вирус по разным участкам его генома. В результате способы защиты бактерий от данного вируса становятся настолько разнообразными, что никакие точечные мутации уже не помогают вирусам эффективно приспособиться к коллективной обороне жертв. Это способствует эволюции специальных вирусных генов, подавляющих работу системы CRISPR в целом, а бактерии отвечают на это эволюцией новых вариантов системы CRISPR.
Александр Марков • Новости науки
-
 22.05.2015Мир победивших биотехнологийДенис Тулинов • Библиотека • «Популярная механика» №12, 2014
22.05.2015Мир победивших биотехнологийДенис Тулинов • Библиотека • «Популярная механика» №12, 2014
-
 07.12.2014Умные ножницы для ДНКДмитрий Джагаров • Библиотека • «Химия и жизнь» №7, 2014
07.12.2014Умные ножницы для ДНКДмитрий Джагаров • Библиотека • «Химия и жизнь» №7, 2014
-
12.03.2013Прокариотическая система иммунитета поможет редактировать геном

Хотя прокариоты — это одни из самых просто организованных существ на Земле (проще устроены только вирусы), их устройство поражает своим изяществом и совершенством. Недавно в научном мире буквально совершило переворот открытие прокариотических CRISPR-систем, которые обеспечивают приобретенный иммунитет к вирусам и плазмидам. О работе этих систем и о том, что их изучение может дать человечеству, рассказал Константин Северинов.
Вера Башмакова • Новости науки
-
06.04.2011Приобретенный иммунитет у бактерий может быть связан с механизмами РНК-интерференции
Европейские ученые расшифровали один из необходимых этапов работы иммунной системы CRISPR у бактерий. На этом этапе бактерии используют универсальный фермент РНКазу, а также распространенный у эукариот механизм подготовки иммунного ответа, схожий с РНК-интерференцией. Таким образом, появилась возможность более содержательно интерпретировать происхождение и эволюцию иммунитета у бактерий.
Елена Наймарк • Новости науки
Последние новости


Картинка дня


