Первое стабильное соединение гелия

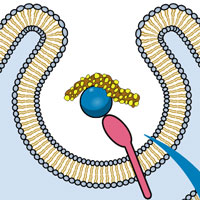
Перед вами — модель молекулы Na2He, первого стабильного соединения гелия. При высоком давлении гелий (зеленые кубы) формирует стабильное соединение с двумя атомами натрия (фиолетовые шары). Эта молекула — электрид, то есть она положительно заряжена и ее противоионами являются электроны (красные октаэдры).
Исторически атомы, расположенные в самой правой колонке таблицы Менделеева (гелий He, неон Ne, аргон Ar, криптон Kr, ксенон Xe, радон Ra) называют атомами «благородных газов». Название повелось с тех далеких пор, когда обнаружили, что эти атомы (точнее газы, состоящие из этих атомов) не образуют стабильных химических соединений. У них полностью заполнена оболочка валентных электронов, и им на первый взгляд незачем делиться электронами с другими атомами и нет места принять электроны извне. Иначе говоря, им энергетически невыгодно образовывать химические связи.
Однако довольно быстро стало ясно, что при определенных условиях и с определенными атомами благородные газы можно заставить создать стабильные соединения. Первым в 1962 году пал ксенон, из которого удалось создать дифторид (XeF2) и тетрафторид ксенона (XeF4). Дифторид ксенона используется в органическом синтезе как сильный фторирующий агент, да и у тетрафторида хватает применений. Вслед за ксеноном пали криптон и аргон.
Неон и гелий же не сдавались. Особенно гелий, из которого удавалось получать лишь гиперреактивные короткоживущие соединения, самое известное из которых гидрид гелия HeH+. Другой тип соединений гелия — молекулы, например He@C60 (см. «Сухая вода» помогла измерить поляризацию ковалентных связей, «Элементы», 02.11.2016), в которых гелий связан слабыми связями Ван-дер-Ваальса и не влияет на электронное строение. Энергия ионизации (отрыва электрона) у гелия — самая высокая из всех атомов, так что к заполненной электронной оболочке не подступиться. Как же сломить сопротивление?
Группа Артёма Оганова из Сколтеха (Москва) и Университета Стoyни-Брук (США) c помощью разработанной ими программы USPEX (Universal Structure Predictor: Evolutionary Xtallography) рассчитала, что гелий способен создать стабильное соединение Na2He с натрием при высоком давлении (>113 ГПа). В коллаборации с группой из Нанкайского университета (Китай) им удалось подтвердить предсказание экспериментально. Синтез был произведен путем сжимания натрия с гелием алмазной наковальней.
Структуру установили с помощью двух независимых методов — спектроскопии Раманa и рентгеноструктурного анализа. Также выяснили, что вещество не проводит электричество и что виновен в этом гелий, не допускающий проход свободных электронов. Na2He имеет температуру плавления в три раза выше, чем чистый натрий — выше 1500 К при 140 ГПа (у Na 550 К при сходных условиях). Подобные соединения могут существовать в недрах Земли и других планет. Авторы предсказывают еще одно соединение — Na2HeO, — стабильное при давлении >15 ГПа, но экспериментально eгo пока не подтвердили.
Что ж, в учебники химии пора вносить соответствующие дополнения.
Рисунок с сайта cen.acs.org.
Григорий Молев
-
Да, пора вносить дополнения в учебники.
(Интересно, USPEX может проверить, стабильны ли мои стержни, о которых мы с тобой переписывались? И если да, то при каких условиях? Или всё же нерегулярная губка - карма.)-
Не вижу, почему бы им не быть стабильными. А программа Оганова важна в первую очередь для расчётов веществ под давлением. Для стабильных штук и "простое" DFT на первых порах подойдёт.
-
https://indicator.ru/article/2017/01/09/pravilnyj-rezultat-i
z-nepravilnyh-dannyh/
Разное люди говорят...
Один мой знакомый квантовик-затейник выразился аж так:"Я всегда говорил, что DFT - это бесовщина :-). Но, конечно, людям было приятно обсчитывать огромные молекулы и делать это быстро, а не сидеть сутками с унылыми точными методами над системами с десятком атомов."
Впрочем, как я понимаю, вполне на первых порах и DFT подойдёт (просто потом нужно будет причаститься и исповедаться :))
Программа Оганова: она ж может строить структуры из строительных блоков, исходя из давления (и др.), минимизируя энергию, она может работать с большим количеством атомов. Я так понимаю, она может взять стержень и посмотреть, не стоит ли его, такого красивого, пересобрать в губку, или, наоборот,- губку перестроить в стержень. Нарисовать стержень легко, а вот прикинуть, как что с чем будет соединяться в губке,- это мне не представляется лёгким делом.
В целом же говоря, в общем, ты прав: 0-ое приближение - лучше не мудрить.
-
-
Последние новости