Уникальный белок тихоходки защищает ДНК благодаря внутренней неупорядоченности

Тихоходки — малочисленный тип небольших животных, близкий к членистоногим. Тихоходки приобрели большую популярность не только благодаря необычному облику. Это одни из самых живучих организмов, демонстрирующие рекордную устойчивость к различным экстремальным воздействиям. Хотя крошечные животные не могут вести при таких условиях нормальную жизнь, они легко переносят огромные дозы ионизирующей радиации, высокие и низкие температуры, давление, высыхание, голод и многое другое. При этом они переходят в состоянии ангидробиоза, то есть глубокого покоя с потерей большей части воды. В основе живучести тихоходок — уникальные молекулярные адаптации, в том числе специфичные неупорядоченные белки. В новой статье, опубликованной в журнале Scientific Reports, исследователи из МФТИ, Объединенного центра ядерных исследований в Дубне и их коллеги использовали различные биофизические методы и описали структуру Dsup — ДНК- и РНК-связывающего белка тихоходки Ramazzottius varieornatus. Он ожидаемо оказался лишен фиксированной структуры и функционирует в виде ансамбля различных трехмерных форм. Комплекс Dsup и ДНК также изменчив, что придает белку способность защищать организм от радиации, активных форм кислорода и других опасных факторов.
Среди самых устойчивых к неблагоприятным факторам живых существ выделяются тихоходки (Tardigrada). Представители небольшого типа Tardigrada близки к членистоногим (Arthropoda) и онихофорам Onychophora: они тоже имеют сегментированное тело, однако выделяются мелкими размерами (0,5 миллиметра и менее в длину) и уникальным строением тела. Каждый из восьми его сегментов несет пару коротких толстых конечностей без суставов, а общие очертания и неспешная походка придает тихоходкам облик микроскопического медвежонка. Это отражено в названии животных на английском (water bears) и немецком языках (Wasserbären) — они буквально означают «водный медведь». Необычные животные освоили самые разные среды жизни, обитая на суше (зачастую на мхах и лишайниках), в почве, пресных водоемах и даже морях на большой глубине (R. Trokhymchuk, A. Kieneke, 2024. Novel distribution records of marine Tardigrada from abyssal sediments of the Northwest Atlantic Ocean). Большинство тихоходок питается растениями, высасывая их сок с помощью заостренного выроста ротового аппарата (Укорочение тела тихоходок связано с потерей Hox-генов, «Элементы», 04.03.2016).
При неблагоприятных условиях тихоходки втягивают короткие ножки и приобретают форму бочонка, почти полностью теряют воду и останавливают метаболические процессы. В этом состоянии ангидробиоза им, кажется, ничто не страшно. Тихоходки выдерживают замораживание до температуры, близкой к абсолютному нулю (около −273 °C), в течение нескольких минут выносят нагрев до 150 градусов, давление в несколько раз больше чем на дне океанических желобов, высокий уровень ионизирующего излучения и другие истязания ученых. Кульминацией живучести этих животных стали эксперименты на околоземной орбите, когда тихоходки видов Richtersius coronifer и Milnesium tardigradum до 10 дней подвергались действию космического вакуума и радиации. В большинстве опытов животные выживали и после выхода из ангидробиоза успешно размножались.
Однако тихоходок нельзя назвать по-настоящему экстремофильными — приспособленными к постоянной жизни в неблагоприятных условиях — животными. Как, скажем, «железная улитка» Chrysomallon squamiferum (обитатель вод у черных курильщиков) или рачки артемии, населяющие даже очень соленые воды. Тихоходки способны лишь временно перейти в ангидробиоз и переждать (подчас довольно долгие) «тяжелые времена». Чтобы вернуться к нормальной жизнедеятельности, развиваться и размножаться, животное должно сперва попасть в более благоприятную среду.
Разумеется, в основе потрясающей живучести тихоходок лежат особые адаптации на молекулярном уровне, которые отличаются у различных видов типа (S. Galas et al., 2024. A comparative ultrastructure study of the tardigrade Ramazzottius varieornatus in the hydrated state, after desiccation and during the process of rehydration). Скажем, Hypsibius exemplaris имеет специализированные внеклеточные структуры, тогда как у представителя того же класса Eutardigrada Ramazzottius varieornatus (рис. 1) их не обнаружили. Зато у R. varieornatus описали так называемые уникальные белки тихоходок TDP (по-английски tardigrade-unique disordered proteins) — семейства сохраняющих растворимость после кипячения белков (S. Tanaka et al., 2015. Novel Mitochondria-Targeted Heat-Soluble Proteins Identified in the Anhydrobiotic Tardigrade Improve Osmotic Tolerance of Human Cells). Это локализованные главным образом в цитоплазме белки CAHS (cytosolic-abundant heat soluble), в митохондриях — белки MAHS (mitochondrial-abundant heat soluble), секреторные белки SAHS, а также белок Dsup. Эти молекулы стали объектами многих исследований, поскольку помогают понять фундаментальные механизмы адаптации к стрессу и очень перспективны для практического использования.
Специфические белки тихоходок относятся к внутренне неупорядоченным (см. intrinsically disordered proteins). Большинство белковых молекул в «рабочем» состоянии имеют четко фиксированную структуру с заданным взаиморасположением разных частей. Их трехмерная форма (конформация) определяется первичной структурой, то есть последовательностью аминокислот, что позволяет ее успешно предсказывать с помощью алгоритмов ИИ. Сейчас на этом поприще лидирует программа AlphaFold2, за которую совсем недавно присудили Нобелевскую премию по химии (см. Нобелевская премия по химии — 2024, «Элементы», 19.10.2024). У неупорядоченных белков все иначе: им нельзя приписать строго заданную конформацию, так как они существуют в виде ансамбля из множества структур. Что не мешает им выполнять многие биологические функции в самых разных организмах. Ряд внутренне неупорядоченных белков переходят в состояние с заданной стабильной формой, когда связывают лиганды (другие молекулы различной химической природы, рис. 2).
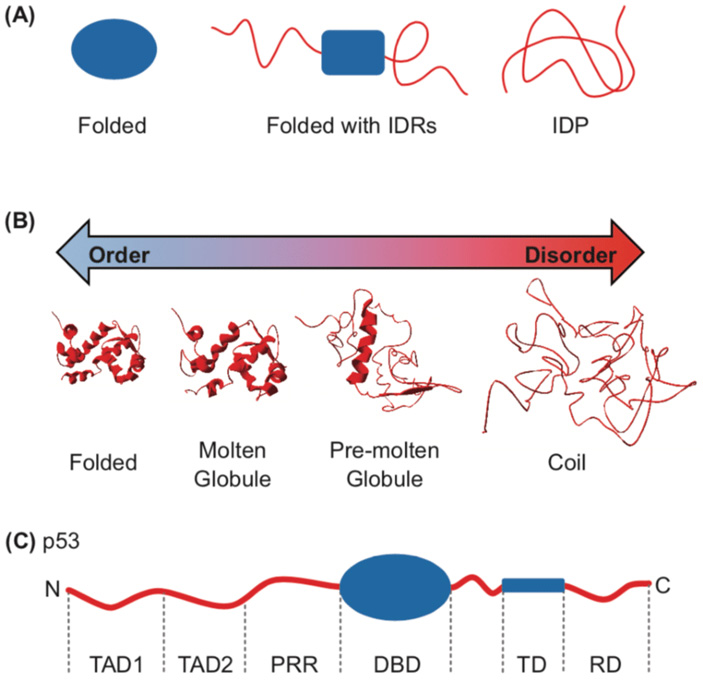
Рис. 2. Отличия обычных белков с фиксированной структурой (слева) от внутренне неупорядоченных белков (справа). (A): folded — свернутый белок с фиксированной конформацией, folded with IDRs — белок с неупорядоченной частью, IDP — полностью неупорядоченный белок. (B): molten globule — расплавленная глобула (белок имеет фиксированную часть), pre-molten globule — предрасплавленная глобула с большей неупорядоченной частью, coil — случайный клубок, полностью неупорядоченная форма. (C): частично упорядоченный белок на примере p53. Подписаны названия доменов. Рисунок из статьи M. Watson, K. Stott, 2019. Disordered domains in chromatin-binding proteins
Авторы новой статьи — ученые из МФТИ, ОИЯИ (Дубна) и ИБП РАН (Пущино), — заинтересовались структурой Dsup, одного из специфических белков тихоходок. Dsup — damage suppressor protein (подавляющий повреждения белок) — был открыт у R. varieornatus в 2016 году как молекула, которая защищает ДНК от активных форм кислорода (АФК), в том числе генерируемых радиацией. Его единственный известный ортолог (Dsup-подобный белок) обнаружили у другой тихоходки — Hypsibius exemplaris. Dsup состоит из 445 аминокислотных остатков при молекулярной массе 42,8 килодальтона, хорошо растворим в воде (гидрофилен) и имеет суммарный положительный заряд за счет соответствующих аминокислот. Электростатические свойства помогают молекуле связывать ДНК, несущую множество отрицательных зарядов на остатках фосфатов. Известно, что помимо ДНК белок связывается с другой нуклеиновой кислотой — РНК. Последовательность Dsup имеет сигнал ядерной локализации, необходимых для направленного транспорта в ядро клетки. Выполненные ранее с использованием разных алгоритмов работы биоинформатиков предсказали, что белок является внутренне неупорядоченным.
Новая статья помимо анализа последовательности использовала экспериментальный подход, а именно методы биофизики — малоугловое рентгеновское рассеяние (small-angle X-ray scattering), спектроскопию кругового дихроизма и молекулярное моделирование. Для начала ученые проанализировали аминокислотную последовательность Dsup. Рассмотрели распределение по ней электростатических зарядов, гидрофобности, а также распределение отдельных аминокислот (рис. 3). Несколько использованных алгоритмов сошлись на том, что белок является неупорядоченным. Согласно их оценкам, фиксированной структуры лишены 79–100% последовательности Dsup. При этом упорядоченная часть белка предсказана в центре (остатки 142–209), — это сравнительно гидрофобная область с меньшей долей аминокислот, которые нарушают упорядоченную структуру белков.

Рис. 3. Анализ последовательности белка Dsup. a — распределение заряда по аминокислотным остаткам (слева N-конец, справа C-конец), b — распределение гидрофобности. Предполагаемые упорядоченные области отмечены бледно-оранжевыми вертикальными полосами. Изображение из обсуждаемой статьи
Известно, что ряд аминокислотных остатков делают белок стабильнее, тогда как другие снижают стабильность молекулы из-за своих структуры, заряда и гидрофобности (расположены в соответствующем порядке на рис. 4). В последовательности Dsup также мало потенциальных сайтов фосфорилирования — посттрансляционных модификаций, состоящих в присоединении остатков фосфата. Фосфорилирование характерно для внутренне неупорядоченных белков и позволяет регулировать их функции. Между тем обе концевые области последовательности Dsup (N-конец и C-конец, см. рис. 3) предсказаны гидрофильными, имеющими положительный заряд, многочисленные сайты фосфорилирования и неупорядоченную структуру (рис. 4).

Рис. 4. Анализ склонности к неупорядоченности белка Dsup на основе последовательности. a — аминокислотный состав (красные столбики), полученный с помощью Composition Profiler. Различие в составе рассчитывается как дробь (Cx − Corder)/Corder, где Cx — содержание данной аминокислоты в белке Dsup, а Corder — ее содержание в стандартном наборе (Protein Databank Select). Аминокислотные остатки ранжированы от сильнее всего стабилизирующих фиксированную структуру до сильнее всего ее нарушающих. Положительные значения указывают на повышенную долю, а отрицательные — на пониженную долю конкретной аминокислоты. Для сравнения показан профиль для экспериментально подтвержденных неупорядоченных белков из базы данных DisProt (черные столбики). b — график Уверского («заряд—гидрофобность») для Dsup (синий), набора белков с фиксированной структурой (зеленый) и неупорядоченных белков (красный). c — склонность белка Dsup к неупорядоченности оценили с помощью платформы Rapid Intrinsic Disorder Analysis Online (RIDAO), которая иллюстрирует результаты разных программ: IU-Pred_short (желтая линия), IUPred_long (синяя линия), PONDR® VL3 (зеленая линия), PONDR® VLXT (черная линия), PONDR® VSL2 (красная линия) и PONDR® FIT (розовая линия). Рассчитана средняя оценка склонности к неупорядоченности для каждого остатка на их основе (программа MDP, толстая лиловая пунктирная линия). Тонкая черная линия на уровне 0,5 — это порог между упорядоченностью и неупорядоченностью: отдельные остатки или области с баллами беспорядка выше 0,5 считают неупорядоченными, ниже 0,5 —- упорядоченными. Пунктирная линия на уровне 0,15 — порог гибкости: остатки/области с оценкой выше 0,15 являются гибкими, а остатки/регионы с оценкой ниже 0,15 — высоко упорядоченными. Изображение из обсуждаемой статьи
Выводы «сухой биологии» уверенно подтвердили эксперименты — рентгеноструктурный анализ и круговой дихроизм. В деионизированной воде и натрий-фосфатном буфере (PBS), близком к внутренней среде клетки, неупорядоченную форму имеют 62–66% молекулы Dsup. Согласно спектроскопии кругового дихроизма (которая «видит» блоки вторичной структуры белка), Dsup содержит около пяти процентов альфа-спиралей. Вероятно, также присутствуют бета-слои, однако метод в этом случае не позволяет точно оценить их долю из-за склонности белка к жидкостному разделению фаз (подробнее о явлении читайте см. новость Фибриллы тау-белка при болезни Альцгеймера формируются из «белковых капель», «Элементы», 02.08.2024). В присутствии мочевины (сильный денатурирующий агент) молекула Dsup меняет структуру и увеличивает объем. Далее использовали трифторэтанол — реагент, стимулирующий образование альфа-спиралей, — который вызвал характерный эффект и у изученного неупорядоченного белка.
Малоугловое рентгеновское рассеяние описало общую форму и размер Dsup в различных растворах. В каждом случае белок выглядел вытянутым и палочковидным. Его длина в PBS составила около 200 ангстрем при ширине 80, в лишенной ионов воде белок имел размер 270 на 80 ангстрем. В растворе молекулы Dsup существуют главным образом в виде мономеров (рис. 5). Экспериментально полученный на основе SAXS радиус инерции (radius of gyration, Rg) — мера распределения массы вокруг оси, — был равен ~53–60 ангстрем. Что близко к оценке, полученной ранее с помощью молекулярной динамики (55–70 ангстрем). Далее метод ансамблевой оптимизации (ensemble optimization method) показал, что распределение значений радиуса инерции бимодально, то есть имеет два пика, которые соответствуют примерно 50 и 100 ангстремам. Вероятно, они описывают две главные разновидности конформаций Dsup — компактную и расширенную. Та же ансамблевая оптимизация подыскала ряд конформаций, которые лучше всего объясняют данные рентгеноструктурного анализа. Оказалось, что белок Dsup чрезвычайно гибок и, по-видимому, постоянно вступает в короткие взаимодействия — как с самим собой (разными частями молекулы), так и с другими соединениями.
Поскольку Dsup связывает нуклеиновые кислоты, с помощью спектроскопии кругового дихроизма авторы отдельно описали структуру соответствующего комплекса. Его получили в смеси Dsup с ДНК в виде плазмид (в молярной пропорции 64:1). Не удалось наблюдать переход комплекса Dsup•ДНК из неупорядоченного состояния в упорядоченное, а также приобретение белком в его составе постоянной структуры. Поэтому такой комплекс, подобно самому белку, отнесли к имеющим нечеткую структуру («fuzzy complex»). Это означает, что ДНК и белок в нем связываются не конкретными участками (сайтами узнавания) с заданной последовательностью, а вступают в разные неспецифичные и короткие взаимодействия. Это особый способ взаимодействия молекул, который может регулироваться фосфорилированием и другими посттрансляционными модификации, а также изменениями вторичной структуры белка. Предпосылки к этому в структуре Dsup как раз описаны в новой работе.

Рис. 5. Трехмерная модель белка Dsup в PBS (a) и деионизированной воде (b). Серым показана усредненная структура, реконструированная по данным SAXS с помощью программ DAMMIF и DAMAVER. Красным — модель структуры Dsup, полученная с помощью программы I-TASSER51. Изображение из обсуждаемой статьи
Точные клеточные функции белка Dsup и механизмы, за счет которых он защищает ДНК от радиации и АФК, пока не установлены. Однако теперь благодаря экспериментам in vitro известно, что белок неплотно контактирует с нуклеиновой кислотой и служит «щитом», который закрывает ее собой от воздействия негативных факторов. Вероятно, запланированные дальнейшие работы по изучению комплекса Dsup с ДНК ответят на многие вопросы. Так или иначе, уникальный белок тихоходки продолжает поставлять новую информацию о механизмах стресса и адаптации к нему. Помимо значения для фундаментальной биологии, он также имеет большие перспективы практического использования. С помощью введения трансгенного Dsup ученые уже смогли придать устойчивость к радиации культивируемым клеткам человека HEK293T, табаку Nicotiana tabacum и плодовой мушке Drosophila melanogaster. В будущем и при условии детального понимания специфической устойчивости тихоходки к радиации и окислительному стрессу он может быть использован в биотехнологии, медицине, космической биологии и других областях науки.
Источник: Mikhail Zarubin, Tatiana Murugova, Yury Ryzhykau, Oleksandr Ivankov, Vladimir N. Uversky & Elena Kravchenko. Structural study of the intrinsically disordered tardigrade damage suppressor protein (Dsup) and its complex with DNA // Scientific Reports. 2024. DOI: 10.1038/s41598-024-74335-2.
Михаил Орлов
-
Я знаю, где такое приспособление могла создать Эволюция: на комете!
Именно там:
то есть атмосфера с водой (при подлете к солнцу), то вакуум,
то +150 градусов, то -100500,
а уж радиации - воткни ложку, она стоять будет!
Непонятно на самом деле, где бы таких полезных для кометной жизни приспособлений - и здесь, на Земле, удалось Эволюционно набраться этим микромедведям.
Казалось бы, давно бы сто раз мутировали, потеряв эти свои чудесные умения выживать - за ненадобностью...-
а уж радиации - воткни ложку, она стоять будет!
Вам нужно снять лапшу с ушей (наверно Сурдин навешал).Средняя доза в межпланетном пространстве составляет около 0,5 миллигрей в сутки. В биологическом эквиваленте это около 2 миллизиверт. Примерно столько средний житель России получает за полгода, а экипаж Международной космической станции за 3-4 дня.
Высоко, но не смертельно. К тому же на поверхности космического тела уровень радиации падает вдвое, чисто геометрически.-
Э... Сурдин? Мне не известны Ваши с ним тёрки, сожалею. И он сам, и его поварские достижения в итальянской кухне.
Однако он похоже, сильно Вам насолил, если Вы готовы спорить с ним там, где его и в помине нет и о том, о чем речь здесь не шла.
Ведь ситуация на комете не подходит к Вашему с ним спору, ибо на комете - ну никак не может быть средняя по Вселенной доза)
Комета периодически далека от солнца, а периодически подлетает ого как близко. И тихоходке какой, если ей на комете сидеть, то о среднем речь вести не совсем уместно. Можно ведь так нахвататься радиации, пролетая близ звёзды, что улучшающая показатель "среднего" часть орбиты если даже вовсе без радиации (что выглядит гипотетично) - уже и не особо интересно. Ибо биомолекулы поломаны-переломаны, и хоть всю жизнь потом лети в свинцовом шаре - делу не поможет)
При этом у кометы нет магнитного поля, чтоб как-то отводить чувствительные к магнитному полю частицы.
Чисто геометрически)
А что касается "высоко, но не смертельно" - мысль моя об эволюции и мутациях, не о смерти. Смерти тихоходке я, поверьте, не желал и не прочил))-
ибо на комете - ну никак не может быть средняя по Вселенной доза)
В два раза меньше чем в среднем по вселенной из-за геометрии.И тихоходке какой, если ей на комете сидеть, то о среднем речь вести не совсем уместно. Можно ведь так нахвататься радиации, пролетая близ звёзды...
У звезды как раз меньше галактический радиационный фон который вносит большую часть дозы, а на удалении фон такой же как и межзвездной пространстве обусловленный в первую очередь заряженными частицами - ядрами водорода и гелия.
Магнитное поле Солнца отталкивает эти частицы - в каком то смысле обеспечиваю защиту от галактической радиации.А что касается "высоко, но не смертельно" - мысль моя об эволюции и мутациях, не о смерти.
Эволюция это и есть борьба со смертью иными словами выживание более приспособленного, если нет смерти то и эволюция не нужна.-
Хм.
Я, конечно, базируюсь только лишь на школьных знаниях, логике и интуиции, и потому очень озадачен мыслью, что на комете близ солнышка многажды безопаснее, чем какая-то наша современная бомбочка... И даже безопаснее рядом с солнцем, чем вдали от него!
У нас тут на Земле, на пляжах-то народ тоннами кремы против загара изводит, прыгая до потолка от радости, что атмосфера не весь ультрафиолет пропускает... А когда вспышка на солнце - по тв про северные сияния на юге пугают, а оказывается...
А рентген ведь ещё... Короче говоря, и альфа, и бета, и тебе гамма.
Хм, хм...
Как сказал в аналогичной ситуации один вдумчивый американец: "какие ваши доказательства!?"
)-
Как сказал в аналогичной ситуации один вдумчивый американец: "какие ваши доказательства!?"
Вдумчивый американец давно уже знает, что "Радиационный фон в межзвёздной среде оказался в 3-4 раза выше, чем внутри гелиосферы", потому что запустил туда зонды "Voyager-1" и "Voyager-2", а также множество аппаратов в установленными дозиметрами на борту.
https://habr.com/ru/companies/ruvds/articles/577754/
Вдумчивый россиянин продолжает вдумываться, поскольку ничего за пределы околоземной орбиты не может запустить.
https://www.atomic-energy.ru/news/2019/11/06/98833
-
-
-
-
-
-
Казалось бы, давно бы сто раз мутировали, потеряв эти свои чудесные умения выживать - за ненадобностью...
И как это тихоходки не утратили способность выживать при давлении большем, чем в Мариинской впадине? И где они такую способность могли на комете приобрести?-
Согласен. Такому на комете не научиться... Но что же тогда это за местечко, где такие таланты могут быть эволюционно закреплены??
Все же моя версия - об астероиде - объясняет "воспитание" существенной части тихоходкиных качеств.)
Где бы найти в природе, чтоб все тоже самое, да плюс давления скачки такие размашистые?
Гипотеза: вдруг белки, защищающие от холода, автоматически способны работать в колоссальном диапазоне давлений?
Может быть, там одинаковые механизмы какие действуют?
-
очень хорошую троицу обеспечили антирадиационной защитой!
Так и вижу грядущую тихую жизнь на дальних планетах, ну, которые без магнитного поля:
сидит, панимашь, этакий радиационно индифферентный мужичок на завалинке и курит трубочку, отмахиваясь от дрозофил.
А чё ещё надо-то?
)
-
Так и вижу грядущую тихую жизнь на дальних планетах, ну, которые без магнитного поля:
Уровень радиации там под открытым небом превышает уровень на МКС в 1.5-2 раза, а под крышей и того меньше.-
Как-то Вы, того... не рубите ли с плеча?
Подозреваю, что если вести речь даже только и исключительно о радиации солнечной - так она должна повышаться/снижаться по мере приближения к или удаления от Солнца в квадратичной зависимости. И потому на Меркурии она должна настолько отличаться от какого-нибудь спутника Юпитера, что разбег в полтора-два раза явно маловат...-
Подозреваю, что если вести речь даже только и исключительно о радиации солнечной
Основной вклад вносит галактическая радиация, интенсивность потоков которой падает при повышении солнечной активности. Разница межпланетного радиационного фона в зависимости от солнечной активности меняется в 2–3 раза - меньше в годы активного солнца! Если вести речь даже только и исключительно о радиации галактической, как основного источника, то на Меркурии она меньше, чем за пределами солнечной системы. Вблизи пульсара, разумеется радиация повышена, но это особенное место во вселенной.она должна повышаться/снижаться по мере приближения к или удаления от Солнца в квадратичной зависимости.
Так же как и равновесная температура - в солнечной короне тихоходки конечно поджарятся и умрут, совсем не от радиации. -
Рубит. Это кажется проповедник альтернативных идей. Рядом с солнышком конечно меньше тяжелых ионов, которые в основном галактического происхождения, но протонов намного больше (они если не вру, солнечные в основном в окрестностях солнца), больше рентгена, а уж если брать приповерхностные слои, то нужно учитывать вакуумный ультрафиолет, который тоже ионизирующая радиация, да еще какая, и источник его солнце даже на нашей орбите земли. Конечно при приближении к солнцу поглощенная доза увеличивается (и увеличивается вероятность попасть под коронарный выброс кстати)
-
то нужно учитывать вакуумный ультрафиолет
Да-а-а-! На глубине 1 м под кометным льдом где проживают тихоходки, а за одно учесть биологический эквивалент ионизирующего излучения, который для галактических альфа частиц ~ 20 и исключить область внутри орбиты Меркурия, где тихоходки умрут от высокой температуры и ИК-излучения, соответственно рассуждать о вреде радиации будет уже поздно.-
Глубина проникновения альфы небольшая, а частиц высоких энергий в спектре немного - космические лучи падают с ростом энергии. Чтобы тихоходки померли от ик и теплоты, комета должна растаять. Как вы можете убедиться, кометы не очень успевают растаять в районе орбиты Меркурия - они большие и холодные, а пролетают быстро. К тому же там тепло и ик только на солнечной стороне, а то, что в тени, такое же холодное, как и где-нибудь в районе Марса
-
-
-
-
Ладно бы какую нить водорасль или фотобактерию, а тихоходки откуда получит энергию?
-
Они там эволюционировали, потому у них закрепились такие потрясающие навыки.
И пока не прозвучала иная версия, позволяющая понять, где живое может эволюционно приобрести такие же.
Как тихоходки туда попали и что там ели - мощный вопрос, стимулирующий фантазию!)
Думаю, нужно внимательно изучить кометы на предмет биоты. Если обнаружатся водоросли - это будет шикарным подтверждением, что мы с Вами на верном пути!))-
Они там эволюционировали
Где "там"? На кометах? А откуда тогда у них общая и морфология и генетика с членистоногими и онихофорами?
https://ru.wikipedia.org/wiki/Panarthropodaгде живое может эволюционно приобрести такие же.
В любых достаточно сухих местах. Адаптация к высыханию во многом обеспечивает и адаптацию к ионизирующему излучению.
И дались ВАм эти тихоходки. Или вы о других животных-экстремфилах не слышали ещё? Так коловратки (особннно интересны - бделлоидные) и цисты щитней не многим менее стойки к жёстким условиям среды.
Тихоходки в отличие от перечисленных разве что ещё сохраняют настоящий план строения тела двустороннесимметричных животных в своём гибернированном состоянии.
Но все - в одном околомикроскопическом размерном классе - пересекаясь с крупнейшими протистами. -
По серьезному поводу такие не серьезные фантазии.
В современной саванне (например африканской) в засушливый сезон высыхают листочки, травинки и тихоходки. При этом часто формируются мощные восходящие воздушные потоки ( вполне макроскопические предметы - орлы, парашютисты и пр. оказываются на высотах больше 10 тыс.м.), для которых унести сушеную тихоходку выше тропосферы раз плюнуть. А здесь и температура -50, и давление пониженное, и радиационный фон ого го.
Более того, после сухого сезона наступает мокрый и приходят тропические грозы с громом и молниями. А каждая уважающая себя молния генерит ультрафиолет, озон, рентген, и даже гамму (как следствие рождения электрон позитронных пар) недавно обнаружили. Фейерверк на этом не заканчивается - особо мощные разряды наносят удары не только по Земле, но и бьют в ближний космос. Сушеные тихоходки, если переживут такую катавасию, смогут переместиться на тыщи километров ( даже на другой континент), ведь по-другому они не умеют, передвигаются плоховато.
И такие атмосферные процессы происходят, по крайней мере, весь фанерозой.
-
Последние новости


См. также















Рис. 1. Тихоходка Ramazzottius varieornatus — обладатель уникальных неупорядоченных белков TDP. Фото с сайта edition.cnn.com