Новый жидкий галлиево-палладиевый катализатор не уступает промышленным

Немецкие химики впервые использовали в закрепленном жидкометаллическом катализаторе не раствор, а расплав металла. В реакции дегидрирования насыщенных углеводородов — важного для химической промышленности процесса — нанесенный на твердый субстрат жидкий сплав галлия с палладием проявляет активность, сравнимую с активностью коммерчески доступных катализаторов, сохраняя при этом свои рабочие свойства в течение более длительного времени. После решения ряда технологических вопросов и изучения каталитической активности жидкометаллического катализатора в других реакциях сплав галлий-палладий может найти применение в промышленной химии.
В химии катализа важную роль играют так называемые гетерогенные катализаторы (см. также Heterogeneous catalysis), термодинамическая фаза которых отличается от фазы взаимодействующих веществ: обычно такие катализаторы твердые, а реагирующие вещества — жидкости или газы. Такой катализатор наносят (закрепляют) на твердый пористый носитель, или подложку (см. Catalyst support) — инертный или малоактивный материал, служащий для стабилизации на его поверхности частиц активной каталитической фазы. Поэтому их также называют «закрепленными». Закрепленный катализ позволяет скомбинировать преимущества эффективности и селективности гомогенных катализаторов и легкость отделения от реакционной смеси катализаторов гетерогенных: после завершения химической реакции носитель с закрепленными на нем каталитически активными центрами можно проcто отделить от продуктов реакции фильтрованием.
С 1980-х годов в процессах промышленного и тонкого органического синтеза применяются закрепленные жидкие металлокомплексные катализаторы. Первоначально в качестве активной каталитической фазы в них использовались капли растворов металлокомплексных катализаторов в органических растворителях с температурой кипения выше 150°С (диметилформамид, гексаметапол), закрепленные на твердых носителях за счет химических связей или межмолекулярных взаимодействий. Позже вместо них стали применяться растворы комплексов металлов в ионных жидкостях. Преимуществом ионных жидкостей является высокая температура кипения и устойчивость к коксованию — высокотемпературным химическим процессам, в результате которых из низкомолекулярных соединений образуются высокомолекулярные продукты, которые могут блокировать активные центры катализатора, снижая или блокируя его способность ускорять химические процессы.
Известно уже немало успешных примеров применения закрепленных жидких металлокомплексных катализаторов, однако их общим недостатком является то, что такие катализаторы нельзя использовать при температуре выше 200°C — при этой температуре и «классические» органические растворители, и ионные жидкости начинают разрушаться, осмоляться, в результате чего растворенные в них комплексы металлов теряют свою каталитическую активность. Оптимальные же температуры для проведения многих промышленно важных процессов лежат гораздо выше.
Исследователи из группы Петера Вассершайда (Peter Wasserscheid) из немецкого Университета имени Фридриха-Александра решили использовать в качестве жидкого гетерогенного катализатора пленку из сплава, содержащего растворенный в галлии палладий, закрепленную на пористом стеклянном носителе. Низкая температура плавления чистого галлия (29,8°C) обуславливает то, что сплав галлий-палладий, содержащий от 2,5% до 15% палладия по массе (сплавы таких составов изучали на предмет проявления каталитической активности), остается жидким при температуре 400–450°С (рис. 2) – оптимальной для проведения ряда промышленно важных процессов, таких как реакции гидрирования и дегидрирования (в соответствии с механизмами протекания химических реакций, прямой и обратный химические процессы ускоряются одним и тем же катализатором).

Рис. 2. Фрагмент фазовой диаграммы (диаграммы, отражающей зависимость агрегатного состояния и возможности образования интерметаллических соединений от состава смеси и температуры) сплава галлий-палладий. Заштрихованная область в верхнем левом углу указывает на условия (температура реакции и состав сплава), в которых проводили модельную каталитическую реакцию дегидрирования. Изображение из обсуждаемой статьи в Nature Chemistry
Дегидрирование алканов — одна из наиболее полезных реакций в промышленном органическом синтезе: алканы, или парафины, которые являются компонентами природных источников углеводородного сырья, отличаются крайне низкой реакционной способностью, и для использования в дальнейших химических процессах их необходимо конвертировать в более реакционноспособные ненасыщенные алкены, двойная связь которых позволяет непосредственно из них получать полимерные материалы, а также промежуточные продукты органического синтеза.
Еще одно отличие нового жидкого закрепленного катализатора в том, что реагенты не растворяются в сплаве галлий-палладий и каталитическая реакция протекает не в растворе, содержащем катализатор, а на поверхности капли сплава. Предполагается, что каталитически активным центром в данном случае выступают отдельные атомы палладия, плавающие в «озерах» галлия.
Исследователи сравнили каталитические свойства сплава галлий-палладий со свойствами зарекомендовавших себя в промышленном синтезе коммерчески доступных катализаторов, таких как платина или палладий, закрепленных на носителе из оксида алюминия. В качестве модельной реакции был выбран процесс дегидрирования бутана (рис. 3).
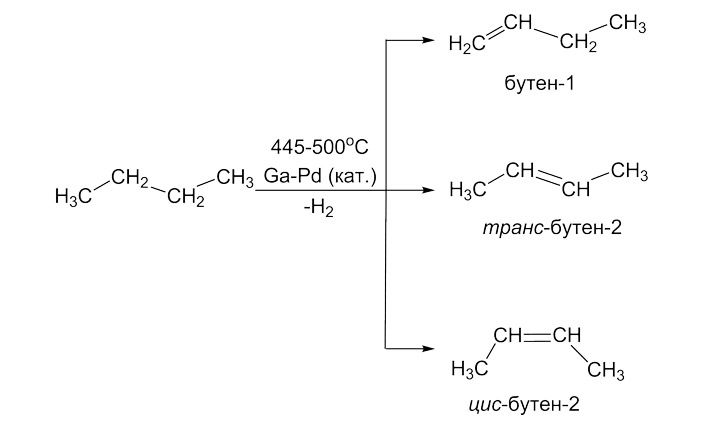
Рис. 3. Модельная каталитическая реакция дегидрирования позволяет получить из бутана смесь изомерных бутенов
Такая модель была выбрана не случайно: металлические палладий и платина, а также их соединения являются известными катализаторами процессов дегидрирования и гидрирования, поэтому исследователи ожидали проявления каталитических свойств и от галлий-палладиевого расплава. Дегидрирование бутана хорошо изучено и фактически является "рабочей лошадкой" для испытания новых каталитических систем. Если новый кандидат в катализаторы превосходит ставшую "золотым стандартом" катализа дегидрирования металлическую платину, закрепленную на оксиде алюминия или углероде, хотя бы по одному из параметров эффективности — степени ускорения каталитической реакции, долговечности работы катализатора, избирательности в превращении бутана в какой-то один из продуктов дегидрирования и т. д., — исследование "кандидата в катализаторы" продолжается. Если получается так (а именно чаще всего так и бывает в химическом поиске), что испытанное на предмет каталитической активности вещество ничуть не лучше "стандарта", дальнейшие работы по возможности его применения в управлении химическими реакциями прекращаются.
Сплав галлий-палладий не уступал известным катализаторам на коротких дистанциях и однозначно превзошел их на длинных. Так, при температуре 445°C в течение трех часов и платина на оксиде алюминия, и жидкометаллический катализатор демонстрировали близкую активность (по расчетам, один атом платины или палладия обеспечивал превращение 3–4 молекул бутана в течение часа) и селективность (в обоих случаях на целевой продукт дегидрирования, смесь трех изомерных бутенов — бутена-1, цис-бутена-2 и транс-бутена-2, приходилось 80–85% от вступивших в реакцию молекул бутана). Через 20 часов после непрерывного процесса дегидрирования платиновый катализатор терял до 40% своей активности, в то время как галлий-палладиевый сплав сохранял свои свойства и через сто часов непрерывного процесса конверсии бутана.
Исследователи планируют изучить обнаруженного ими каталитическую активность сплава галлий-палладий и в других реакциях, важных для органической химии. В их планах — проверка активности сплавов галлия и с другими металлами, которые в таких условиях можно будет «раздробить» до отдельных атомов. Так, например, есть надежда на то, что сплав галлий-никель сможет ускорять уникальные химические реакции. Эта надежда вызвана тем, что электронная конфигурация и, следовательно, реакционная способность изолированных атомов никеля в жидкометаллическом катализаторе должна отличаться от свойств атома никеля, окруженного другими атомами никеля в составе никелевой наночастицы, входящей в состав такого известного катализатора, как никель Ренея.
Безусловно, новый тип катализатора может оказаться весьма перспективным направлением закрепленного катализа. Однако, поскольку это первый пример применения жидкого металла, пусть даже сплава, для ускорения химических процессов, система очень сильно отличается от всего, с чем приходилось иметь дело. До использования в промышленности нужно решить целый ряд вопросов, связанных с масштабным получением такого катализатора и способами его хранения. Также необходимо изучить способы его регенерации (извлечения катализатора из реакционной смеси после завершения реакции, его очистки и подготовки к повторному использованию) и понять, не будет ли он терять активность при регенерации и при хранении. (То, что катализатор выходит из катализируемой им реакции, «не изменившись в лице», — очень большое упрощение. Реальный катализатор «отравляется» либо из-за загрязнения поверхности, либо по причине вторичных реакций. Поэтому должны быть способы повторного приведения катализатора в рабочее состояние.)
Тем не менее весьма возможно, что процесс адаптации нового типа катализаторов к существующим технологиям будет быстро пройден, и в химической технологии органических соединений появится новый раздел — гетерогенный жидкометаллический катализ.
Источник: N. Taccardi, M. Grabau, J. Debuschewitz, M. Distaso, M. Brandl, R. Hock, F. Maier, C. Papp, J. Erhard, C. Neiss, W. Peukert, A. Görling, H.-P. Steinrück, P. Wasserscheid. Gallium-rich Pd–Ga phases as supported liquid metal catalysts // Nature Chemistry. 2017. DOI: 10.1038/nchem.2822.
Аркадий Курамшин
-
Пористое стекло: это прекрасно. А не входит ли в состав этого самого стекла галлий? Возможно тогда бы жидкий сплав галлия и палладия покрывал бы бОльшую площадь пор.
Не научно мыслю? Может быть. Однако такая штука есть: человеку нужно было получить суспензию мелкодисперсного натрия в толуоле. Он взял поваренную соль, растёр её, высушил хорошо. Загрузил её вместе с металлическим натрием в сухой толуол под аргоном, нагрел, взбил всё проволочной мешалкой, охладил. Получились у него мееееелкие частички соли, покрытые натрием. Далее была сложноэфирная конденсация. Обычно греть надо. А тут аж прям охлаждать пришлось. Красиво. (Я спросил про калий, он предложил мне это самому проверить; но как-то пока не было нужды.)
-
Видимо пористость носителя препятствует коалесценции (можно на картинке увидеть, что через 20 часов катализа капли хотя и меняют форму, но не коалесцируют). Сравнение TOF сплава и платины у них в статье нет, там больше подчеркивается, что у платины ниже TON (число каталитических циклов до дезактивацдлкого сплава.
Понятно, что это не гарантирует, что сплав будет вести себя в промышленной установке, как в лаборатории - у масштабирования есть свои проблемы.
-
Цитата из новостной статьи: *металлические палладий и платина, а также их соединения являются известными катализаторами *
Именно дело в том, что у самих авторов в статье нет четкого понимания механизма, они его и не обсуждают, просто сравнивают с промышленными типами гетерогенных катализаторов. Вместе с тем есть комплексы палладия (конечно не такие активные в гидрировании/дегидрировании, как родийсодержащий комплекс Уилкинсона), где именно работает один координационно ненасыщенный атом металла, стабилизированный/растворенный в реакционной смеси за счет лигандов
Последние новости













Рис. 1. Изображения пористых стекол с закрепленным галлием и сплавом галлий-палладий, полученные с помощью метода сканирующей электронной микроскопии. а — чистый галлий; b, c — капли сплава GaPd (атомарное соотношение Ga:Pd = 10:1) до начала каталитической реакции; d — капли сплава после 20 часов каталитической реакции дегидрирования. Изображение из обсуждаемой статьи в Nature Chemistry