Искусственные полимеры могут хранить генетическую информацию
Получены ферменты-полимеразы, способные переписывать генетическую информацию с молекул ДНК на шесть типов не встречающихся в природе полимеров — «ксенонуклеиновых кислот» (КНК). Другие искусственные ферменты осуществляют обратный процесс — синтез ДНК на матрице КНК. Для некоторых КНК налажена самостоятельная репликация без участия ДНК или РНК. Методом искусственной эволюции удалось вывести молекулы КНК с полезными свойствами (аптамеры), что ранее удавалось сделать только с ДНК и РНК. Исследование показало, что ДНК и РНК — не единственные полимеры, способные служить «веществом наследственности» и эволюционировать под действием мутаций и отбора. Открытие может иметь большое значение для биотехнологии, а также для общего понимания жизни и ее происхождения.
Всё живое на Земле использует для хранения и копирования наследственной информации только два класса полимеров: РНК и ДНК. Чем обусловлен этот выбор? Возможна ли жизнь, использующая в качестве «вещества наследственности» какие-то другие полимеры? Окончательного ответа пока нет, но химики пытаются его найти, экспериментируя с синтетическими полимерами — искусственными аналогами РНК и ДНК. Некоторые специалисты по пребиотической химии предполагают, что земная жизнь могла начаться не с РНК, а с другого способного к репликации полимера, синтез которого в отсутствие биологических катализаторов (белков-ферментов и рибозимов) происходил легче и быстрее, чем абиотический синтез РНК. Одним из кандидатов на эту роль считается ТНК — аналог РНК, у которого пятиуглеродная рибоза заменена на четырехуглеродный сахар — треозу (см. Тайна происхождения жизни скоро будет разгадана?, «Элементы», 12.01.2009).
Изучение альтернативных «генетических полимеров» сдерживается тем, что синтезировать их трудно и дорого. Производство молекул ДНК и РНК с любой нужной экспериментатору последовательностью нуклеотидов сегодня поставлено на поток благодаря использованию мощнейших природных катализаторов — ферментов-полимераз, которые осуществляют размножение молекул ДНК и РНК (репликацию), синтез РНК на матрице ДНК (транскрипцию) или синтез ДНК на матрице РНК (обратную транскрипцию). Полимеразы весьма привередливы в выборе субстрата, то есть тех длинных молекул, которые используются в качестве матрицы для копирования, и мономеров-нуклеотидов, из которых собирается копия. Как правило, природные полимеразы наотрез отказываются размножать КНК («ксенонуклеиновые кислоты»: так называют разнообразные искусственные аналоги ДНК и РНК). Из-за отсутствия эффективных методов репликации КНК и переноса генетической информации с ДНК на КНК (и обратно) само предположение о том, что КНК могут играть роль вещества наследственности, до сих пор оставалось недоказанным.
Команда исследователей из Великобритании, Бельгии, США и Дании сообщила в последнем выпуске журнала Science, что им удалось изготовить ферменты-полимеразы, способные переносить наследственную информацию с ДНК на шесть разных КНК (рис. 1), а также осуществлять процесс, аналогичный обратной транскрипции, то есть синтезировать комплементарные цепочки ДНК на матрице КНК.
Авторы взяли за основу белок TgoT — ДНК-полимеразу термофильной архебактерии Thermococcus gorgonarius, которая была обнаружена российскими микробиологами в гидротермальных источниках у побережья Новой Зеландии (Miroshnichenko et al., 1998. Thermococcus gorgonarius sp. nov. and Thermococcus pacificus sp. nov.: heterotrophic extremely thermophilic archaea from New Zealand submarine hot vents.). Структура этого фермента хорошо изучена (Hopfner et al., 1999. Crystal structure of a thermostable type B DNA polymerase from Thermococcus gorgonarius), что облегчает создание на его основе новых полимераз с заданными свойствами: в общих чертах понятно, в какие места молекулы нужно вносить случайные мутации, чтобы изменить избирательность фермента.
Искусственный отбор ферментов, способных синтезировать КНК на матрице ДНК, проводился при помощи хитрой методики, которую авторы назвали «compartmentalized self-tagging» («компартментализованное само-мечение») (рис. 2). Бактерий E. coli, в которых были вставлены плазмиды с разными мутантными версиями гена полимеразы TgoT, помещали в водно-жировую эмульсию, так что каждый вариант полимеразы оказывался в отдельной капельке воды — в той же самой, где находился и его ген («компартментализация»). В воду добавляли «ксенонуклеотиды», а также затравки-праймеры — короткие последовательности нуклеотидов, комплементарные участку той же плазмиды, в которой располагался ген полимеразы. Праймеры использовались не простые, а биотинилированные: к олигонуклеотидам прикреплялись молекулы биотина (см. Biotin).
Праймер присоединяется к комплементарному участку ДНК, а полимераза пытается его достроить, используя ксенонуклеотиды в качестве мономеров для синтеза КНК. Если ей это удается, праймер оказывается прикреплен к плазмидной ДНК более прочно. Это и есть «само-мечение», позволяющее отобрать плазмиды с удачными вариантами гена полимеразы при помощи шариков, покрытых стрептавидином (см. Streptavidin). Биотин, приделанный к праймеру, накрепко присоединяется к стрептавидину. В результате после промывки на шариках остаются только те плазмиды, чей ген полимеразы сумел обеспечить синтез КНК и, как следствие, более прочное соединение праймера с плазмидой. В отобранные варианты гена можно затем внести новые мутации и повторить процедуру отбора.

Рис. 2. Стратегия искусственного отбора полимераз, способных синтезировать КНК на матрице ДНК («компартментализованное само-мечение»). Большие круги с красными и синими фрагментами — плазмиды с разными вариантами гена полимеразы. Маленькие красные и синие шарики — полимеразы. Крошечные незакрашенные кружки с загогулинами — биотинилированные праймеры. Большие коричневые круги — шарики, покрытые стрептавидином, к которым присоединяется биотин, прикрепленный к праймеру. Промывка позволяет удалить те плазмиды, на которых синтез КНК не состоялся, и поэтому связь между плазмидой и праймером осталась непрочной. Остальные пояснения см. в тексте. Изображение из дополнительных материалов к обсуждаемой статье Pinheiro et al. в Science
Другие, столь же изощренные методики использовались для получения полимераз, способных переписывать наследственную информацию в обратном направлении: с КНК на ДНК. В итоге удалось получить аналоги прямых и обратных транскриптаз для всех шести КНК, а для одной из них (флюоро-арабино-нуклеиновой кислоты, FANA) вывели даже фермент, способный размножать (реплицировать) молекулы КНК напрямую, без участия ДНК. Правда, репликация FANA по своей эффективности пока сильно уступает стандартным методам размножения ДНК при помощи полимеразной цепной реакции.
Точность работы искусственных полимераз ниже, чем у их естественных аналогов, синтезирующих обычные ДНК и РНК, но всё же достаточно высока, чтобы с КНК можно было работать — например, ставить опыты по искусственной эволюции. Частота ошибок в полном цикле репликации (ДНК → КНК → ДНК) составляет от 4,3·10–3 (для CeNA) до 5,3·10–2 (для LNA). Для сравнения, в живых клетках частота ошибок при репликации ДНК обычно около 10–8–10–7, при обратной транскрипции 10–5–10–4, у некоторых РНК-содержащих вирусов точность копирования генетического материала может быть еще ниже.
Главная заслуга авторов в том, что выведенные ими полимеразы позволяют работать с разнообразными КНК примерно так же, как биологи давно уже работают с ДНК и РНК. Неудивительно, что авторы сразу попытались при помощи искусственной эволюции вывести молекулы КНК с какими-нибудь полезными свойствами. Попытка увенчалась успехом: на основе HNA со случайной последовательностью нуклеотидов при помощи мутаций и отбора были выведены молекулы, способные, подобно антителам и другим белкам-рецепторам, избирательно связываться с определенными веществами: лизоцимом из белка куриных яиц и фрагментом РНК вируса ВИЧ (см. TAR). Участки РНК, работающие наподобие рецепторов (их называют «аптамерами»), встречаются у живых организмов (см. Сложные РНК-переключатели — новый механизм регуляции генов, «Элементы», 18.10.2006) и легко выводятся искусственно. Успешное создание аптамеров на основе КНК показывает, что эти полимеры способны не только к хранению и копированию генетической информации, но и к дарвиновской эволюции.
Работа может оказаться важной в двух отношениях: практическом и теоретическом. С точки зрения практики, она открывает целое новое поле для биотехнологических разработок — от медицинских препаратов до альтернативных форм жизни. Не исключено, что на основе КНК можно будет создать эффективные средства регуляции активности генов. Молекулы КНК, комплементарные фрагментам тех или иных генов, будут связываться с соответствующими матричными РНК и тем самым подавлять активность гена. Чужеродные РНК или ДНК, попадающие в клетку извне, как правило, быстро уничтожаются ферментами-нуклеазами. Но КНК неуязвимы для нуклеаз, имеющихся у живых клеток (по той же причине, по которой природные полимеразы отказываются их размножать: они просто не распознают их как свой субстрат). Поэтому препараты для подавления активности генов, основанные на антисмысловых КНК, могут оказаться эффективнее аналогичных препаратов, основанных на РНК. К тому же разные КНК обладают разными химическими характеристиками, что расширяет спектр областей их возможного применения. Например, авторы показали, что в кислой среде некоторые КНК гораздо устойчивее, чем ДНК.
С теоретической точки зрения, исследование может оказаться важным для общего понимания земной жизни и ее происхождения. Теперь уже можно считать доказанным, что не только ДНК и РНК, но и другие полимеры могут хранить генетическую информацию и эволюционировать. Это делает более правдоподобными гипотезы о том, что жизнь могла начаться не с РНК, а с какого-то иного полимера, который легче синтезировался абиогенным путем и впоследствии был вытеснен РНК. При поиске жизни на других планетах эти результаты тоже следует учитывать. В конце концов может оказаться, что земная жизнь основана на ДНК и РНК не из-за каких-то уникальных свойств этих молекул, а просто в силу исторической случайности.
Данное исследование — один из первых шагов в неизведанную область, в целый новый мир альтернативных генетических полимеров. Можно смело ожидать скорого открытия первых ксенозимов — молекул КНК с каталитическими свойствами. Не исключено, что и работы по созданию искусственной жизни пойдут бодрее на основе открывшегося разнообразия потенциальных «веществ наследственности».
Источники:
1) Vitor B. Pinheiro, Alexander I. Taylor, Christopher Cozens, Mikhail Abramov, Marleen Renders, Su Zhang, John C. Chaput, Jesper Wengel, Sew-Yeu Peak-Chew, Stephen H. McLaughlin, Piet Herdewijn, Philipp Holliger. Synthetic Genetic Polymers Capable of Heredity and Evolution // Science. 2012. V. 336. P. 341–344.
2) Gerald F. Joyce. Toward an Alternative Biology // Science. 2012. V. 336. P. 307–308.
См. также:
Тайна происхождения жизни скоро будет разгадана?, «Элементы», 12.01.2009.
-
Разумеется выбор рибозы случайность, правда есть основания предполагать что не случайная, если синтез сахаров шел по реакции бутлерова на аппатитах, то получающаяся связаная с поверхностью (тетраэдром РО4) рибоза, уже прекрасная основа для синтеза остальных рибозофосфатов. Если синтез этого сахара был действиетльно самым простым, его включение в абиогенез было предопределено.
Конечно очень хороший результат, другие молекулы записывающие генетический код обязаны были быть, и теперь их нашли. -
PS: Забыл пароль от старого аккаунта и почту на которой его регистрировал, можно восстановить как-то? :)
-
Например селенометионин включается вместо метионина, но он ядовит. Есть еще аминокислоты, входящие в расширенный генетический код - селеноцистеин (вместо стоп-кодона плюс должен быть определенный контекст) , таурин и третий не помню.
Ну а при внематричном синтезе в пептиде может вообще быть все что угодно, включая D-аминокислоты.
Либо мы не можем культивировать микроорганизмы с другими наборами ДНК оснований и аминокислот.
-
-
А может, среда была очень кислой. Этакая смесь карбоновой, фосфорной, азотной и серной кислоты в первичной луже плюс ультрафиолет. Аминокислоты, из которых мы состоим, стойки именно к ультрафиолету.
-
Кислой вряд ли, источник аминных оснований предполагает пары СНОН и NН3 а аммиак основание. Из кислых газов НCl и H2S оба слишком реакционноспособны и могут остановить все пребиотические реакции.
А вот насчет УФ света верно есть веские основания предполагать что реакция АДФ + PO4 + УФ-квант = АТФ была основным источником энергии для пребиотических реакций. И стойкость выживших определяется именно постоянной необходиомстью энергии из УФ, нестойкие разрушались стойкие получали дармовую энергию.-
С ходу не нашел публикацию, которую читал полгода назад. Перескажу как получиться.
Английские химики синтезировали абиогенные аминокислоты. Почти все получились, кроме двух, реакции неизменно заходили в тупик. И только когда в растворе ИЗНАЧАЛЬНО содержалась фосфорная кислота, открылась цепочка побочных реакций, приведшая к результату. Но получилось и множество других близких аминокислот. Но стоило "засветить" реактор УФ, как исчезли все аналоги, остались только те, которые и входят в состав живого.
Далее мое. Поскольку фосфорная кислота в природных водоемах бысто выпадает в осадок из-за кальция, вода должна быть кислой, причем очень, за счет серной, азотной или Н_2СО_3 кислот. Кроме того, в материале о самом древнем минерале (не на ЭЛЕМЕНТАХ) говорилось, что эрозия древнего циркона была вызвана кислотами, настолько сильными, что делало невозможным существование силикатов на поверхности Земли в первые полмиллиарда лет ее существования.
-
-
-
...По нуклеотидному составу т-РНК несколько отличается от других рибонуклеиновых кислот, т.к., помимо обычных А, Г, Ц и У, в нее входят редкие нуклеотиды (7-8 в каждой т-РНК). Их роль заключается в том, что они повышают сопротивляемость т-РНК действию фермента рибонуклеа-зы, благодаря чему т-РНК существует более длительный период. К настоящему времени изучено строение т-РНК для семи разных аминокислот. (http://yaveterinar.ru/veterinarnaya-enciklopediya/141/142/r
-------
Бактерии любят наварить для своих загадочных нужд разные нестандартные аминокислоты. Грибы - тоже; токсины бледной поганки содержат нестандартные аминокислоты (http://ru.wikipedia.org/wiki/%D0%90%D0%BB%D1%8C%D1%84%D0%B0
Возникает вопрос - а что мы можем сказать о строении и свойствах теоретически возможных, но пока ещё не открытых новых химических репликаторов? Репликация ДНК и РНК достигается благодаря попарной дополнительности молекулярных звеньев репликатора - нуклеотидов при образовании ими направленных химических связей достаточно слабых, чтобы обратимо разрываться тепловым движением при температурах гораздо меньших, чем необходимо для начала распада химических связей репликатора, но уже достаточно сильных, чтобы обеспечивать достаточную селективность такой дополнительности (комплементарности), подразумевая направленный характер комплементарных связей. Поэтому необходимо, чтобы отношение k1 энергии разрыва слабейшей химической связи в полимерной цепи репликатора Eb к энергии Eс связывания двух звеньев в комплементарный комплекс к было достаточно велико для того, чтобы аррениусовские скорости этих процессов различались в достаточное число раз x1 (на несколько порядков). Кроме того, необходимо, чтобы отношение k2 энергии Eс к энергии Er межзвеньевого торсионного барьера в полимерной цепи репликатора (т. е. к энергии конформационного вращения вокруг химических связей) также было достаточно велико для того, чтобы аррениусовские скорости этих процессов различались в достаточное число раз x2 (тоже на несколько порядков). Числа x1 и x2 вносят свои независимые вклады в отношение числа точных элементарных актов репликации к суммарному числу ошибок и повреждений - то есть, предопределяют вероятность мутаций, в ходе биологической эволюции стремящуюся к некоторому оптимальному значинию - но заведомо тем более низкому, чем организмы крупнее и анатомически сложнее. Поэтому и значения k1 и k2 тоже должны иметь оптимальные значения - притом достаточно большие. На логарифмической шкале примерно посередине между энергиями самых прочных ковалентных химических связей, способных образовывать цепи (а это связи C-C) и энергиями конформационного вращения вокруг осей таких связей располагаются только два типа направленных связей - водородные и ионно-координационные. При этом ионно-координационные связи нужного диапазона энергий требуют наличия в системе катионов некоторого металла в достаточной концентрации - при понижении этой концентрации неизбежно произойдёт распад комплементарных пар, и репликация станет невозможной. Поэтому молекулярный репликатор, комплементарность звеньев которого обеспечивают не предъявляющие специальных требований к среде водородные связи, гораздо более надёжен и сможет возникнуть и распространиться в многократно более широком спектре местообитаний. Вероятность мутаций сильно зависит также от количества и от типа межзвеньевых химических связей в полимерной цепи репликатора: селективность реакций образования-расщепления неполярных связей C-C чрезмерно низка (повышаясь выше 90% только для металлоорганических катализаторов, нереализуемых при практически встречающихся в космосе относительных пропорциях химических элементов, или для сложных ферментативных центров, которые сами могут быть только результатом эволюции достаточно сложных и надежных репликаторов, и потому не могут участвовать в инициировании жизни), поэтому в такой цепи неизбежно наличие достаточно полярных связей, имеющих достаточно высокую селективность образования-расщепления уже в отсутствие стереоспецифичных катализаторов (для чаще всего встречающихся космических условий, это кислородсодержащие связи гидролизующихся типов - например, сложноэфирных или ацетальных). Кроме того, количество вращательных степеней свободы межзвеньевой связки в полимерной цепи репликатора должно быть достаточно большим, чтобы образование-расщепление новой комплементарной пары звеньев не требовало существенной деформации предыдущих пар звеньев (которая резко понижала бы эффективное значение k2), но и не настолько большим, чтобы это понизило селективность роста цепи или ее долговечность в неприемлемой степени. Вариативность, конформационная жесткость одиночных водородных связей и их энергии обычно слишком низки для целей информативного комплементарного связывания, но слишком высокая кратность комплементарных систем водородных связей приводит к слишком высокой энергии расщепления комплементарной связи между звеньями, падению селективности по комбинаторным причинам, чрезмерной сложности и маловероятности химических реакций образования таких звеньев. Наивысшая кратность межмолекулярного водородного связывания между молекулами, образующимися в простейших реакциях, достигается в еще неорганическом комплексе 1:1 меламина C3N3(NH2)3 (продукта термической тримеризации цианамида NH2CN, образующегося при гидролизе CaCN2 и другими простыми путями) с циануровой кислотой (CO)3(NH)3 (продуктом термолиза мочевины, тримеризации изоциановой кислоты или гидролиза меламина), что дает основания предполагать, что вероятность образования репликаторов с водородными связями подобного типа наиболее высока - и действительно, именно таковы связи между азотистыми основаниями нуклеиновых кислот. Однако при этом возникает вопрос - а почему с урацилом или тимином связывается аденин, ведь связь с ними аминоаденина была бы как минимум в полтора раза прочнее по энергии, а по скорости образования-расщепления - в многие разы. Здесь возможно несколько причин, и без расчетов с ходу не скажешь, какая из них оказалась решающей - или чрезмерная сложность ферментативного синтеза аминоаденина (что не могло быть решающим при последующей эволюции - ведь усложнился же урацил РНК до тимина ДНК!), или слишком высокая прочность такой системы водородных связей - по сравнению гуанин-цитозин или самой по себе, или какие-то более сложные причины.
Последние новости







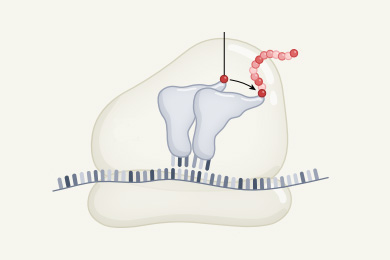





Рис. 1. ДНК и ксенонуклеиновые кислоты (КНК). А — структура ДНК (показана одна из двух нитей, образующих двойную спираль). B — структура мономеров (нуклеотидов) ДНК (DNA) и шести КНК. Молекулы различаются строением сахара, входящего в состав сахаро-фосфатного «скелета». У ДНК это дезоксирибоза, у РНК — рибоза, у КНК — разные другие сахара: арабиноза (ANA), 2'-флюороарабиноза (FANA), треоза (TNA), особая «запертая» (locked) форма рибозы (LNA, см. Locked nucleic acid), циклогексен (CeNA), ангидрогекситол (HNA). Base — азотистое основание. Черные шарики — атомы углерода, красные — кислорода, зеленые — фтора. Изображение из обсуждаемой статьи G. F. Joyce в Science