У пещерных рыб биологические часы регулируются не светом, а пищей

Известно, что внутренние биологические часы регулируются внешними воздействиями, главное из которых — суточные колебания света. Специалисты из университетов Италии, Германии и Испании решили исследовать суточные ритмы у абсолютно слепой рыбки Phreatichthys andruzzii, обитающей в условиях постоянной темноты в подземных пещерах Сомали. Оказалось, что у P. andruzzii сохранились «слепые» циркадные часы, которые не корректируются светом, а запускаются только пищей. Примечательно, что у этой пещерной рыбы сами по себе циркадные часы оказались в полной исправности. Но два незрительных фоторецептора из семейства опсинов мутировали, в результате чего потеряли способность передавать световой сигнал.
Циркадные (суточные) ритмы — эндогенные циклические колебания различных биологических процессов, чрезвычайно древний механизм регулирования адаптации к изменениям окружающей среды. Синхронизирован он в первую очередь со сменой дня и ночи. У млекопитающих пигмент меланопсин (см. Melanopsin) в ганглиозных клетках сетчатки реагирует на смену дня и ночи, и эта информация передается в определенную область в гипоталамусе (см.: Синий и зеленый свет будят человека по-разному, «Элементы», 04.06.2010). В результате внутренние часы организма подстраиваются под суточный цикл.
У других позвоночных фоторецепторы могут быть локализованы совсем даже не в сетчатке, а в самых разных тканях, но это не мешает им участвовать в регуляции циркадного ритма. Хорошо известная рыбка Danio rerio представляет собой удобный объект для изучения механизмов запуска внутренних часов с помощью света. Свет может непосредственно запускать циркадный ритм не только в самых различных тканях D. rerio, но даже и в культуре клеток. Описаны различные типы периферических фоторецепторов, принадлежащих к семейству всё тех же опсинов, к которым относится и родопсин, основной зрительный пигмент в сетчатке позвоночных.
В некоторых экстремальных условиях обитания, например в пещерах, некоторые виды рыб абсолютно изолированы от суточного цикла день–ночь на протяжении миллионов лет. У таких рыб обычно совсем редуцированы глаза, причем неродственные виды выказывают в этом отношении поразительное морфологическое сходство. Многое, тем не менее, остается неясным в биологии и поведении этих рыб. Приводит ли эволюция в условиях постоянной темноты к потере всех фоторецепторных функций, включая регуляцию периферических циркадных часов светом? И вообще, сохраняют ли эти исключительные существа какие-либо циркадные ритмы?
Биологи из университетов Италии, Германии и Испании выбрали для выяснения этих вопросов рыбку из подземных пещер Сомали — Phreatichthys andruzzii — с экстремально выраженным трогломорфным фенотипом, то есть абсолютно безглазую, без намека на какие-либо следы или пигментацию в области глаз. Считается, что это существо живет в полной темноте и постоянной температуре в течение 1,4–2,6 миллионов лет.
На первом этапе исследования решили померить двигательную активность P. andruzzii в условиях суточного цикла «12:12 день–ночь» (ДН), а для сравнения то же самое сделать и у Danio rerio. Для этого на стенку аквариума был помещен инфракрасный фотодиод, подключенный к компьютеру. Число пересечений рыбкой фотодиода регистрировалось и сохранялось с помощью компьютерной программы каждые 10 минут. Кормление рыб осуществляли случайным образом. В результате получили абсолютно хаотичную двигательную активность P. andruzzii — в отличие от четкого рисунка повышения двигательной активности в световую фазу у D. rerio (рис. 1).

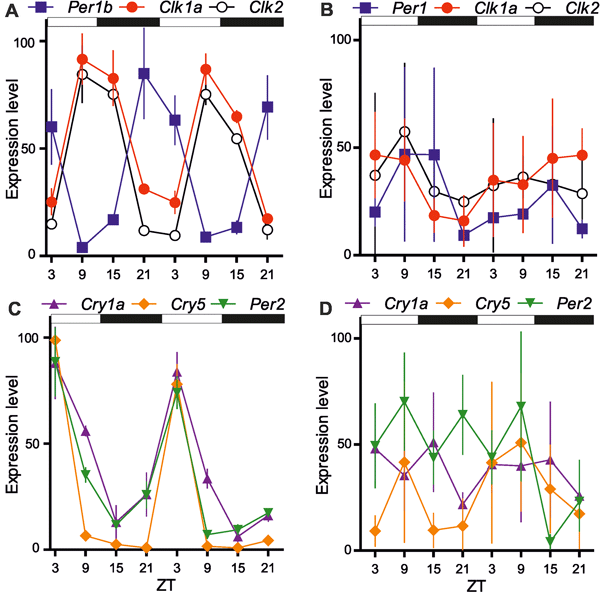
На следующем этапе работы клонировали гомологов часовых генов у P. andruzzii, чтобы проверить их экспрессию в условиях такого же суточного цикла (про часовые гены см.: Открыт альтернативный принцип работы биологических часов, «Элементы», 01.02.2011). Эти гены у D. rerio относятся либо к классическим часовым генам (Per1, Clk1a, Clk1b), либо активируются при изменении освещенности (Cry1a, Cry5, Per2). Секвенирование генов показало их большое сходство у обеих рыбок, что, в принципе, неудивительно, учитывая то, что оба вида относятся к одному семейству карповых.
Экспрессию генов измеряли in vivo во взрослых тканях и у личинок. Результат получился сходный с данными предыдущего эксперимента: у зрячей рыбки D. rerio суточный цикл влиял на изменение экспрессии всех исследуемых генов, тогда как у пещерной рыбки какой-либо закономерный ритм экспрессии отсутствовал (рис. 2). У P. andruzzii ритм не прослеживался даже в течение первого дня жизни, когда у личинки еще присутствуют рудименты глаз. Итак, можно сделать вывод: либо у P. andruzzii вовсе отсутствуют циркадные часы, либо биологические часы не запускаются светом.
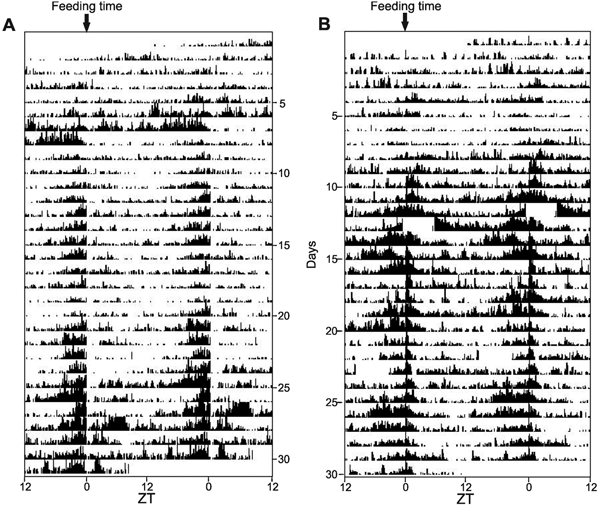
Чтобы проверить эти две гипотезы, авторы решили исследовать, можно ли запустить биологические часы периодическим предъявлением пищи. Взрослых рыб D. rerio и P. andruzzii кормили один раз в день личинками хирономид в определенное время в условиях постоянной темноты, и, как и в первом опыте, измеряли их двигательную активность. Оба вида замечательным образом продемонстрировали повышение активности за несколько часов до появления пищи (рис. 3).
Вслед за этим авторы опять проверили экспрессию часовых генов в различных тканях обоих видов рыб в течение последнего дня кормления и двух последующих дней в отсутствие пищи. Практически во всех исследованных тканях обоих видов рыб было обнаружено ритмическое изменение экспрессии двух часовых генов (рис. 4).

Эти результаты говорят о том, что P andruzzii обладает внутренними часами, которые запускаются пищей, но не светом. Напротив, у D. rerio внутренние осцилляторы регулируются как светом, так и пищей.
Если у пещерной рыбы циркадные часы не запускаются светом, это может происходить из-за какой-либо мутации в регуляторном участке гена (промотере), запускаемого светом. Авторы сравнили регуляторный участок гена Per2 у обоих видов рыб, а также у некоторых других позвоночных. Хотя в промотере Per2 у пещерной рыбы было найдено несколько мутаций, отсутствующих у данио-рерио, оказалось, что они не нарушают световой путь на этом уровне. Авторы это доказали, проведя так называемый репортерный эксперимент.
Здесь нужно дать пояснение. Известно, что регуляторные участки гена обычно находятся перед кодирующими. Допустим, мы хотим изучить закономерности регуляции гена А. Для начала нам нужно померить количество его белкового продукта (или РНК) во времени, что иногда бывает затруднительно сделать. Тут на помощь нам приходит ген-«репортер». Геном-репортером называется синтетическая конструкция, в которой регуляторные участки гена А помещены перед кодирующей последовательностью белка-репортера. Репортер — фермент или флуоресцентный белок, который легко померить точно и количественно. Люцифераза — люминесцентный белок светлячка — очень часто используется в роли репортера, поскольку даже малые ее количества можно определить чувствительной химической реакцией.
Итак, поместив флуоресцентный белок cfPer2-Luc пещерной рыбы в клетки данио-рерио, авторам удалось запустить экспрессию гена Per2 светом. Когда же проделали обратный репортерный эксперимент — zfPer2-Luc данио-рерио встроили в клетки пещерной рыбы, — то не удалось индуцировать экспрессию гена светом. То есть у пещерных рыбок отсутствует механизм, который включает или выключает ген Per2 через этот регуляторный участок. Таким образом, авторы выяснили, что мутации, нарушающие световой путь у пещерной рыбки, не затрагивают непосредственно гены «часов» или регуляторные участки этих генов, а находятся где-то выше на пути передачи светового сигнала.
После этого дело дошло до исследования периферических рецепторов. Авторы выбрали два опсина, один из которых — уже упоминавшийся меланопсин, а другой — так называемый TMT-opsin (Moutsaki et al., 2003), и проклонировали их у P. аndruzzii. В обоих рецепторах нашли мутации в кодирующем регионе, которые, по предположению авторов, должны были бы мешать связыванию хромофора ретиналя (Retinal) с опсином. Опять же с помощью репортерного эксперимента авторы проверили экспрессию опсинов и показали, что, действительно, эти мутации мешают пещерной рыбе передавать световой сигнал. И это — единственная поломка на светопроводящем пути: если «починить» эти рецепторы, клетка P. аndruzzii начинает реагировать на свет, хотя от рецептора до промотера — путь неблизкий и может состоять из массы шагов.
Источник: N. Cavallari, E. Frigato, D. Vallone, N. Fröhlich, J. F. Lopez-Olmeda, A. Foa, R. Berti, F. J. Sánchez-Vázquez, C. Bertolucci, N. S. Foulkes. A blind circadian clock in cavefish reveals that opsins mediate peripheral clock photoreception // PLoS Biology. 2011. V. 9(9), P. 1–13.
См. также:
1) Найден ген, регулирующий ход «внутренних часов», «Элементы», 17.05.2007.
2) Синий и зеленый свет будят человека по-разному, «Элементы», 04.06.2010.
3) Предложена гипотеза, объясняющая механизм синхронизации биоритмов в организме., «Элементы», 16.11.2010.
4) Открыт альтернативный принцип работы биологических часов., «Элементы» 01.02.2011.
Варвара Веденина
Последние новости