Сила пустоты, или Путеводитель по π-дыркам
Вадим Юрьевич Кукушкин,
академик
«Химия и жизнь» №5, 2025

В известной басне Л. Н. Толстого отец решает преподать важный урок своим сыновьям. Он просит их принести связку прутьев и демонстрирует им простую, но глубокую истину. Сначала он предлагает каждому сыну по очереди сломать один прут. Сыновья делают это с легкостью. Затем отец связывает все прутья вместе и просит сломать всю связку. И вот тут, несмотря на все усилия, ничего не получается.
В химии и молекулярной биологии нековалентные взаимодействия демонстрируют то же самое. Каждое нековалентное взаимодействие — водородная связь, ван-дер-ваальсовы силы, именные взаимодействия, такие как галогенная и халькогенная связи — по отдельности крайне слабое. Их энергия обычно составляет всего 1–5 ккал/моль, что в разы или даже на порядок слабее любой ковалентной связи. Такую связь легко разорвать, как и отдельный прут.
Но когда этих взаимодействий множество, они становятся несокрушимыми. Именно множественные слабые взаимодействия удерживают форму сложнейших биологических структур, обеспечивая укладку белков, спирализацию ДНК, сворачивание ферментов, мембранные конструкции клеток. Сотни и тысячи слабых связей, работая одновременно, делают структуры чрезвычайно стабильными.
Еще одна иллюстрация этой мудрости — структура мангровых лесов, где множество тонких воздушных корней (см. фото на заставке к статье). Каждый из них в отдельности довольно слаб, но вместе они создают надежную опорную систему, позволяющую деревьям противостоять ветрам, штормам и сильным приливам.
В предыдущей статье (см. «Химию и жизнь», 2025, № 3) мы подробно рассмотрели σ-дырки и многогранные применения σ-дырочных взаимодействий. Эта статья посвящена другому типу нековалентных связей — не менее впечатляющим π-дырочным взаимодействиям. Но сначала давайте сравним их.
Два лика молекулярного притяжения
Молекулы можно рассматривать как сложные конструкции, в которых сдвиги электронов приводят к формированию пустот двумя принципиально разными способами. Это легко понять на примере многоуровневой парковки, где пустое пространство есть между этажами, над и под машинами, а также вдоль рядов машин на одном этаже в виде пустых коридоров. Итак, первый тип пустот, это π-дырки, формируется между условными этажами конструкции — над и под молекулой или фрагментом молекулы. Во втором случае пустое место тянется вдоль химической связи — это σ-дырки.
И то и другое — реальные электростатические феномены, измеримые области с положительным электростатическим потенциалом, которые можно наблюдать экспериментально, например с помощью микроскопии Кельвина. Главное различие между ними — в природе электронов и в пространственном расположении.
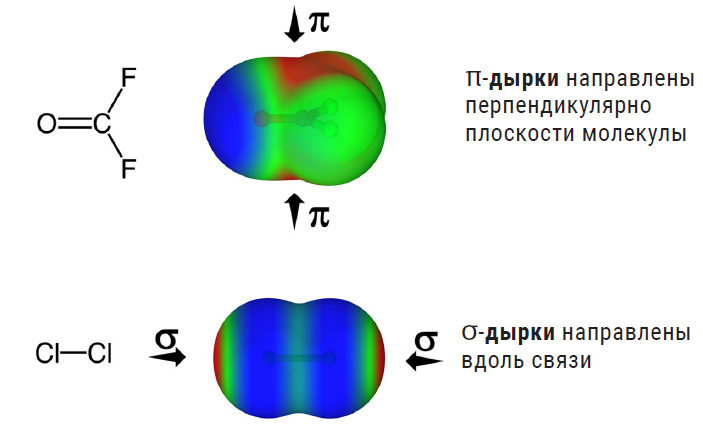
На рисунке сверху показано, как распределяется положительный электростатический потенциал (красная область) в молекуле карбонилдифторида O=CF2, где π-дырка формируется над и под молекулой (как пространство между этажами парковки), а снизу — молекула хлора, где σ-дырки образуются вдоль связи Cl–Cl (как промежутки между машинами в ряду)

Удивительно, но некоторые молекулы могут обладать обоими типами дырок одновременно. Например, в молекуле диперфторпиридилтеллура(II), (NC5F4)2Te, синтезированной в нашей лаборатории, над и под плоскостями электронодефицитного арила NC5F4 формируются π-дырки, а вдоль связей Te–C формируются две σ-дырки. Причем эти электронные пустоты могут конкурировать между собой за возможность связывания с другими молекулами.
Природа мастерски использует обе возможности. Например, в белках π-дырочные взаимодействия помогают правильно уложить ароматические аминокислоты друг относительно друга, как книги на полке, а σ-дырочные взаимодействия обеспечивают точное распознавание молекул по тому же принципу, как определенный ключ подходит к конкретному замку.
Электронные прятки: как возникают π-дырки
Итак, π-дырка — это область молекулы с положительным электростатическим потенциалом, расположенная над или под плоскими участками молекулы.
Согласно исследованиям, π-дырки участвуют в нековалентных взаимодействиях с энергией, как правило, 1–15 ккал/моль. При этом π-дырочные связи обычно не вызывают заметных изменений в структуре самих молекул. Однако они — идеальные «магниты», способные удерживать молекулы вместе, а значит, создавать супрамолекулярные конструкции.
Хотя π-дырки нельзя наблюдать непосредственно, квантово-химические расчеты позволяют визуализировать их через распределение электростатического потенциала, подобно тому, как тепловизор показывает невидимое ИК-излучение. Современные компьютерные программы помогают описать поведение электронов в молекуле. Конечно, точное аналитическое решение для многоэлектронных систем получить невозможно, но можно максимально к нему приблизиться. Это напоминает прогнозирование облаков в небе с помощью гидродинамических моделей — мы не покажем положение каждой молекулы воды в облаке, но довольно точно предскажем его плотность и форму.

Возьмем, к примеру, гексафторбензол (C6F6) и бензол (C6H6). У молекулы гексафторбензола низкая плотность (π-дырки) находится в центре ароматического кольца, а высокая плотность — на атомах фтора. В бензоле — наоборот, низкая плотность — на атомах водорода, а высокая — в центре бензольного кольца.
Долгое время π-дырки оставались сугубо теоретическим понятием, которое можно было изучать только с помощью компьютерных моделей. Однако прорыв в экспериментальных методах исследования позволил наконец непосредственно наблюдать эти электронные пустоты. Первыми увидели в эксперименте π-дырки в молекуле 9,10-дихлороктафторантрацена чешские ученые. Более того, они еще и продемонстрировали, что в незамещенном антрацене такой дырки нет. Результаты этих виртуозных экспериментов были опубликованы в Nature Communications (2023, 14).
Типы π-электронных пустот
Давайте теперь систематизируем наши знания и рассмотрим основные типы этих электронных пустот, которые определяют разнообразие их свойств и применений. Если говорить о типах, то их два. Первый — это π-дырки на атомах и на химических связях, второй — на ароматических системах.
Атомные π-дырки — это настоящие диковинки, они встречаются довольно редко и потому особенно интересны.
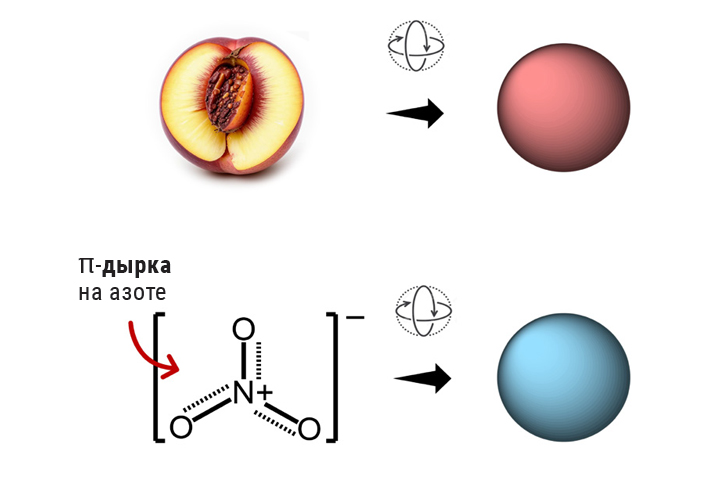
Если представить половинку персика, которая быстро вращается в разных направлениях, то мы увидим размытую красноватую сферу вместо четкой картинки с косточкой в центре. Точно так же в растворе свободно вращающийся в разных направлениях нитрат-анион NO3– кажется равномерно заряженной отрицательной частицей.
Однако в кристаллической структуре, где вращение ограничено, картина совсем иная. Как показывают теоретические расчеты, у нитрат-аниона в свободном состоянии действительно высокий отрицательный электростатический потенциал вокруг азота (–112 ккал/моль). Однако, когда атомы кислорода образуют водородные связи с тремя молекулами воды в кристалле, этот потенциал становится менее отрицательным (–75 ккал/моль), а в присутствии катиона лития и двух молекул воды в бисгидрате (LiNO3·2H2O) над и под атомом азота формируется область с положительным электростатическим потенциалом (+27 ккал/моль).
Обратите внимание, что электростатический потенциал отражает распределение зарядов в пространстве, а не формальный заряд на атомах. Последний как раз и приведен на рисунке выше. В обоих случаях существование π-дырок подтверждается не только расчетами, но и с помощью рентгеноструктурного анализа огромного массива кристаллов.
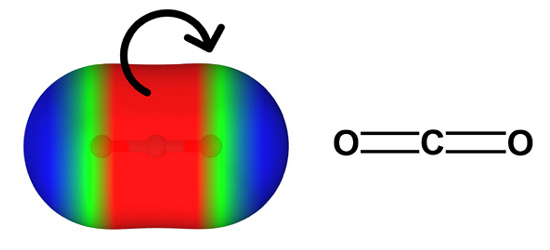
К атомным π-дыркам относятся и так называемые опоясывающие π-дырки. Они образуются на атомах углерода в линейном диоксиде углерода O=C=O (показан на рисунке), а также в его производных — карбодиимидах RN=C=NR и сероуглероде S=C=S. В этих случаях атомная π-дырка расположена перпендикулярно к фрагменту E=C=E и окружает весь атом.
Мы упомянули, что есть еще и π-дырки на химических связях. Если в тройных или двойных связях электроны перетекают к присоединенным электроноакцепторным группам (к атомам фтора, например), то над связью образуется π-дырка. Такие пустоты играют роль магнитов, благодаря которым молекулы притягиваются друг к другу в кристаллах, ведь природа, как и люди, не терпит пустоты.

Когда к двум соседним атомам присоединены мощные электроноакцепторные заместители (например, в тетрафторэтилене F2C=CF2 на рисунке), область положительного электростатического потенциала становится расширенной и занимает пространство не только над и под каждым из атомов углерода, но и между ними. Из-за короткого расстояния между соседними активированными атомами углерода (~1.20 A в производных ацетилена и ~1.34 A в производных этилена) донор электронной плотности будет естественным образом приближаться либо к атомам углерода, либо к самой связи. В таких случаях сложно определить, каким образом этот донор присоединен к π-дырке — через атом или через связь.
От простых колец к сложным системам
Простейшим и самым наглядным примером работы ароматических π-дырок служит система гексафторбензол-бензол. В 1960 году К. Р. Патрик и Дж. С. Проссер обнаружили удивительный факт: при смешивании двух жидкостей, гексафторбензола и бензола, образуется твердая фаза. Оказалось, что температура плавления нового соединения (23.7°C) гораздо выше, чем у смешанных веществ (5.0°C для гексафторбензола и 5.4°C для бензола). Сам факт взаимодействия между веществами, которые, казалось бы, не должны реагировать друг с другом, шокировал исследователей и оказался настолько значимым, что привел к незамедлительной публикации в журнале Nature в том же году. В основе явления лежат сильные межмолекулярные взаимодействия между π-дыркой гексафторбензола и электронно-обогащенной π-системой бензола.
Это не уникальный случай, есть и другие примеры. Например — взаимодействие гексафторбензола с мезитиленом. При соединении этих двух бесцветных жидкостей быстро образуется белый кристаллический осадок (т. пл. 34°C).
Что же при этом происходит? Можно заглянуть на эту молекулярную кухню? Можно. Рентгеноструктурный анализ полученных кристаллов показал, что молекулы гексафторбензола и мезитилена укладываются в упорядоченные стопки, чередуясь друг с другом. Это происходит благодаря взаимодействию между π-дыркой гексафторбензола и электронным облаком мезитилена.
Итак, мы рассмотрели три вида π-электронных пустот: атомные π-дырки, π-дырки на химических связях и ароматические π-дырки. Последние наиболее распространены и лучше всего изучены, поэтому именно они нашли применение. Так что всё предыдущее — это присказка, сказка будет впереди.
Направленная доставка лекарств
Наверное, все читатели знают, что большинство противораковых препаратов плохо различают опухолевые и здоровые клетки. Поэтому химиотерапия отравляет организм, из-за чего выпадают волосы и преследует тошнота. Исследователи во всем мире ищут способы, которые позволят ядовитому лекарству точно попасть в цель, никуда не отклоняясь на пути следования к ней.
И тут как нельзя кстати пришлись π-дырки, которые позволили китайским ученым создать концепцию π-зажимов (Nature Chemistry, 2016, 8).
Такой π-зажим — это небольшой структурный элемент, состоящий из четырех аминокислот: фенилаланин-цистеин-пролин-фенилаланин (Phe-Cys-Pro-Phe). Этот зажим присоединяют к антителу, которое представляет собой «белок-распознаватель» на службе у иммунной системы. Наш иммунитет, а именно В-лимфоциты, производит миллиарды разнообразных антител, каждое из которых прилипает к строго определенной цели — например к поверхности вируса или раковой клетки. Это прилипание антител привлекает к вирусу или к раковой клетке других участников иммунной системы, которые уничтожают помеченного неприятеля. Сами антитела, как и все белки, кодируются генами — ДНК-инструкциями, задающими последовательность их аминокислот. И эти гены в В-лимфоцитах можно модифицировать методами генной инженерии, чтобы они собирали белки с нужной нам вставкой Phe-Cys-Pro-Phe.
Само название «π-зажим» происходит от особой структуры этого фрагмента: атом серы цистеина буквально зажат между двумя ароматическими кольцами фенилаланина. Эта последовательность, встроенная в белок, действует как химический капкан. За счет π-дырочных взаимодействий он избирательно приманивает молекулы, содержащие перфторарильные группы, а затем прочно с ними сцепляется — об этом чуть позже.
Важно, что именно благодаря своему зажатому состоянию атом серы цистеина способен вступать в химическую реакцию, чего не могут все остальные тиольные группы, присутствующие в белке. Это делает π-зажим идеальным инструментом для селективного присоединения лекарств.

Как это работает? Противораковый препарат предварительно химически модифицируют, присоединяя к молекулам действующего вещества перфторарильную группу. При этом сохраняется терапевтическая активность лекарства, но появляется дополнительный участок молекулы, своего рода крючок, который будет прочно цепляться именно за π-зажим.
В результате формируется прочная ковалентная связь и образуется стабильный конъюгат антитело-лекарство, готовый к выполнению своей терапевтической функции. Это и есть система направленной доставки лекарств: антитело точно нацеливает на определенные клетки, например — раковые, π-зажим Phe-Cys-Pro-Phe надежно присоединяет лекарства к антителу, само же лекарство, как ему и положено, убивает раковую клетку. Из-за миниатюрного размера π-зажима (всего четыре аминокислоты) его не видит иммунная система, а сам зажим не влияет на функцию белка-носителя, то есть не сбивает прицел антитела на раковую клетку.
Эти π-зажимы представляют собой элегантное сочетание органической химии и белковой инженерии, которое может стать прорывом в терапии рака.
Светящиеся метки невозможно подделать
Мы детально обсудили, как в молекуле гексафторбензола шесть атомов фтора создают область с пониженной электронной плотностью — π-дырку, расположенную над и под плоскостью ароматического кольца. Это свойство перфторированных ароматических соединений оказалось ключом к созданию нового класса люминесцентных материалов, способных долго светиться при комнатной температуре.
Принцип их изготовления удивительно прост: нужно соединить две разные молекулы — перфторированную ароматическую молекулу, обладающую π-дыркой (подобно гексафторбензолу), и обычную ароматическую молекулу с электронно-обогащенной π-системой. При сокристаллизации эти молекулы самопроизвольно выстраиваются строго «лицом к лицу» на расстоянии около 3.5 A друг от друга. Эти межмолекулярные расстояния вдвое больше длины обычных ковалентных связей.
Почему же такие кристаллы способны к длительному свечению? Когда молекула поглощает свет, она переходит в возбужденное состояние, называемое синглетным: это как прыжок на более высокую энергетическую ступеньку. Обычно молекула быстро спрыгивает обратно в свое исходное состояние, испуская при этом свет, — это явление называется флуоресценцией и длится всего наносекунды.
Но иногда молекула может перейти в особое состояние, называемое триплетным. Оно маловероятное и «запрещенное» правилами квантовой механики, но тем не менее возможное. Молекуле, оказавшейся в триплетном состоянии, сложно вернуться в исходное (основное), потому что такой переход тоже запрещен. В результате молекула как бы застревает в возбужденном состоянии и светится гораздо дольше — от микросекунд до нескольких секунд, а иногда и даже после выключения источника возбуждения. Это свечение и называется фосфоресценцией.
Теперь снова вернемся к нашим перфторарен-а-реновым системам и примем к сведению, что атомы фтора в молекулах делают запрещенный переход в триплетное состояние более вероятным. При облучении кристалла мягким ультрафиолетовым светом (длина волны 365 нанометров, близкая к видимому свету) молекулы поглощают энергию и переходят в синглетное возбужденное состояние. В обычных условиях эта энергия рассеивается в виде тепла, но в данном случае из-за особой упаковки молекул и присутствия атомов фтора система впадает в долгоживущее триплетное состояние. Именно поэтому после выключения возбуждающего излучения кристалл продолжает светиться зеленым светом, как маленький фонарик.
Варьируя структуру перфторированных и обычных ароматических молекул, ученые создали целую серию подобных материалов. В некоторых системах свечение продолжается почти полсекунды после выключения УФ-источника — рекордное время для органических фосфоресцентных материалов при комнатной температуре.
Это явление используют для многоуровневой защиты документов и товаров от подделок. Фосфоресцентные материалы позволяют контролировать подлинность на нескольких уровнях: наличие характерного свечения, когда метку освещают ультрафиолетом, и послесвечения в течение определенного времени.
При этом можно создавать сложные узоры, используя несколько различных фосфоресцентных систем, которые в дневном свете выглядят однородными. Но если освещение выключить, то проявится сложный рисунок из областей с разным временем послесвечения. Такой эффект практически невозможно подделать без точного знания химического состава и условий кристаллизации каждого компонента. Сама же процедура контроля подлинности очень проста, для нее достаточно источника ультрафиолета и фотодетектора.

В качестве впечатляющих (по крайней мере, впечатляющих автора этой статьи) примеров вы видите на фотографиях две люминесцентные системы. На верхней, любезно предоставленной доктором химических наук И. В. Тайдаковым, отчетливо проявлятся свечение люминофора при ультрафиолетовом облучении. При дневном свете изображения не видно.

А на этой фотографии от член-корреспондента РАН В. П. Федина (большое спасибо ему и его сотрудникам) показано, как под воздействием ультрафиолета проявляется рукописная надпись, созданная с помощью двух отличных фосфоресцентных систем. При обычном свете надписи не видно.
Исследования в этой области активно продолжаются, и ученые работают над созданием материалов с еще более ярким и длительным свечением.
Сэндвичи наизнанку
Еще одно поле деятельности для π-дырок — молекулярная архитектура. Здесь электронные пустоты не просто модифицируют свойства веществ, но полностью переворачивают традиционные представления о структуре химических соединений.
Представьте молекулу, похожую на гамбургер: атом металла вместо котлеты, а плоские ароматические кольца вместо булочек. Это и есть сэндвичевые соединения. История этих молекул началась в 1951 году, когда Питер Посон и группа американских ученых независимо друг от друга синтезировали ферроцен — соединение, где атом железа зажат между двумя пятичленными углеродными кольцами. Джеффри Уилкинсон и Роберт Вудворд, увидев сходство с гамбургером, предложили термин «сэндвичевое соединение». Это открытие совершило революцию в химии, а Эрнст Отто Фишер и Джеффри Уилкинсон в 1973 году получили Нобелевскую премию за эти исследования.

В 1955 году Эрнст Отто Фишер и Вальтер Хафнер синтезировали дибензолхром — молекулу с атомом хрома между двумя бензольными кольцами, которая представлена на рисунке. Если ферроцен — это сэндвич с пятиугольными «булочками», то дибензолхром — с шестиугольными. В таких молекулах металл притягивает электроны от ароматических колец (кислотно-основное взаимодействие, по Льюису) и одновременно отдает часть своих электронов обратно. Этот химический диалог создает прочную связь с частично ковалентным характером.
Все это хорошо известно и описано в учебниках по металлоорганической химии, например в книге К. Эльшенбройха. Однако современные исследования предложили неожиданный поворот в понимании сэндвичевых структур. Речь идет об «обратных сэндвичах» (или, другими словами, «сэндвичах наизнанку»), которые образуются благодаря уникальным π-дырочным взаимодействиям.
Не так давно наша научная группа совместно с группой академика РАН Ю. Г. Горбуновой синтезировала и детально изучила уникальные супрамолекулярные ансамбли — обратные ареновые сэндвичевые структуры (Angewandte Chemie International Edition, 2019, 58). На рисунке представлена структура такого ассоциата, образованного за счет π-дырочного взаимодействия гексафторбензола с порфирином платины, точнее с выступающей за пределы поверхности dz2-орбиталью иона платины(II).
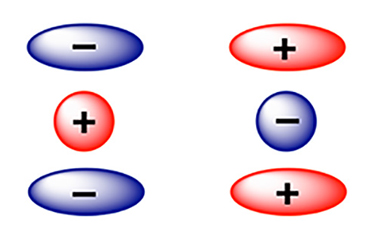
В этих ассоциатах все химические роли перевернуты с ног на голову. Если в классических сэндвичах металл выступает как электрофильный центр, принимающий электронную плотность от ароматических колец (на рисунке слева), то в наших обратных структурах положительно заряженный ион металла — платина(II) или палладий(II) — неожиданно играет роль нуклеофила за счет выступающих dz2-орбиталей положительно заряженных ионов (на рисунке справа)! Но как именно организованы эти необычные структуры и что делает их столь уникальными? Давайте рассмотрим их строение подробнее.
Такие соединения построены за счет взаимодействий между π-дырками перфтораренов и плоскими соединениями металлов с торчащими наружу dz2-орбиталями. Структурно эти молекулярные ансамбли напоминают не столько классический гамбургер, сколько деконструированный сэндвич (булочки внутри, а начинка снаружи), где ион MII располагается над ареном, образуя специфические нековалентные связи с π-дырками ароматической системы.
Как видите, π-дырочные взаимодействия возможны не только между ароматическими органическими молекулами, но и между электронодефицитными органическими молекулами и металлоорганическими плоскими системами.
Более того, оказалось, что при соединении фосфоресцентных соединений платины с фторированными ароматическими молекулами образуются уникальные структуры, где происходит особое взаимодействие между электронодефицитной π-дыркой фторированных ароматических молекул и богатым электронами центром иона платины. Это взаимодействие, в основном электростатическое по природе, усиливает люминесценцию: яркость (или, более строго, квантовый выход) увеличивается до 3,5 раза, а время жизни свечения — до 15 раз. Эти результаты, полученные А. В. Рожковым в нашей лаборатории, открывают новые возможности для разработки фосфоресцентных материалов, которые могут найти применение в органических светодиодах, сенсорах и других оптоэлектронных устройствах.
Когда молекулы выстраиваются по команде
В обычной жидкости молекулы, как и люди в толпе, движутся хаотично, сталкиваясь друг с другом и меняя свое положение. В кристалле же молекулы выстроены в идеальном порядке, как зрители в заполненном кинозале, — каждый на своем месте и строго лицом к затылку соседа. А между этими крайностями существует удивительное промежуточное состояние — когда молекулы выстраиваются по команде, сохраняя способность двигаться, но подчиняясь определенному порядку. Это состояние вещества называется жидким кристаллом.
И здесь π-дырки тоже сказали свое слово. В отличие от обычных жидких кристаллов, где молекулы удерживаются вместе слабыми силами (как слабые магниты, едва притягивающиеся друг к другу), в новых материалах используется сила π-дырочных взаимодействий — гораздо более мощный «магнит».
Жидкие кристаллы окружают нас повсюду — они используются в экранах наших телефонов, ноутбуков и телевизоров. В большинстве случаев это сложные органические молекулы, похожие по форме на стержни или диски, которые могут выстраиваться параллельно друг другу. Когда свет проходит через такой упорядоченный слой молекул, его поляризация изменяется определенным образом. А если приложить электрическое поле, молекулы повернутся, изменив свою ориентацию, — и свет начнет проходить иначе. Добавив поляризационные фильтры и цветные светофильтры, можно управлять тем, какой свет и в каком месте экрана будет проходить — так и формируется изображение.
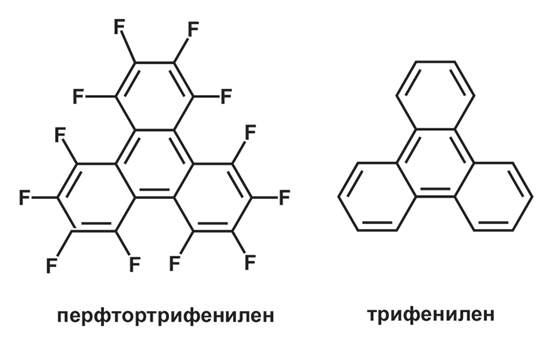
Вот пример такой системы. Ученые взяли две молекулы — перфторотрифенилен и его нефторированный аналог с дополнительными группами-заместителями. При температуре выше 250°C эти вещества существуют в виде обычной жидкости, в которой молекулы движутся и вращаются совершенно хаотично, как люди в толпе на концерте. При постепенном охлаждении до 250°C система переходит в особое состояние — жидкий кристалл. В этом состоянии молекулы, хотя еще и сохраняют некоторую подвижность, выстраиваются в упорядоченные колонки за счет π-дырочных взаимодействий между фторированными и нефторированными частями молекул.
Самое удивительное в этой системе то, что жидкокристаллическая фаза существует в необычно широком температурном интервале — около 160°C (от 250 до 90.8°C). Это, как если бы мороженое оставалось в полурастаявшем состоянии не несколько минут, а несколько часов! Для сравнения: большинство обычных жидких кристаллов сохраняют свои свойства в гораздо более узком диапазоне — обычно 20–40°C.
Почему же эта система так устойчива? Все дело в особом балансе сил. Так, π-дырочные взаимодействия создают что-то вроде молекулярного конструктора, где каждая деталь может соединиться с соседними несколькими способами. Помимо самих π-дырочных взаимодействий молекулы могут образовывать дополнительные связи: водородные связи между атомами водорода и фтора (CH...F) и контакты между атомами фтора (F...F). Получается своеобразная молекулярная демократия — множество почти равноценных способов упаковки молекул (помимо упаковки типа «лицом к лицу») конкурируют между собой, не давая системе быстро превратиться в обычный кристалл.
Особенно интересно то, что этими молекулами можно командовать, как солдатами на параде, с помощью электрического поля. Приложили напряжение — и молекулы повернулись в одну сторону, изменили напряжение — и они перестроились иначе. При этом благодаря сильным π-дырочным взаимодействиям молекулы реагируют на команды быстрее и точнее, чем в обычных жидких кристаллах. А когда электрическое поле убирают, π-дырочные взаимодействия, как надежные пружины, возвращают молекулы в исходное положение.
Исследования таких необычных жидких кристаллов активно продолжаются. Ученые ищут новые комбинации молекул, способные формировать подобные системы. Это не только помогает лучше понять, как молекулы самоорганизуются в сложные структуры, но и открывает путь к созданию новых материалов для экранов, сенсоров и других устройств будущего.
Сила пустоты
В этой статье мы совершили путешествие в удивительный мир π-дырок — областей электронного вакуума в молекулах, играющих колоссальную роль в химии, биологии и материаловедении. Парадоксально, но именно эти пустоты становятся источником направленных взаимодействий. Если традиционно химическая связь ассоциируется с насыщенностью электронами, то π-дырочные взаимодействия демонстрируют противоположный принцип — здесь связующим звеном выступает именно пустота.
«Пустота. Но при мысли о ней / видишь вдруг как бы свет ниоткуда». Эти строки И. Бродского удивительно точно отражают суть π-дырочных взаимодействий: там, где, казалось бы, ничего нет, где лишь одна электронная пустота, вдруг рождается мощная сила, способная стать источником нового света, будь то люминесцентное свечение материалов или метафорический свет новых научных открытий. Из кажущейся пустоты рождается удивительная архитектура молекулярных взаимодействий. Отдельные π-дырочные взаимодействия кажутся слабыми, но вместе эти электронные пустоты образуют мощную силу, создающую уникальные материалы и структуры — от фосфоресцентных меток до систем доставки лекарств, от жидких кристаллов до сэндвичей наизнанку.
Исследования этих молекулярных пустот активно продолжаются, открывая новые направления в солнечной энергетике, сенсорике и квантовых материалах. Эти невидимые пустоты существовали всегда, но лишь с развитием современных методов исследования мы осознали их фундаментальное значение в архитектуре молекулярного и супрамолекулярного мира. И действительно, при мысли о них мы видим свет ниоткуда — свет новых возможностей и открытий.
Научные результаты, частично представленные в данной статье, были получены при поддержке Российского научного фонда (гранты 20-13-00144 и 23-13-00033).
-
Раньше это называлось комплексами с переносом заряда, например хингидрон. А сейчас поди тыж - пидырки!
В 1973 году было обнаружено, что комбинация тетрацианохинодиметана (TCNQ) и тетратиафульвалена (TTF) образует прочный комплекс с переносом заряда, называемый TTF-TCNQ . Это твердое вещество демонстрирует почти металлическую электропроводность и было первым обнаруженным чисто органическим проводником .
Избранное








































Фото автора