Разнообразие и распространение вирусов клещевого энцефалита Балтийской группы
Андрей Девяткин, Сергей Бугмырин, Юлия Вакуленко, Александр Лукашёв, Галина Карганова
«Природа» №6, 2021
Клещевой энцефалит — это вирусная инфекция, в результате которой возможны тяжелые поражения центральной нервной системы [1]. К развитию этого заболевания приводит инфицирование вирусом клещевого энцефалита (ВКЭ). Заражают им человека чаще всего клещи рода Ixodes (рис. 1). Заметим, они переносят возбудителей не только клещевого энцефалита, но и болезни Лайма (бактерий рода Borrelia), анаплазмоза (бактерий рода Anaplasma) и др. Вирус клещевого энцефалита — опасный арбовирус1, широко распространенный в Северной Евразии, причем ареал этого патогена со временем меняется.

Ежегодно на территории Европейского Союза и России выявляют примерно 3.5–5 тыс. случаев клещевого энцефалита [2]. Интересно, что заражение вирусом не всегда приводит к развитию болезни; доля не вакцинированных людей, обладающих антителами к ВКЭ, бывает очень высокой. Так, примерно 10% образцов биоматериала от не вакцинированных пациентов, полученного в Чехии и Швеции [3, 4], и около 50% — в Свердловской области [5], были сероположительными (т. е. в крови были обнаружены антитела к ВКЭ).
ВКЭ все чаще обнаруживают на территориях, которые раньше считались свободными от этой инфекции. В 2016 г. в черте Москвы, в микрорайоне Крылатское, нашли зараженного клеща [6]. Недавно впервые за долгое время патоген обнаружили в Великобритании [7], Дании [8], Боснии [9], Нидерландах [10], Австрии [11], Молдове [12].
В 2008–2018 гг. мы собрали в Карелии клещей и выделили из них ВКЭ [13]. После этого отсеквенировали фрагменты их геномов. Ожидалось, что эти последовательности будут очень похожи. Но оказалось, что разнообразие вирусов балтийской группы (Балт-ВКЭ), идентифицированных в окрестности одной карельской деревни, сопоставимо с разнообразием этой группы на огромной территории от Финляндии на западе до Челябинской области на востоке. Как это объяснить?
Разнообразие и распространение
Двадцать лет назад ВКЭ разделили на три основных субтипа, которые назвали согласно известному на тот момент географическому распространению: европейский, сибирский и дальневосточный [14]. Действительно сибирский субтип чаще всего находят в Сибири, европейский в Европе, дальневосточный — на Дальнем Востоке, однако нередко вирусы встречаются и в не соответствующих им регионах [15]. Так, ВКЭ европейского субтипа кроме Европы распространены в Южной Корее [16], на Алтае, в Иркутской области. Представителей сибирского субтипа можно обнаружить в Скандинавии [17], Прибалтике [18], Боснии [19], Средней Азии [20, 21] и на Сахалине [22]. Вирусы дальневосточного субтипа описаны на юге Сибири, на Урале, в Прибалтике и Молдавии [12]. В Крыму найдены все три основных субтипа ВКЭ.
Сибирский субтип состоит из нескольких подгрупп вирусов [9]. В 2000-х годах на территории Финляндии, Эстонии и Латвии обнаружили вирусы, формирующие отдельную подгруппу этого субтипа [18, 23–25]. Вскоре представителей этой балтийской подгруппы ВКЭ-Сиб (Балт-ВКЭ-Сиб) нашли на территории Ярославской, Вологодской, Ленинградской, Свердловской, Курганской областей и республики Карелия (рис. 2) [17, 26–28].

Основным переносчиком ВКЭ-Сиб считают таежного клеща (Ixodes persulcatus) [29]. С ним можно встретиться на широких просторах евразийской тайги от Японии на востоке до Скандинавии на западе. В Карелии случаи заболевания человека клещевым энцефалитом регистрируют с 1957 г. [30]. В 2000-х годах ареал I. persulcatus расширился: клещей этого вида стали находить в тех районах Карелии, где раньше не регистрировали. Кроме того, численность популяции иксодовых клещей увеличилась, что совпало с ростом заболеваемости людей [31, 32]. С 2004 г. I. persulcatus находят в Финляндии [23], где этот вид стал повсеместно распространенным [33, 34]. В 2015 г. таких клещей впервые обнаружили в Швеции [35]. Таким образом, территория распространения основного переносчика ВКЭ-Сиб с каждым годом увеличивается.
В поисках родства с Балт-ВКЭ-Сиб
Двенадцать лет назад в нескольких километрах севернее Петрозаводска обнаружили зараженных ВКЭ клещей. Благодаря филогенетическому анализу нуклеотидных последовательностей фрагментов генома этих вирусов стало понятно, что ВКЭ-Сиб распространен на юге Карелии [17]. Были отсеквенированы фрагменты вирусного генома (Е-гены2) 10 изолятов из найденных там клещей: одного — в Петрозаводске, восьми — в деревне Гомсельга (37 км к северу от Петрозаводска) и еще одного — в деревне Педасельга (33 км к югу от Петрозаводска) [13]. Мы ожидали, что все эти вирусы произошли от одного общего предка, который относительно недавно появился в Карелии. После анализа нуклеотидных последовательностей эта гипотеза была отвергнута. Среди геномных последовательностей восьми изолятов из Гомсельги нашли отличия вплоть до 4.8% нуклеотидов, что сопоставимо с разнообразием всех представителей Балт-ВКЭ-Сиб. Отметим, что в геноме ВКЭ за 10 лет меняется примерно 0.1–0.2% нуклеотидов [15, 27, 36].
Места сбора клещей, в которых когда-либо находили представителей группы Балт-ВКЭ-Сиб, формально разделили на пять географических регионов: Эстония и Латвия (n=11); Финляндия (n=14); Ленинградская и Архангельская области, республика Карелия (n=14); Вологодская и Ярославская области (n=25); Свердловская и Курганская области (n=7).
Родство всех известных Балт-ВКЭ-Сиб представлено на филогенетическом древе (рис. 3). Видно, что ближайшие друг к другу последовательности могут быть получены в разных регионах. Например, четыре изолята из Курганской области (идентификационные номера последовательностей #FJ214128–FJ2141313) практически не отличались от ВКЭ из Вологодской области (#FJ214153): 1053 из 1054 нуклеотидов совпали. В то же время изоляты из одной местности могут быть филогенетически дальними. Например, ВКЭ из деревни Гомсельга (республика Карелия) вошли в состав трех разных групп, для каждой из которых были свои «ближайшие родственники».

Рис. 3. Филогенетическое древо, которое показывает взаимоотношения между Балт-ВКЭ-Сиб из разных географических регионов [13]
Распределение попарных генетических расстояний показывает разнообразие Балт-ВКЭ-Сиб как в каждом из пяти отдельно взятых регионов, так и на всей территории распространения патогена. При построении диаграмм составили список всех возможных пар последовательностей для каждой выборки. Для каждой пары последовательностей посчитали генетические расстояния. Здесь генетические расстояния рассчитывали, как долю несовпадающих нуклеотидов в последовательностях ге-номов разных изолятов. Для визуализации распределения такой меры филогенетической близости построили гистограммы (рис. 4). Оказалось, что вовсех шести выборках генетическое разнообразие сопоставимо. Пара самых непохожих сиквенсов, #MT424736 (Гомсельга, республика Карелия, Россия) и #DQ451293 (муниципалитет Коккола, Финляндия), различались в 5.6% нуклеотидов. В то же время последовательности #MT889225 (Петрозаводск, республика Карелия, Россия) и #MT424736 (Гомсельга, республика Карелия, Россия) содержат 5.2% различий. Более того, последовательности двух изолятов из одной деревни Гомсельга (#MT424746 и #MT424737) различались между собой в 4.5% нуклеотидов.
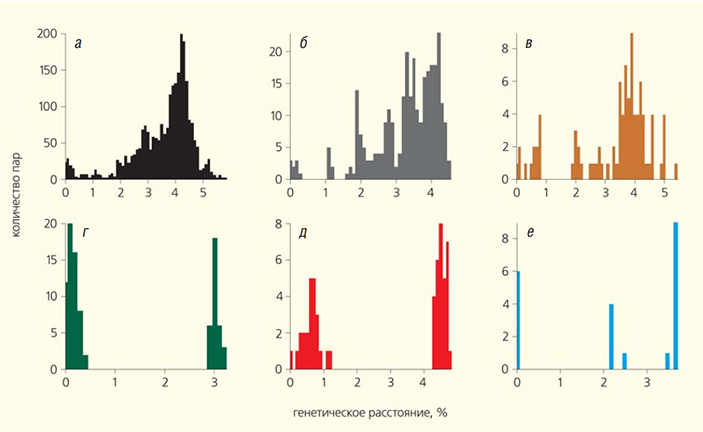
Рис. 4. Попарные эволюционные расстояния: а — для всех представителей Балт-ВКЭ-Сиб (n = 71); б — Балт-ВКЭ-Сиб из Вологодской и Ярославской областей (n = 25); в — Балт-ВКЭ-Сиб из республики Карелия, Ленинградской и Архангельской обласетй (n = 14); г — Балт-ВКЭ-Сиб из Финляндии (n = 14); д — Балт-ВКЭ-Сиб из Эстонии и Латвии (n = 11); е — Балт-ВКЭ-Сиб из Свердловской и Курганской областей (n = 7) [13]
Для дальнейшего анализа филогеографических закономерностей эволюции ВКЭ мы визуализировали зависимость между попарными генетическими и географическими расстояниями (рис. 5). В случае постепенного распространения вируса можно было ожидать связь между генетическими и географическими расстояниями, которая может привести к линейному тренду (точки в черном эллипсе на рис. 5). Несколько точек (ограничены зеленой линией на рис. 5) представляют генетически близкие вирусы, изолированные в географически удаленных местах. Такие точки свидетельствуют о перемещениях на расстояние более 1500 км. Вирусы с почти идентичными или очень похожими последовательностями, собранные в регионах, которые разделены тысячами километров, вероятно, были завезены на новые территории недавно. Интересно, что значительно большее количество пар вирусов (выделено оранжевыми линиями на рис. 5) были генетически разнообразны, но географически близки. Поскольку генетические расстояния ВКЭ внутри регионов и между ними сопоставимы, эти точки скорее всего отражают перемещение вирусов между отдаленными регионами, а не обширную диверсификацию внутри региона. Также следует отметить, что меньшая часть точек на рис. 5 укладывается в линейный тренд, но это вполне может быть совпадением. Поэтому Балт-ВКЭ-Сиб распространялся скорее прыжками на дальние дистанции, чем постепенно.

Рис. 5. Тепловая карта соответствия между генетическими и географическими попарными расстояниями для Балт-ВКЭ-Сиб [13]. Каждая точка на карте соответствует паре вирусов. По оси ординат показано процентное соотношение различных нуклеотидов в исследуемом фрагменте Е-гена (1054 нуклеотида) между двумя вирусами, тогда как расстояние (в км) между местами сбора хозяев для этой пары показано на оси абсцисс. Плотность встречаемости обозначена цветом на легенде. Цветные линии указывают на предполагаемые события распространения вируса, обсуждаемые в тексте
В пяти регионах Евразии
Системное разнообразие вирусов могло сформироваться за сотни лет независимой эволюции в каждом отдельно взятом регионе. Тем не менее этой гипотезе противоречит то, что в географически далеких локациях находят вирусы с практически идентичными последовательностями генома (см. рис. 3). Таким образом, вероятнее всего, происходили множественные независимые переносы Балт-ВКЭ-Сиб на дальние расстояния между разными регионами. Клещи не могут самостоятельно далеко мигрировать. Но такие миграции возможны при помощи человека (антропогенный фактор) или другого животного (зоонозный фактор). Известная территория распространения Балт-ВКЭ-Сиб (см. рис. 2) накладывается на три экологических региона (согласно классификации Всемирного фонда дикой природы): сарматский смешанный лес, скандинавская и российская тайга, тундра и тайга Уральских гор. Российские регионы, расположенные между Свердловской и Ярославской областями (например, Кировская область или Удмуртская республика), принадлежат к этим экологическим зонам и входят в список эндемичных по клещевому вирусному энцефалиту территорий. Район включают в такой список, если там регулярно регистрируют случаи заболевания человека ВКЭ и находят возбудителя инфекции в клещах. Например, 36 из 160 (22.5%) клещей, собранных в Кировской области в 2016 г., были заражены ВКЭ [37]. К сожалению, в открытом доступе есть всего две последовательности фрагментов генома патогена из Кировской области. Оба изолята — представители другой подгруппы Сибирского субтипа [15]. Таким образом, естественное ограничение нашей работы — это фрагментарность знаний о реальном распространении Балт-ВКЭ-Сиб.
Кроме обозначенных районов I. persulcatus (напомним, основной переносчик Балт-ВКЭ-Сиб) распространен в Сибири и на Дальнем Востоке. Если бы зараженные патогеном клещи случайно переносились людьми, то системного разнообразия Балт-ВКЭ-Сиб не наблюдалось бы. Кроме того, в этом случае патоген можно было бы обнаружить в других экологических регионах, где встречается I. persulcatus — ареал этих клещей существенно шире известных зон распространения Балт-ВКЭ-Сиб. Отметим, что более половины всех известных последовательностей генома ВКЭ получены в Приморье и в Новосибирской области, а также Иркутской. Разнообразие ВКЭ в этих регионах хорошо изучено с точки зрения числа отсеквенированных вирусов. Кроме того, Владивосток, Новосибирск и Иркутск — крупные инфраструктурные центры. При антропогенном распространении представителей группы Балт-ВКЭ-Сиб можно было бы обнаружить в Сибири и на Дальнем Востоке. Тем не менее ни один из примерно 500 отсеквенированных вирусов с этих территорий не принадлежал к Балт-ВКЭ-Сиб.
Согласно актуальным данным, ареал Балт-ВКЭ-Сиб ограничен смешанным лесом и тайгой северо-восточной Европы, а также окрестностями Уральских гор. Такое распространение может быть объяснено вовлечением в жизненный цикл патогена дополнительного животного, чей ареал совпадает с обозначенными экологическими зонами. Если вирус способен размножаться (реплицироваться) в этом «хозяине», то животное — дополнительный переносчик ВКЭ. Иными словами, животное распространяет вирус не напрямую, а путем транспортировки зараженных клещей. Наиболее правдоподобным объяснением активного перемешивания зараженных разными вариантами Балт-ВКЭ-Сиб клещей можно считать вовлечение в жизненный цикл клеща и/или вируса летающего животного.
Мы сформулировали несколько тезисов, вытекающих из нашего исследования:
— известный ареал Балт ВКЭ-Сиб совпадает с тремя экологическими регионами;
— I. persulcatus, основной переносчик ВКЭ-Сиб, распространен на обширной территории (от Швеции на западе до Японии на востоке) [38];
— Балт-ВКЭ-Сиб не обнаружен в Сибири и на Дальнем Востоке, где разнообразие ВКЭ хорошо изучено;
— Балт-ВКЭ-Сиб — «хорошо перемешанная» популяция вирусов со сравнимым разнообразием в каждом регионе.
Похоже, что какое-то летающее животное, способное переносить клещей, выступает в качестве важного звена в циркуляции Балт-ВКЭ-Сиб. Последний общий предок этой группы вирусов существовал сотни лет назад [15]. Если представители Балт-ВКЭ-Сиб способны распространяться без участия мигрирующего в пределах ограниченного ареала животного, то, вероятнее всего, существовали бы следы заносов патогена в Сибирь, чего не наблюдается. Эта группа патогенов характеризуется системными переносами вируса (или зараженных клещей) при помощи животного на дальние расстояния в пределах сарматского смешанного леса, скандинавской и российской тайги, тундры и тайги Уральских гор. Отметим, что предположение о возможности репликации ВКЭ напрямую в летающем животном спекулятивно и требует экспериментального подтверждения.
Существует две группы позвоночных животных, которые могут переносить клещей при полете: летучие мыши [39–41] и птицы [42–47]. Несмотря на то, что по сравнению с птицами летучие мыши мигрируют в среднем на меньшие дистанции [48], дальние перелеты у этих млекопитающих тоже возможны [49–51], хотя и менее вероятны. Роль летучих мышей в распространении ВКЭ сегодня неизвестна. Это может быть вызвано отсутствием актуальных исследований, в которых образцы биоматериала летучих мышей исследовали бы на предмет присутствия ВКЭ. По нашим сведениям, такие работы проводились более сорока лет назад [52–54]. Тем не менее летучие мыши в разной степени вовлечены в циркуляцию некоторых других флавивирусов (вирусов денге, желтой лихорадки, западного Нила, Зика, Усуту, энцефалита Сент-Луис, заболевания леса Кясанур, японского энцефалита) [55]. Учитывая, что летучие мыши могут переносить клещей, нельзя исключать роль этих млекопитающих в распространении Балт-ВКЭ-Сиб.

Рис. 6. Западный подвид зеленой пеночки — возможный переносчик возбудителя клещевого энцефалита Балт-ВКЭ-Сиб. Фото Amano Samarpan
Клещи, кормящиеся на птицах, бывают заражены ВКЭ [56, 57]. Кроме того, маркеры ВКЭ (вирусная РНК и антиген) [44] или антитела к ВКЭ [58] можно обнаружить непосредственно в биоматериале, полученном от птиц. Это значит, что птицы, вероятно, вовлечены в распространение ВКЭ, в частности изучаемой нами балтийской группы. К примеру, зона распространения Балт-ВКЭ-Сиб чуть меньше обширного ареала представителя отряда воробьинообразных — западного подвида зеленой пеночки (Phylloscopus trochiloides viridanus) [59]. Эта певчая птица (рис. 6) широко распространена на всем протяжении своего гнездового ареала (от Западной Сибири до северо-востока Европы) и ежегодно мигрирует на зимовку в Индию. Тем не менее, чтобы однозначно подтвердить предположение об активном участии западного подвида зеленой пеночки, как и любого другого летающего животного, в циркуляции Балт-ВКЭ-Сиб, требуются дальнейшие полевые исследования.
***
Ограниченный ареал Балт-ВКЭ-Сиб совпадает с активным перемешиванием вирусов между удаленными друг от друга регионами. Это может быть следствием активного распространения ВКЭ летающим животным. Вероятнее всего, это птица, обитающая в пределах сарматского смешанного леса, скандинавской и российской тайги, тундры и тайги Уральских гор. Распространение ВКЭ может происходить опосредованно (при переносе зараженного клеща) или напрямую, если вирус способен размножаться в организме летающего животного.
Работа выполнена при поддержке Российского научного фонда (проект 19-75-00013).
Литература:
1. Ruzek D., Zupanc T.A., Borde J. et. al. Tick-borne encephalitis in Europe and Russia: Review of pathogenesis, clinical features, therapy, and vaccines. Antiviral Research. 2019; 164: 23–51. DOI:10.1016/j.antiviral.2019.01.014.
2. Beauté J., Spiteri G., Warns-Petit E. et. al. Tick-borne encephalitis in Europe, 2012 to 2016. Euro Surveill. 2018; 23(45): pii=1800201. DOI:10.2807/1560-7917.ES.2018.23.45.1800201.
3. Kriz B., Hubalek Z., Marek M. et al. Results of the screening of tick-borne encephalitis virus antibodies in human sera from eight districts collected two decades apart. Vector-Borne and Zoonotic Diseases. 2015; 15(8): 489–493. DOI:10.1089/vbz.2014.1747.
4. Stjernberg L., Holmkvist K., Berglund J. A newly detected tick-borne encephalitis (TBE) focus in south-east Sweden: A follow-up study of TBE virus (TBEV) seroprevalence. Scandinavian Journal of Infectious Diseases. 2008; 40: 4–10. DOI:10.1080/00365540701522934.
5. Maikova G.B., Chernokhaeva L.L., Rogova Yu.V. et al. Ability of inactivated vaccines based on far-eastern tick-borne encephalitis virus strains to induce humoral immune response in originally seropositive and seronegative recipients. J. Med. Virol. 2019; 91: 190–200. DOI:10.1002/jmv.25316.
6. Makenov M., Karan L., Shashina N. et. al. First detection of tick-borne encephalitis virus in Ixodes ricinus ticks and their rodent hosts in Moscow, Russia. Ticks Tick Borne Dis. 2019; 10(6): 101265. DOI:10.1016/j.ttbdis.2019.101265.
7. Holding M., Dowall S.D., Medlock J.M. et. al. Tick-borne encephalitis virus, United Kingdom. Emerg. Infect. Dis. 2020; 26(1): 90–96. DOI:10.3201/eid2601.191085.
8. Agergaard Ch.N, Rosenstierne M.W., Bødker R. et. al. New tick-borne encephalitis virus hot spot in Northern Zealand, Denmark, October 2019. Euro Surveill. 2019; 24(43): pii=1900639. DOI:10.2807/1560-7917.ES.2019.24.43.1900639.
9. Tkachev S.E., Babkin I.V., Chicherina G.S. et. al. Genetic diversity and geographical distribution of the Siberian subtype of the tick-borne encephalitis virus. Ticks Tick Borne Dis. 2020; 11(2): 101327. DOI:10.1016/j.ttbdis.2019.101327.
10. Dekker M., Laverman G.D., de Vries A. et al. Emergence of tick-borne encephalitis (TBE) in the Netherlands. Ticks Tick Borne Dis. 2019; 10(1): 176–179. DOI:10.1016/j.ttbdis.2018.10.008.
11. Heinz F.X., Stiasny K., Holzmann H. et. al. Emergence of tick-borne encephalitis in new endemic areas in Austria: 42 years of surveillance. Euro Surveill. 2015; 20(13): pii=21077. DOI:10.2807/1560-7917.ES2015.20.13.21077.
12. Ponomareva E.P., Mikryukova T.P., Gori A.V. et al. Detection of Far-Eastern subtype of tick-borne encephalitis viral RNA in ticks collected in the Republic of Moldova. J. Vector Borne Dis. 2015; 52(4): 334–336.
13. Deviatkin A.A., Kholodilov I.S., Belova O.A. et. al. Baltic group tick-borne encephalitis virus phylogeography: systemic inconsistency pattern between genetic and geographic distances. Microorganisms. 2020; 8(10): 1589. DOI:10.3390/microorganisms8101589.
14. Ecker M., Allison S.L., Meixner T. et al. Sequence analysis and genetic classification of tick-borne encephalitis viruses from Europe and Asia. J. Gen. Virol. 1999; 80(1): 179–185. DOI:10.1099/0022-1317-80-1-179.
15. Deviatkin A.A., Kholodilov I.S., Vakulenko Yu.A. et al. Tick-Borne Encephalitis Virus: An Emerging Ancient Zoonosis? Viruses. 2020; 12(2): 247. DOI:10.3390/v12020247.
16. Yoshii K., Song J.Y., Park S.B. et al. Tick-borne encephalitis in Japan, Republic of Korea and China. Emerg. Microbes Infect. 2017; 6(9): e82. DOI:10.1038/emi.2017.69.
17. Jaaskelainen A.E., Sironen T., Murueva G.B. et. al. Tick-borne encephalitis virus in ticks in Finland, Russian Karelia and Buryatia. J. Gen. Virol. 2010; 91(11): 2706–2712. DOI:10.1099/vir.0.023663-0.
18. Golovljova I., Vene S., Sjцlander K.B. et. al. Characterization of tick-borne encephalitis virus from Estonia. J. Med. Virol. 2004; 74(4): 580–588. DOI:10.1002/jmv.20224.
19. Tkachev S.E., Babkin I.V., Chicherina G.S. et. al. Genetic diversity and geographical distribution of the Siberian subtype of the tick-borne encephalitis virus. Ticks Tick Borne Dis. 2020; 11(2): 101327. DOI:10.1016/j.ttbdis.2019.101327.
20. Muto M., Bazartseren B., Tsevel B. et. al. Isolation and characterization of tick-borne encephalitis virus from Ixodes persulfates in Mongolia in 2012. Ticks Tick Borne Dis. 2015; 6(5): 623–629. DOI:10.1016/j.ttbdis.2015.05.006.
21. Briggs B.J., Atkinson B., Czechowski D.M. et. al. Tick-borne encephalitis virus, Kyrgyzstan. Emerg. Infect. Dis. 2011; (5): 876–879. DOI:10.3201/eid1705.101183.
22. Пуховская Н.М., Морозова О.В., Белозерова Н.Б. и др. Сравнительный анализ геномов штаммов вируса клещевого энцефалита, выделенных от комаров и клещей. Вопросы вирусологии. 2017; 62(1): 30–35.
23. Jaaskelainen A., Tikkakoski T., Uzcategui N. et. al. Siberian subtype tick-borne encephalitis virus, Finland. Emerg. Infect. Dis. 2006; 12(10): 1568–1571. DOI:10.3201/eid1210.060320.
24. Golovljova I., Katargina O., Geller J. et. al. Unique signature amino acid substitution in Baltic tick-borne encephalitis virus (TBEV) strains within the Siberian TBEV subtype. Int. J. Med. Microbiol. 2008; 298: 108–120. DOI:10.1016/j.ijmm.2007.12.004.
25. Lundkvist A., Vene S., Golovljova I. et. al. Characterization of tick-borne encephalitis virus from latvia: Evidence for co-circulation of three distinct subtypes. J. Med. Virol. 2001; 65(4): 730–735. DOI:10.1002/jmv.2097.
26. Khasnatinov M.A., Ustanikova K., Frolova T.V. et. al. Non-Hemagglutinating Flaviviruses: Molecular Mechanisms for the Emergence of New Strains via Adaptation to European Ticks. PLoS ONE. 2009; 4: e7295. DOI:10.1371/journal.pone.0007295.
27. Kovalev S.Yu., Chernykh D.N., Kokorev V.S. et al. Origin and distribution of tick-borne encephalitis virus strains of the Siberian subtype in the Middle Urals, the north-west of Russia and the Baltic countries. J. Gen. Virol. 2009; 90(12): 2884–2892. DOI:10.1099/vir.0.012419-0.
28. Погодина В.В., Карань Л.С., Колясникова Н.М. и др. Эволюция клещевого энцефалита и проблема эволюции возбудителя. Вопросы вирусологии. 2007; 52(5): 16–21.
29. Labuda M., Nuttall P.A. Tick-borne viruses. Parasitology. 2004; 129(51): S221–S245. DOI:10.1017/S0031182004005220.
30. Kovalenko A.I., Rubis L.V., Ekimova O.V. et al. Natural foci infections in Republic of Karelia. EpiNorth. 2003; 4: 3–4.
31. Bugmyrin S.V., Bespyatova L.A., Korotkov Yu.S. Long-term dynamics of Ixodes persulcatus (Acari: Ixodidae) abundance in the north–west of its range (Karelia, Russia). Exp Appl Acarol. 2019; 77: 229–240. DOI:10.1007/s10493-019-00342-y.
32. Bugmyrin S.V., Bespyatova L.A., Korotkov Yu.S. et. al. Distribution of Ixodes ricinus and I.persulcatus ticks in southern Karelia (Russia). Ticks Tick Borne Dis. 2013; 4, 57-62. DOI:10.1016/j.ttbdis.2012.07.004.
33. Laaksonen M., Sajanti E., Sormunen J.J. et. al. Crowdsourcing-based nationwide tick collection reveals the distribution of Ixodes ricinus and I.persulcatus and associated pathogens in Finland. Emerg. Microbes Infect. 2017; 6(1): 1–7. DOI:10.1038/emi.2017.17.
34. Sormunen J.J., Andersson T., Aspi J. et. al. Monitoring of ticks and tick-borne pathogens through a nationwide research station network in Finland. Ticks Tick Borne Dis. 2020; 11(5): 101449. DOI:10.1016/j.ttbdis.2020.101449.
35. Jaenson T.G.T., Värv K., Fröjdman I. et. al. First evidence of established populations of the taiga tick Ixodes persulcatus (Acari: Ixodidae) in Sweden. Parasites Vectors. 2016; 9: 377. DOI:10.1186/s13071-016-1658-3.
36. Tkachev S.E., Chicherina G.S., Golovljova I. et. al. New genetic lineage within the Siberian subtype of tick-borne encephalitis virus found in Western Siberia, Russia. Infection, Genetics and Evolution. 2017; 56: 36–43. DOI:10.1016/j.meegid.2017.10.020.
37. Бессолицына Е.А., Волков С.А., Столбова Ф.С. Динамика зараженности бактериями рода Borrelia и вирусом клещевого энцефалита клещей, собранных в Кировской области. Инфекция и иммунитет. 2017; 7(2):171–180. DOI:10.15789/2220-7619-2017-2-171-180.
38. Margos G., Fingerle V., Reynolds S. Borrelia bavariensis: vector switch, niche invasion, and geographical spread of a tick-borne bacterial parasite. Front. Ecol. Evol. 2019; 7: 401. DOI:10.3389/fevo.2019.00401.
39. Lv J., Fernбndez de Marco M.d.M., Goharriz H. et. al. Detection of tick-borne bacteria and babesia with zoonotic potential in Argas (Carios) vespertilionis (Latreille, 1802) ticks from British bats. Sci. Rep. 2018; 8. DOI:10.1038/s41598-018-20138-1.
40. Sándor A.D., Corduneanu A., Péter Á. et. al. Bats and ticks: host selection and seasonality of bat-specialist ticks in eastern Europe. Parasites Vectors. 2019; 12. DOI:10.1186/s13071-019-3861-5.
41. Jaunbauere G., Salmane I., Spungis V. Occurrence of bat ectoparasites in Latvia. Latv. Entomol. 2008; 45: 38–42.
42. Klaus Ch., Gethmann J., Hoffmann B. et. al. Tick infestation in birds and prevalence of pathogens in ticks collected from different places in Germany. Parasitol Res. 2016; 115: 2729–2740. DOI:10.1007/s00436-016-5022-5.
43. Lommano E., Dvorák Ch., Vallotton L. et. al. Tick-borne pathogens in ticks collected from breeding and migratory birds in Switzerland. Ticks Tick Borne Dis. 2014; 5(6): 871–882. DOI:10.1016/j.ttbdis.2014.07.001.
44. Mikryukova T.P., Moskvitina N.S., Kononova Y.V. et. al. Surveillance of tick-borne encephalitis virus in wild birds and ticks in Tomsk city and its suburbs (Western Siberia). Ticks Tick Borne Dis. 2014; 5(2): 145–151. DOI:10.1016/j.ttbdis.2013.10.004.
45. Hasle G. Transport of ixodid ticks and tick-borne pathogens by migratory birds. Front. Cell. Infect. Microbiol. 2013; 3. DOI:10.3389/fcimb.2013.00048.
46. Michelitsch A., Wernike K., Klaus C. et. al. Exploring the reservoir hosts of tick-borne encephalitis virus. Viruses. 2019; 11(7): 669. DOI:10.3390/v11070669.
47. Waldenstrum J., Lundkvist A., Falk K.I. et. al. Migrating birds and tickborne encephalitis virus. Emerg. Infect. Dis. 2007; 13(8): 1215–1218. DOI:10.3201/eid1308.061416.
48. Fleming T.H. Bat Migration. Encyclopedia of Animal Behavior. Coral Gables (USA), 2019; 605–610. DOI:10.1016/B978-0-12-809633-8.20764-4.
49. Russell A.L., Pinzari C.A., Vonhof M.J. et. al. Two tickets to paradise: multiple dispersal events in the founding of hoary bat populations in Hawaii. PLoS ONE. 2015; 10(6): e0127912; DOI:10.1371/journal.pone.0127912.
50. Roberts B.J., Catterall C.P., Eby P. et. al. Long-distance and frequent movements of the flying-fox Pteropus poliocephalus: implications for management. PLoS ONE. 2012; 7(8): e42532; DOI:10.1371/journal.pone.0042532.
51. Cryan P.M. Seasonal distribution of migratory tree bats (Lasiurus and Lasionycteris) in North America. Journal of Mammalogy. 2003; 84(2): 579–593. DOI:10.1644/1545-1542(2003)084<0579:SDOMTB>2.0.CO;2.
52. Havlik O., Kolman J. The demonstration of antibodies against the virus of the tick-borne encephalitis in certain bats. J. Hyg. Epidemiol. Microbiol. Immunol. 1957; 1(2): 231–233.
53. Дробищенко Н.И., Львов Д.К., Укбаева Т. П. и др. Экспериментальное подтверждение персистенции вируса клещевого энцефалита у летучих мышей в зимний период. Медицинская паразитология. 1978; 47: 81–82.
54. Nosek J., Gresikova M., Rehacek J. Persistence of tick-borne encephalitis virus in hibernating bats. Acta Virol. 1961; 5: 112–116.
55. Fagre A.C., Kading R.C. Can bats serve as reservoirs for arboviruses? Viruses. 2019; 11(3): 215. DOI:10.3390/v11030215.
56. Geller J., Nazarova L., Katargina O. et. al. Tick-borne pathogens in ticks feeding on migratory passerines in Western Part of Estonia. Vector-Borne and Zoonotic Diseases. 2013; 13(7): 443–448. DOI:10.1089/vbz.2012.1054.
57. Kazarina A., Japiтa K., Keišs O. et. al. Detection of tick-borne encephalitis virus in I.ricinus ticks collected from autumn migratory birds in Latvia. Ticks Tick Borne Dis. 2015; 6(2): 178–180. DOI:10.1016/j.ttbdis.2014.11.011.
58. Csank T., Korytár ј., Pošiváková T. et al. Surveillance on antibodies against West Nile virus, Usutu virus, tick-borne encephalitis virus and Tribec virus in wild birds in Drienovská wetland, Slovakia. Biologia. 2019; 74: 813–820. DOI:10.2478/s11756-019.
59. Alcaide M., Scordato E.S.C., Price T.D. et al. Genomic divergence in a ring species complex. Nature. 2014; 511: 83–85. DOI:10.1038/nature13285.
1 Арбовирусы (от англ. слов arthropod — членистоногие, borne — переносить и virus — вирус) — неофициальное название вирусов, которые переносятся членистоногими (Аrthropodа), в том числе клещами. — Примеч. ред.
2 Е-гены кодируют синтез белка вирусной оболочки (англ. envelope). Выбор именно этого фрагмента генома ВКЭ связан с тем, что для вирусов клещевого энцефалита балтийской группы сибирского субтипа (Балт-ВКЭ-Сиб), разнообразие которых изучалось в данном исследовании, известно всего семь полных геномов (~11 тыс. п.о.), а E-генов — примерно 70. — Примеч. ред.
3 Всем нуклеотидным последовательностям, представленным в международных базах данных (DDBJ, EMBL, GenBank), присваиваются идентификационные номера с определенным префиксом (в данном случае — FJ). Информацию о размещенных в GenBank образцах, о которых идет речь в статье, см. по ссылке. www.ncbi.nlm.nih.gov/nuccore.



























Рис. 1. Иксодовые клещи — основные переносчики вируса клещевого энцефалита, в том числе ВКЭ)Сиб (а; фото Florent Lamiot). В большинстве случаев вирус передается человеку зараженным клещом [1]. Вокруг присосавшегося клеща может развиться неспецифическая кожная реакция (б), но так происходит не всегда (в)