Персональная таблетка
Генетические исследования уже в скором времени позволят справиться с орфанными заболеваниями
Алексей Дейкин,
кандидат биологических наук, Институт биологии гена РАН, НИУ «БелГУ»
«Коммерсантъ Наука» №23 (2), июнь 2021

Генная терапия дает шанс на спасение десятков тысяч жизней — причем в наиболее сложных и редких случаях: при болезни Дюшенна, некоторых видах эпилепсии и кардиомиопатии.
В мире активно развивается направление генной терапии. Разрабатываемые препараты в основном делятся на две группы — противораковые и направленные на терапию орфанных (редких) заболеваний. Обе эти группы препаратов имеют разную судьбу. Если в случае противораковых средств социальная значимость и востребованность, а значит, и потенциальный рынок не вызывают вопросов и главной проблемой является генетическая мишень, то для орфанных заболеваний все ровно наоборот.
Около 30% пациентов с орфанными заболеваниями не доживают до 5-летнего возраста, и потому разработка и лицензирование лекарственных препаратов для них должны проводиться в крайне сжатые сроки. Особую остроту проблеме добавляет то, что хотя каждое орфанное заболевание само по себе встречается редко: 1 из 6000, 1 из 100 000, 1 из 300 000 новорожденных, общее их количество таково, что охватывает более 1% детей. Для России это 25–30 тыс. пациентов в год.
Один из многих тысяч
Значительная часть орфанных заболеваний является не просто генетическими, но моногенными. Для них известна генетическая мишень, на коррекцию дефекта которого должна быть направлена генная терапия. Вот только один пример.
Мутации в гене GNAO1 приводят к эпилептической энцефалопатии с двигательными нарушениями, грубой задержке психомоторного развития. На практике это приводит к тому, что у детей присутствует, в зависимости от варианта мутации, эпилепсия, хорея, гиперкинезы, а также дети не держат голову, не сидят, не разговаривают. При этом, по мнению неврологов, у детей сохраняется интеллект.
Есть два вида мутаций, при которых присутствуют все симптомы: R209H и G203R, таких детей в мире сейчас более 200. Второй вариант наиболее тяжелый и приводит ко всем перечисленным выше симптомам, с ним нет ни одного ребенка старше 8 лет. На сегодняшний день в мире диагностировано 24 ребенка с наиболее тяжелым вариантом мутации, пять из них в России. Генная терапия, направленная на подавление работы мутантного гена, — единственный шанс выжить для этих пациентов.
Какие виды геннотерапевтических препаратов существуют
На сегодняшний день в качестве медицинских стратегий генной терапии реализуется как модификация генома клеток пациента «в пробирке» с последующей обратной трансплантацией, так и системное или местное введение геннотерапевтического препарата больному.
Согласно центральной догме молекулярной биологии, наследственная информация передается в потоке ДНК → РНК → белок; сама природа человека определила эти три ключевые точки, и именно на них может воздействовать генная терапия. Так и геннотерапевтические средства действуют на один из этапов передачи информации, чтобы в итоге скорректировать функцию белка в клетке.
Первая группа препаратов обеспечивает коррекцию дефекта без внесения изменений в ДНК или РНК самого человека — в клетки доставляется плазмида или аденоассоциированный вирус, который, не встраиваясь в геном человека, обеспечивает наработку нужного белка — такой подход наиболее безопасен и подходит для коррекции, например, ферментативных недостаточностей.
Вторая группа препаратов воздействует на РНК. РНК в клетке претерпевает изменения — в процессе ее «созревания» из первичной молекулы удаляются не кодирующие белок незначащие последовательности. Бывает так, что из-за мутаций этот процесс нарушен и «зрелая» РНК не работает, и на этом этапе в качестве геннотерапевтического препарата выступают короткие последовательности олигонуклеотидов, которые помогают изменить процесс «созревания» РНК так, чтобы с итоговой молекулы мог нарабатываться правильный белок. Основным ограничением таких препаратов является их относительно короткий период работы и слишком сложный молекулярный механизм. Но именно на этом принципе основан зарегистрированный в России американский препарат от спинальной мышечной атрофии (SMA).
И наконец, третья группа препаратов основана на внесении изменений в геном пациента — это или встраивающиеся в геном вирусы, или системы для прямого редактирования генома CRISPR/Cas9 — вносящие точечные изменения в нужное место генома. Основное ограничение таких препаратов — опасения, что при редактировании будут нарушены «правильные» участки генома.
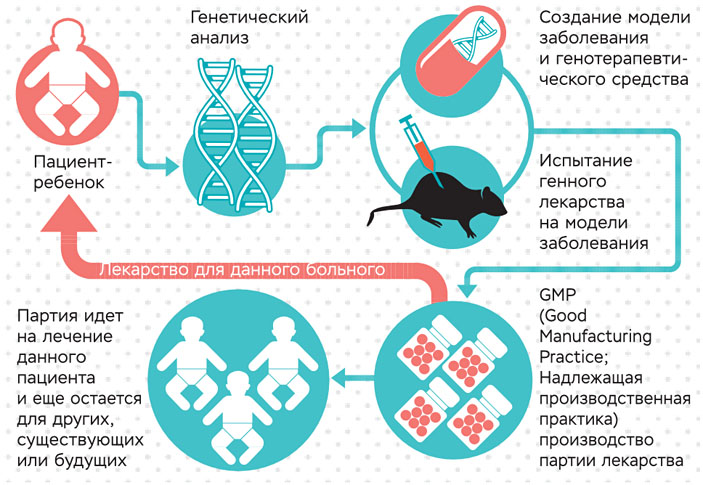
Принципиальная схема производства генных лекарств
Персональные клинические испытания
Во всех случаях возникает совершенно новая проблема обеспечения безопасности лекарственного препарата — обычно на доклинических стадиях исследуется токсичность субстанции, затем безопасность подтверждается на 1-й стадии клинических испытаний на здоровых добровольцах и лишь на 2-й стадии клинических испытаний препарат получают пациенты для исследования его эффективности.
В случае генетических заболеваний на животных зачастую невозможно исследовать прямую генетическую токсичность (нет у животных человеческих генов), а для здоровых добровольцев препарат может быть заведомо опасен. В то же время для орфанных заболеваний невозможно собрать группу для полноценных исследований на больных, если их на всю планету десять человек.
В Институте биологии гена Российской академии наук совместно с компанией «Марлин Биотех» ведется разработка нескольких геннотерапевтических лекарственных средств. Мы ищем лекарство от дистрофии Дюшенна, GNAO1 эпилепсии и FLNC кардиомиопатии. Во всех случаях речь идет о персонализированной терапии.
Общая схема работы по проектам состоит из нескольких этапов — генетическая диагностика, разработка молекулярного подхода к терапии, создание персонализированной животной модели заболевания с теми же мутациями, что обнаружены у пациента, создание лекарственного препарата на основе олигонуклеотидов или минигена, разработка системы их доставки и испытания ее эффективности на культуре клеток, а затем на модельных животных.
Все это позволяет провести комплекс исследований, для того чтобы показать общую, специфическую токсичность потенциального лекарственного препарата, а главное — его эффективность уже на животной модели, для того чтобы у регулятора были основания для разрешения клинических исследований на одном пациенте. Пока ни в России, ни в мире такой механизм не отработан, и в каждом случае требуется индивидуальный подход к исследованиям.
Немного о деньгах
Большое количество разработок и постепенная регистрация все большего количества геннотерапевтических препаратов позволяют рассчитывать на то, что на наших глазах рождается фармацевтическая индустрия нового типа.
Главная причина медленного развития направления — сложности в коммерциализации разработок фармацевтическими компаниями. Они не видят рынка, не понимают, как будут окупаться вложения в производство. Но, например, в случае препаратов от GNAO1 эпилепсии на основе олигонуклеотидов стоимость производства одной и 60 доз практически не отличается, а значит, стоимость лечения 1 и 20 пациентов одинакова. Просто за счет диагностики и большего охвата пациентов можно значительно снизить затраты в расчете на одного пациента.
Более того, оборудование и подход являются универсальными, это значит, что не такой уж фантастикой выглядит картина, когда после диагноза в поликлинике пациенты будут становиться в очередь на синтез для них персонального генного препарата. Ведь основным отличием генной терапии от других фармацевтических подходов является то, что мишень известна, известен способ воздействия на нее, а значит, реальный объем затрат на разработку снижается в сотни раз.
И наконец, важно то, что с 1 января 2021 года в соответствии с решением Совета Евразийской экономической комиссии от 3 ноября 2016 года № 78 «О Правилах регистрации и экспертизы лекарственных средств для медицинского применения» в правовое поле вводится понятие высокотехнологических, в том числе геннотерапевтических, лекарственных препаратов. Для России это может означать новый этап в развитии важнейшего направления биомедицины.
Избранное
См. также


















Фото: Bloomberg via Getty Images