ДНК-связывающий белок голодных клеток
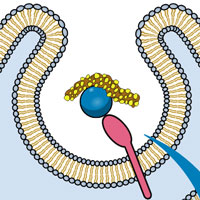
Перед вами 3D-модель транскрипции — синтеза РНК по матрице ДНК — у бактерий. Фермент РНК-полимераза (розовый цвет) связывается с ДНК (синий) и осуществляет синтез молекул РНК (фиолетовый). Зеленые глобулы — это молекулы белка Dps — ДНК-связывающего белка голодных клеток (DNA-binding protein from starved cells). Они плотно упаковали нити ДНК, полностью блокируя белки, которые могут их разрезать и повредить, но никак не препятствуя экспрессии генов.
Этот незаменимый для бактерий белок был обнаружен в 1992 году у кишечной палочки (Escherichia coli). Название белка обусловлено тем, что он был впервые выделен и описан при исследовании протеома (совокупности белков организма) в трехдневных культурах голодающих клеток E. coli: в растущую культуру перестали добавлять питательные вещества, из-за чего активное деление клеток замедляется или прекращается вовсе.
Во время активного роста культуры E. coli молекулы Dps составляют очень малую часть бактериального нуклеоида (у прокариот нет ядра, и нуклеоидом обозначается область в клетке, где находится хромосома и ассоциированные с ней белки; также в этой зоне могут находиться молекулы РНК). Однако во время стационарной фазы роста бактериальной культуры, когда запас питательных веществ в среде иссякает, концентрация Dps резко возрастает — примерно в 300 раз, что составляет около 180 000 молекул на одну бактериальную клетку. Такое количество необходимо для того, чтобы максимально эффективно упаковать хромосому в компактную, стабильную, а главное — безопасную структуру. Физическое «экранирование» ДНК позволяет сохранить нить в целости в различных стрессовых условиях, таких как высокие температуры, окислительный стресс (к слову, Dps играет немаловажную роль и в нейтрализации опасных для клетки радикалов кислорода; об этом мы расскажем чуть ниже), антибактериальное влияние различных веществ, голодание, изменение микроокружения и т. д.

Считается, что Dps связывает разные части ДНК неспецифически, то есть без предпочтения каких-либо нуклеотидных мотивов — коротких и устойчивых последовательностей нуклеотидов, имеющих определенную биологическую функцию. Но недавние исследования показали, что структура участка ДНК может играть роль в сродстве белка. Например, со шпильками, образующимися в нити ДНК, Dps связывается более эффективно за счет увеличения точек связывания.
Есть несколько основных моделей, объясняющих механизм взаимодействия Dps с ДНК с образованием нуклеопротеидного комплекса. Согласно одной из них, связывание происходит за счет различия в электростатическом потенциале. Dps представляет собой додекамер (см. Dodecameric protein) — глобулу из 12 белковых субъединиц. Вся глобула преимущественно отрицательно заряжена, как и молекула ДНК, но у Dps присутствуют положительно заряженные «хвосты» (N-концевые фрагменты), состоящие из остатков аминокислот лизина и аргинина, которые обеспечивают заряд. Исследования показали, что именно они помогают белку присоединятся к ДНК, а так как хвосты на поверхности находятся триплетами (то есть три N-конца сплетаются), то логично предположить, что при достаточном количестве мест для связывания нуклеопротеидный комплекс будет только устойчивее.

Графическое изображение глобулы Dps и нуклеопротеидных комплексов. А — распределение заряда на белке: красные и белые области — отрицательный заряд (−12 и −4,8 соответственно), синие — положительный (от 0). К6, К8, К10 — положительно заряженные аминокислоты на неструктурированных N-концевых фрагментах (остатки лизина). В — связывание молекул белка с ДНК в областях шпилек и одноцепочечных разрывов. Рисунок из статьи V. V. Melekhov et al., 2015. Modes of Escherichia coli Dps Interaction with DNA as Revealed by Atomic Force Microscopy
Согласно второй модели, вокруг ДНК формируются два полукольца из шести мономеров Dps, которые образуют гексагональное кольцо диаметром 9 нм. Предполагается, что происходит перестройка шарообразной структуры додекамера в торообразную и, по-видимому, «выворачивание» внутренней поверхности мономеров наружу. Однако такая перестройка требует затрат энергии, поэтому маловероятна, но всё же возможна.

Фото, сделанные через электронный микроскоп. A — Dps без примесей и ДНК, B — комплексы Dps-ДНК, формирующие гексагональные кольца, плотная упаковка колец возможна при самоагрегации молекул белка. Масштаб обеих фотографий в два раза меньше масштаба врезки. Изображение из статьи M. Almirón et al., 1992. A novel DNA-binding protein with regulatory and protective roles in starved Escherichia coli
Третья модель оспаривает возможность непосредственного взаимодействия отрицательно заряженной двойной спирали ДНК с белком из-за того, что поверхность додекамера несет сильный отрицательный заряд, и положительные концы не могут «перевесить» его. Согласно этой гипотезе, взаимодействие Dps с ДНК происходит за счет образования ионных мостиков в присутствии ионов магния (Mg2+). Недостаток этой модели — неспособность объяснить явную зависимость ДНК-связывающей активности Dps от структуры гибких N-концевых фрагментов, несущих избыточный положительный, а не отрицательный заряд.
Dps плотно связывается и агрегирует на нити ДНК, однако не влияет на экспрессию генов: белок оставляет место для работы РНК-полимеразы и производства транскриптов, что проиллюстрировано на главном изображении.
Кроме защиты ДНК от повреждения, Dps предохраняет клетки от окислительного стресса. Dps относят к семейству ферритинов — белков, способных окислять и накапливать ионы железа в своей полости. Попавшие в клетку ионы железа (Fe2+) окисляются пероксидом водорода (H2O2) с образованием гидроксильного радикала (OH·), который вызывает окисление липидов, разрывы цепи ДНК и деградацию различных биомакромолекул. Это так называемая реакция Фентона:
Fe2+ + H2O2 → Fe3+ + OH− + OH·
Ферритины, Dps в том числе, обладают способностью окислять ионы железа Fe2+ с использованием пероксида водорода (или хлорноватистой кислоты) без образования гидроксильных радикалов, тем самым защищая клеточные структуры от свободно-радикальных процессов. Эта реакция происходит в так называемом ферроксидазном центре:
2Fe2+ + Н2О2 + 2Н2О → 2FeOOH−Dps + 4H+
Окисленные ионы железа в виде оксогидроксида трехвалентного железа (FeOOH) накапливаются во внутренней полости Dps, образуя неорганическое ядро, содержащее до 500 ионов железа.
Возможно, у Dps есть и другие, пока не открытые функции. Для науки 28 лет исследований молекулы — срок слишком короткий, поэтому сложно сказать, что мы еще узнаем об этом белке в будущем.
Изображение с сайта futurity.org.
Анастасия Шешукова
-
А — распределение заряда на белке: красные области — отрицательный заряд, белые — положительный, а синие — нейтральный.
Шта???.. оО
Цвета перепутаны!!
В подписи Fig.6 той статьи сказано: "In panel [A] the threshold for Coulombic surface coloring was set at -12 for red (negative electrostatic potential), at -1.5 for white and at 0 for blue (positive potential). In panel [C] the scale was changed to: -12, -4.8 and 0, respectively."
Т.е. и красный и белый цвет соответствуют отрицательному заряду (12e и 4.8e, соотв-но), а синий - нейтральному. Впрочем, вполне может статься, что электростатика была посчитана для "вакуума" и без учёта pH среды (и потому лизины несут категорически заниженный заряд)... :)
Ещё интересно сравнение Dps с многочисленными гистонами...
Последние новости














Фазы роста бактериальной культуры. Во время лаг-фазы колонии, помещенные в питательную среду, приспосабливаются к ней, в экспоненциальной фазе клетки активно и быстро делятся (именно это называют ростом клеток и клеточной культуры), в стационарной фазе запас питательных веществ в среде иссякает (если не пересаживать клетки или не добавлять среду) и клетки перестают делиться, фаза отмирания начинается при полном истощении ресурсов. Рисунок с сайта studfile.net