Последние выпуски
- Том 86, № 6. Ноябрь-декабрь 2025
- Том 86, № 5. Сентябрь-октябрь 2025
- Том 86, № 4. Июль-август 2025
- Том 86, № 3. Май-июнь 2025
Как вирусы подавляют защитные механизмы клетки
В ходе эволюционной «гонки вооружений» организмы вырабатывают средства защиты от вирусов, а вирусы совершенствуют способы преодоления этих защитных механизмов. Пикорнавирусы — одна из групп РНК-содержащих вирусов — используют одновременно четыре способа подавления сопротивляемости зараженных клеток, однако полностью отключить защитные механизмы им все равно не удается.
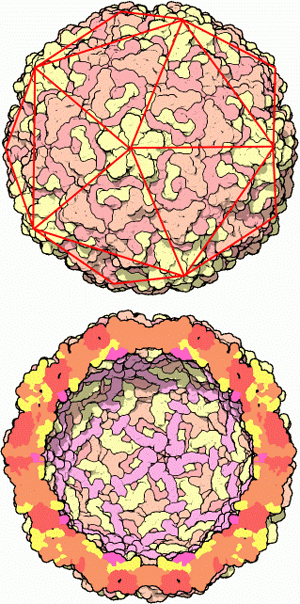
В обзорной статье Е. С. Гаврюшиной из Института физико-химической биологии им. Белозерского описаны способы борьбы пикорнавирусов с теми адаптациями, которые млекопитающие выработали для защиты от них. Название «пикорнавирус» (см.: picornavirus) сложено из слов «pico-» (маленький), «RNA» (РНК) и «virus», то есть «маленький РНК-содержащий вирус». К этой группе относятся возбудители полиомиелита, ящура, гепатита А, риновирусы (возбудители простуды), энтеровирусы, кардиовирусы и др.
Геном пикорнавирусов представляет собой одноцепочечную молекулу РНК с одной-единственной открытой рамкой считывания — последовательностью нуклеотидов, которая кодирует белок и может сразу, без всяких промежуточных этапов, транслироваться, то есть использоваться в качестве матрицы для синтеза белка.
Этот единственный «ген» пикорнавирусов кодирует, однако, не один, а сразу 11 разных белков. Все они синтезируются рибосомами зараженной клетки «в один присест», то есть в виде единой полипептидной цепочки, которая уже в ходе трансляции сама себя режет на 11 частей — функциональных вирусных белков. Четыре из них (VP1, VP2, VP3, VP4) служат для построения оболочки вирусной частицы (капсида). Остальные семь (2A, 2B, 2C, 3A, 3B, 3C, 3D) нужны для размножения вирусной РНК и борьбы с защитными системами клетки.
Основной метод воздействия пикорнавирусов на зараженную клетку не отличается тонкостью и изяществом — скорее его можно сравнить с ударом дубиной по голове. Вирус пытается заблокировать важнейшие проявления жизнедеятельности клетки — работу ядерных генов и синтез клеточных белков. Вмешательство осуществляется на трех уровнях:
1) Подавление работы (транскрипции) ядерных генов. «Отвечает» за эту диверсию вирусный белок 3C, который является протеазой, то есть ферментом, разрушающим другие белки. Одной из мишеней протеазы 3C являются белки TFIID и TFIIC — важнейшие транскрипционные факторы (регуляторы транскрипции), без которых гены, расположенные в ядерных хромосомах, просто не могут быть транскрибированы («прочтены»).
2) Блокировка транспорта матричных РНК из ядра в цитоплазму. Если в клетке все-таки сохраняется какое-то количество транскрипционных факторов TFIID и TFIIC, и процесс транскрипции в ядре не прекращается полностью, то образовавшиеся в ходе транскрипции матричные РНК должны быть затем доставлены из ядра в цитоплазму, где клетка сможет их использовать для синтеза белка. Вирус пытается помешать транспортировке РНК, разрушая белки нуклеопорины, входящие в состав комплекса ядерных пор (через эти поры транспортируются молекулы РНК из ядра в цитоплазму). За разрушение нуклеопоринов отвечает тот же самый вирусный белок — протеаза 3C.
3) Подавление синтеза клеточных белков (трансляции). Ни одно из своих «диверсионных мероприятий» вирус не может (или не хочет?) проводить со стопроцентной эффективностью, поэтому какое-то количество матричных РНК все-таки попадает в цитоплазму, где они могут быть транслированы, то есть использованы рибосомами в качестве матриц для синтеза клеточных белков. Вирус пытается этому воспрепятствовать, разрушая белок eIF4G. Этот белок необходим для инициации (начала) трансляции клеточных мРНК. Расщепление белка eIF4G осуществляет другая вирусная протеаза — 2А. Вирусные белки 2A и 3C также вмешиваются в заключительные этапы трансляции, разрушая совместными усилиями белок PABP. Этот белок необходим для замыкания мРНК в кольцо, благодаря чему рибосома, закончив трансляцию данной молекулы мРНК, может сразу же начать транслировать ее снова.
Возникает вопрос: как же вирус ухитряется транслировать на клеточных рибосомах собственную РНК, если белок eIF4G, необходимый для начала трансляции, уничтожен? Оказывается, в вирусной РНК есть особая последовательность нуклеотидов, которая «обманывает» аппарат трансляции и заставляет рибосомы начать синтез вирусных белков без участия eIF4G. Эта последовательность называется «участком внутренней посадки рибосом» (см.: internal ribosome entry site).
Лишенная возможности нормально синтезировать белки, клетка оказывается беззащитной перед вирусом. В частности, она не может запустить механизм апоптоза — «программируемой смерти» (самоубийство зараженных клеток — один из основных способов борьбы организма с вирусными инфекциями; бактерии, зараженные вирусами, тоже прибегают к этому крайнему средству, чтобы не заразить других бактерий — своих родичей). Клетка также лишается возможности призвать на помощь иммунную систему при помощи сигнальных белков — цитокинов.
Но вирус заинтересован в подавлении синтеза клеточных белков не только потому, что тем самым он блокирует защитные системы клетки. Может быть, еще более важным является то обстоятельство, что в результате все клеточные рибосомы оказываются в полном распоряжении вируса и могут беспрепятственно использоваться для трансляции вирусной РНК и синтеза вирусных белков.
Подавление работы клеточных генов и синтеза клеточных белков — не единственный способ воздействия вируса на зараженную клетку. Вирус также принимает меры для того, чтобы зараженная клетка не была обнаружена и уничтожена специализированными клетками иммунной системы — цитотоксическими Т-лимфоцитами CD8. Система опознания зараженных клеток Т-лимофцитами работает следующим образом. Каждая клетка постоянно расщепляет имеющиеся в ней белки на короткие кусочки (пептиды) при помощи специальных молекулярных «машинок» — протеасом. Эти пептиды транспортируются в эндоплазматическую сеть, оттуда — в аппарат Гольджи, и, наконец, попадают на поверхность клетки. В пути они объединяются с белками главного комплекса гистосовместимости класса I (см.: MHC class I ). Т-лимофциты CD8 постоянно «ощупывают» поверхность клеток своими рецепторами, проверяя, какие пептиды прикреплены к белкам MHC-I, сидящим на поверхности клеток. Если оказывается, что петид незнакомый, «чужой» (например, вирусный, представляющий собой фрагмент вирусного белка), Т-лимфоциты принимают самые жесткие меры. Чаще всего они просто заставляют клетку покончить с собой (совершить апоптоз).
Чтобы фрагменты вирусных белков не попали на поверхность клетки и не навлекли на клетку «гнев» Т-лимфоцитов, пикорнавирусы принимают следующие меры. Во-первых, они блокируют транспорт белков из эндоплазматической сети в аппарат Гольджи. Эту функцию выполняет вирусный белок 3А. Во-вторых, блокируется транспорт белков от аппарата Гольджи к поверхности клетки. За это отвечает вирусный белок 2B.
В целом можно заметить, что вирус обращается с клеткой очень грубо, его воздействие на клеточные системы транскрипции, трансляции и транспорта отличается отсутствием избирательности. Именно в этом и кроется слабость вируса. Блокировка синтеза всех клеточных белков, а также их транспорта из цитоплазмы на поверхность клетки, приводит к тому, что белки MHC-I вообще перестают попадать на клеточную мембрану. Т-лимофциты CD8 не придают этому значения — для них главное, чтобы на поверхности не было чужих пептидов, прикрепленных к белкам MHC-I. Но есть и другой класс лимфоцитов — NK («нормальные киллеры»), для которых само отсутствие белков MHC-I на поверхности клеток является сигналом тревоги. Поэтому зараженная клетка, «спасенная» вирусом от лимфоцитов CD8, всё равно в конце концов уничтожается NK-лимфоцитами.
Очевидно, мы видим здесь типичный результат эволюционной «гонки вооружений» между вирусами и их жертвами — млекопитающими. Теоретически, такая гонка вооружений может продолжаться неопределенно долго (хотя в некоторых случаях одна из сторон может добиться «окончательной победы», и это не обязательно приводит к полному вымиранию побежденной стороны; см. об этом в книге Р. Докинза «Расширенный фенотип», глава 4). В случае с пикорнавирусами, очевидно, «гонка вооружений» еще не закончена, поэтому мы видим весьма сложные и эффективные средства борьбы с обеих сторон, но при этом уязвимые места сохраняются как у вирусов, так и у их жертв.
См. также:
Расшифрованы геномы всех известных риновирусов — возбудителей простуды, «Элементы», 7.04.09
Популярные синопсисы