«Самая главная молекула». Глава из книги
Глава 7. Кольцевые ДНК
ДНКовые кольца
Внимательный читатель, должно быть, заметил, что для понимания биологических функций ДНК важны два ее основных свойства: она состоит из двух комплементарных цепей, и генетическая информация заключена в последовательности нуклеотидов четырех типов (А, Т, Г и Ц). Собственно, на этих двух фактах зиждется все стройное здание современной молекулярной биологии, включая генную инженерию. Даже то, что ДНК — это спираль, а не просто веревочная лестница, биологам знать как бы ни к чему, а уж генным инженерам — и подавно, не говоря уже о более тонких деталях физического строения молекулы. Во всяком случае есть люди, которые действительно так считают. Эти люди говорят, что хватит, мол, копаться в этой ДНК, пора всем дружно взяться только за сугубо практические задачи, для решения которых вполне достаточно того, что известно.
Конечно, позиция эта недальновидна. То, о чем было рассказано в предыдущих главах, убеждает, что при изучении ДНК даже самые, казалось бы, пустяковые факты могут привести к открытиям первостепенной важности. Вспомните историю открытия рестриктаз. Ведь все началось с выяснения очень тонкой химической особенности молекул ДНК — метилирования ничтожной доли нуклеотидов. Эта особенность не была связана с основными функциями ДНК, а лишь позволяла клетке отличать «свои» молекулы от «чужих». А где были бы сейчас молекулярная биология и генная инженерия, не будь открыты рестриктазы?!
Так кто же осмелится утверждать, что тщательное изучение структуры ДНК не откроет нам совсем новые характеристики молекулы, важные для ее работы, не выявит новые ферменты, о которых никто раньше и не подозревал? Где гарантия, что в результате мы не сможем еще активнее вмешиваться в генетические процессы? Вновь и вновь мы убеждаемся в том, что изучение биологической роли тонких особенностей структуры ДНК обещает интересные и неожиданные находки. Пожалуй, самое яркое свидетельство тому — открытие кольцевой формы ДНК, явления сверхспирализации и ферментов топоизомераз. При выяснении возникших здесь вопросов молекулярным биологам в наибольшей степени потребовалась помощь со стороны физики и математики.
Когда научились выделять из клеток молекулы ДНК (а биохимики овладели этим искусством очень давно), то вскоре убедились, что эти молекулы ведут себя так, как и положено себя вести обычным линейным полимерам. На каждую молекулу приходилось по два конца. И ни у кого не вызывало сомнений, что все молекулы ДНК — линейные цепи. Правда, генетикам часто было неясно, какие же гены считать концевыми. Поэтому им приходилось рисовать свои генетические карты в виде кольцевых диаграмм. Но можно себе представить, как посмеялись бы над тем чудаком, который стал бы утверждать, что эти условные кольцевые карты отражают истинное кольцевое строение самих молекул! Для того, чтобы всерьез утверждать такое, надо было доказать, что молекулы ДНК и впрямь бывают кольцевыми. Как это часто случается, ответ пришел оттуда, откуда его и не ждали.
Электронные микроскописты изучали маленькие ДНК онкогенных вирусов, т. е. вирусов, вызывающих рак. Генетические сведения об этих ДНК практически вообще отсутствовали, но работать с ними было удобно — маленькие ДНК не рвутся на куски, как это происходит с длинными молекулами, выделять которые в неповрежденном виде — очень трудная задача. Так вот, к величайшему удивлению своему, микроскописты обнаружили, что некоторые вирусные ДНК замкнуты в кольцо. Это наблюдение было сделано в начале 1960-х годов. Стало ясно, что кольцевые генетические карты — штука вовсе не случайная.
Однако особого интереса открытие не вызвало. Мало ли какой бывает ДНК в вирусах! Иногда она находится там в виде одной из двух комплементарных цепей. Порой эта цепь замкнута в кольцо. Но заведомо известно и много случаев, когда внутри вирусной частицы ДНК линейна.
Все же поиск кольцевых ДНК продолжался. И постепенно выяснилось, что даже в тех случаях, когда ДНК в вирусной частице линейна, она, как правило, замыкается в кольцо после проникновения вируса в клетку. Оказалось, что перед началом репликации такая линейная молекула переходит в форму (ее называют репликативной), в которой обе комплементарные цепи ДНК образуют замкнутые кольца (рис. 26). Кольцевыми оказались ДНК бактерий, в частности, кишечной палочки. Плазмиды, эти незаменимые в генной инженерии переносчики генов, всегда кольцевые. Короче, трудно назвать случаи, когда ДНК работает в прокариотической клетке, не находясь в кольцевом состоянии. Отметим сразу, что у эукариот хромосомная ДНК всегда линейна. Мы еще вернемся к этому фундаментальному различию между двумя основными царствами живых существ. А пока сосредоточим свое внимание на прокариотах. Зачем прокариотической клетке замыкать молекулы ДНК в кольца? Что это дает? К каким изменениям свойств молекул приводит? Чтобы ответить на эти вопросы, надо было подробно изучить эту новую форму ДНК.

Сверхспирализация и топоизомеразы
Для нас сейчас важнее всего то, что в молекуле ДНК комплементарные цепи обвивают друг друга подобно двум лианам, и когда каждую из цепей замыкают, то два кольца оказываются зацепленными так, что их невозможно развести. Простейшее зацепление двух колец известно всем — это символ бракосочетания (рис. 27). Только две комплементарные цепи в ДНК сцеплены друг с другом гораздо сильнее.
Количественно степень зацепленности двух колец характеризуется величиной, называемой порядком зацепления и обозначаемой Lk (от английского слова linking). Определить эту величину для любого зацепления очень легко. Нужно представить себе, что на одно кольцо натянута мыльная пленка, и подсчитать, сколько раз второе кольцо протыкает эту пленку. Тогда легко убедиться, что для символа бракосочетания Lk = 1, а для зацепления, изображенного на рис. 26, Lk = 9.
Величина Lk замечательна тем, что ее значение для заданной пары колец не может измениться, как бы мы ни гнули эти кольца, лишь бы не рвали их. Поэтому математики говорят, что Lk есть топологический инвариант системы, состоящей из пары колец. А без помощи математиков молекулярным биологам никогда не удалось бы разобраться в свойствах кольцевых ДНК.

Рис. 27. Простейшее зацепление — символ бракосочетания
Итак, если мы превратили ДНК в кольцевую замкнутую молекулу, то созданный в ней порядок зацепления двух цепей не может измениться, что бы мы ни делали с молекулой, пока сахарофосфатные цепи, образующие «хребет» каждой из комплементарных цепочек, остаются целыми и невредимыми. Благодаря этому обстоятельству замкнутые кольцевые (зк) ДНК обладают совершенно особыми свойствами, резко отличающими их от линейных молекул. Самое главное заключается в том, что в зкДНК может быть запасена впрок энергия в виде так называемых сверхвитков.
Чтобы пояснить только что сказанное, представим линейную ДНК в каких-то определенных внешних условиях. В такой ДНК на один виток двойной спирали приходится вполне определенное число пар оснований. Это величина γ0. В двойной спирали Уотсона — Крика γ0 = 10, но она может немного меняться (всего лишь на десятые доли, но сейчас для нас это важно) при изменении внешних условий. Допустим теперь, что из линейной молекулы сделали кольцевую, прибегнув к минимальному насилию. Проще всего представить себе, что мы превратили молекулу в окружность и «заклеили» концы каждой из цепей. Чему будет равно Lk? Ясно, что Lk = N/γ0, где N — число пар оснований в молекуле.
Теперь изменим внешние условия. Молекула ДНК приобретает другое равновесное значение числа пар оснований на виток — γ’0, хотя величина Lk измениться не может. Что же происходит? Молекула стремится обрести положенный порядок зацепления: Lk’ = N/γ’0, но не в состоянии себе этого позволить, ей уже навязано иное значение Lk. Подобное случается и с брачными узами. Когда они заключались, то Lk = 1, но вот условия изменились, той или другой стороне хочется расторгнуть брак, т. е. сделать Lk равным нулю. Возникает очень напряженная обстановка. Нечто похожее происходит и с ДНК. Молекула оказывается в напряженном, энергетически невыгодном состоянии сверхспирализации.
Обычно сверхспирализованные молекулы принимают форму, показанную на рис. 28. Количественно сверхспирализация характеризуется величиной τ = Lk−N/γ’0. Подобно тому, как самой двойной спирали приписывается определенный знак (положительный для правой спирали и отрицательный для левой), так и сверхспирализация может в принципе быть положительной или отрицательной. На рис. 28 двойная спираль правая, как и положено для ДНК, а сверхспирализация отрицательна.
Последнее утверждение может вызвать недоумение. Ведь кажется, что сверхспираль на рис. 28 правая, а не левая. Это один из парадоксов, с которыми приходится сталкиваться при изучении сверхспирализации. Чтобы проще было во всем этом разобраться, возьмите кусок резинового шланга длиной чуть меньше метра, по возможности жесткого. Вставьте в один конец шланга какой-нибудь штырь так, чтобы он немного торчал наружу и на него можно было надеть другой конец, замкнув шланг в кольцо. Важно, что концы шланга после замыкания не должны свободно прокручиваться относительно друг друга.
Теперь можно моделировать сверхспирализацию. Для этого, держа один конец неподвижным, вращайте другой конец шланга вокруг оси штыря так, чтобы ось шланга образовала левую винтовую линию. Затем дайте замкнутому в кольцо шлангу принять наиболее выгодное для него положение, придерживая его двумя пальцами одной руки. Вы убедитесь, что он примет форму, аналогичную изображенной на рис. 28.

Рис. 28. Такой вид принимает сверхспиральная ДНК. Сверхспирализация отрицательная
По мере того как из клеток аккуратно выделяли все новые ДНК и определяли их состояние, вновь и вновь убеждались в том, что эти ДНК не только замкнуты в кольцо, но и завиты в сверхвитки; при этом сверхспирализация абсолютно во всех случаях оказывалась отрицательной. Стало ясно, что сверхспирализованное состояние ДНК не исключение, как думали вначале, а правило. Но тут возникло сомнение — а такова ли ДНК там, внутри клетки? Пришлось признать, что, скорее всего, нет, не такова. По-видимому, сверхспирализация — это реакция на насильственное извлечение ДНК из родной стихии, ведь условия, в которых пребывает ДНК внутри клетки, конечно же, отличаются от условий после ее извлечения.
В клетке ДНК связана с какими-то белками, в частности, с теми, которые раскрывают двойную спираль и расплетают в этих местах две цепи. Но из-за расплетения среднее для всей молекулы значение γ0 становится больше, чем для чистой ДНК, не связанной с белками. Поэтому, если ДНК все-таки не закручена в клетке в сверхспираль, то очистка ее от белков приведет к тому, что она обязательно перейдет в сверхспирализованное состояние с отрицательным знаком.
Таково было простейшее объяснение сверхспирализации ДНК, сложившееся к началу 1970-х годов. Оно означало, что сверхспирализация не имеет никакого биологического значения.
В начале 1970-х годов проблемой сверхспирализации ДНК занимались практически только две группы, обе в США, — Джерома Винограда (Калифорнийский технологический институт), открывшего само явление сверхспирализации, и Джеймса Уонга (Гарвард). Кому хотелось изучать свойство ДНК, явно не имеющее биологического значения? Собственно, и Уонг подключился только потому, что решил выяснить, могут ли те или иные белки расплетать ДНК.
Опыты Уонга требовали времени и усилий: надо было в зкДНК разрывать одну из цепей, создавать комплекс между белком и разорванной ДНК, затем залечивать разрыв лигазой, отделять ДНК от белка и, наконец, измерять величину сверхспирализации. Хорошо бы иметь один белок, который и рвет цепь, и залечивает разрыв, думал Уонг. Насколько меньше было бы возни. И он принялся искать такой белок в клеточных экстрактах кишечной палочки.
Что могло помочь в поисках? Приметы были ясны: если нужный белок существует, то с его помощью сверхспирализованная ДНК должна превращаться в кольцевую замкнутую молекулу, не имеющую сверхвитков. В самом деле, как только белок разорвет одну из цепей, напряжение в ДНК немедленно пропадет, т. е. сверхспираль исчезнет. А когда белок залечит разрыв, то получится ДНК, у которой Lk = N/γ0. Иными словами, шла охота за ферментом, способным менять величину Lk.
Уонгу удалось обнаружить такой фермент. Этот белок оказался родоначальником обширного класса ферментов, меняющих топологические свойства ДНК и названных впоследствии топоизомеразами. Обнаруженный Уонгом первый представитель этого нового класса ферментов получил название топоизомераза I. Открытие топоизомераз заставило усомниться в том, что сверхспирализация никчемна в биологическом смысле. Ведь если есть ферменты, меняющие топологию, то, значит, сама топология клетке не совсем безразлична.
Начался планомерный поиск топоизомераз. И вот в 1976 году группа Мартина Геллерта (Национальный институт здравоохранения, США) обнаружила фермент, который при помощи АТФ (этого универсального «аккумулятора» энергии в клетке) производит действие, обратное тому, что проделывает белок, открытый Уонгом. Этот фермент, названный ДНК-гиразой, превращает расслабленную несверхспирализованную зкДНК в сверхспираль. И вот тут-то выяснилось, что если вывести из строя гиразу, то самые важные процессы в клетке, в частности репликация ДНК, полностью прекращаются. Стало ясно, что сверхспирализация — жизненно важное для клетки состояние ДНК.
Зачем нужна сверхспирализация?
Сверхспирализация — важнейший пример того, как физическое состояние молекулы ДНК влияет на ее работу в клетке. Всю эту проблему интенсивно изучают специалисты самых разных профилей — от медиков до математиков. Поэтому неудивительно, что существует множество гипотез о роли сверхспирализации в работе клетки. Мы остановимся более подробно на одной из них, которая кажется сейчас наиболее простой и правдоподобной.
Гипотеза эта возникла потому, что было прямо доказано: для того чтобы начать удваиваться, молекуле ДНК обязательно надо закрутиться в сверхспираль, но для самого процесса репликации сверхспираль вовсе не нужна. Более того, иногда перед репликацией одна из цепей кольцевой замкнутой ДНК рвется, причем этот разрыв делает специальный белок и только в том случае, если ДНК сверхспирализована. Получается какая-то бессмыслица — клетка затрачивает усилия, чтобы превратить ДНК в сверхспираль с помощью одного белка (ДНК-гиразы) для того, чтобы другой белок эту сверхспирализацию немедленно ликвидировал. Но факты неопровержимы — без этого загадочного ритуала репликация не начнется, во всяком случае в тех объектах, которые были исследованы (например, в бактериофаге ФХ174).
Объяснение всему этому может быть, по-видимому, только одно. Описанный ритуал — не что иное, как проверка ДНК на целостность сахарофосфатной цепи, своеобразный ОТК для ДНК. В самом деле, не следует забывать, что ДНК в клетке постоянно повреждается — облучением, химическими агентами, собственными нуклеазами, тепловым движением, в конце концов. В клетке есть целый арсенал средств, называемый репарирующей системой, для залечивания этих повреждений. В главе 3 мы рассказывали о том, как эта репарирующая система залечивает повреждения, наносимые ультрафиолетовыми лучами. Репарирующая система располагает множеством ферментов. Одни, нуклеазы, рвут цепь ДНК вблизи поврежденного нуклеотида. Другие ферменты расширяют брешь, удаляя поврежденное звено. Но генетическая информация при этом сохраняется, ведь есть вторая, комплементарная цепь, по которой ДНК-полимераза I вновь наращивает удаленную часть цепи ДНК.
Итак, в клетке постоянно залечиваются раны, наносимые молекуле ДНК, причем сплошь и рядом приходится прибегать к хирургическому вмешательству — разрывать одну из цепей двойной спирали. Что произойдет, если одновременно с ремонтом начнется репликация? Дойдя до разрыва цепи, ДНК-полимераза, ведущая репликацию, остановится: не сможет идти ни тот, ни другой процесс. Это катастрофа. Значит, репликацию следует начинать, только до конца убедившись, что ремонт завершен, а судить об этом можно по тому, что обе цепи ДНК целы. Но как это проверить? Пустить какой-нибудь белок вдоль ДНК, чтобы он ее прощупывал? Но на ДНК могут сидеть другие белки, которые не пропустят «ощупывающий» белок, и потом этот контроль очень долог. Где гарантия, что, пока будет проверяться целостность цепи звено за звеном, не произойдет новое повреждение? Нет, такой путь не годится.
И вот тут-то на помощь приходит сверхспирализация. Ведь она возможна только в той ДНК, в которой обе цепи на всем протяжении целы. А убедиться в наличии сверхспирали очень просто — в сверхспиральной ДНК гораздо легче развести две комплементарные цепочки, т. е. раскрыть участок двойной спирали. Раскрытие подобно действию расплетающего белка — оно снимает напряжение в отрицательно сверхспирализованной ДНК. Итак, белку, которому поручен контроль, следует связаться с нужным участком ДНК (он узнает его по определенной последовательности нуклеотидов) и попробовать развести в этом месте комплементарные цепи. Если получилось, то с этого места быстро-быстро начинается репликация. Если развести цепи не удалось, то придется подождать — ДНК еще не готова к воспроизведению.
Не правда ли, очень похоже на то, как мы проверяем исправность электрического шнура? Мы не прощупываем его по всей длине, а просто пропускаем ток. Если ток проходит — все в порядке, если нет — ищем неисправность. Найдя дефект и устранив его, мы вновь проверяем прохождение тока — а вдруг есть еще разрыв? Во всяком случае без такой проверки никто не станет прилаживать шнур. Но ДНК — не проводник, по ней ток не течет, так что пришлось клетке изобрести свой, надо признать, весьма остроумный тестер.
Но сверхспирализация нужна не только для начала репликации. Чтобы понять связь между сверхспирализацией и транскрипцией, проделайте следующий опыт. Подойдите к окну и закрутите двойной шнур от штор по часовой стрелке, пока не получится двойная спираль. Затем вставьте карандаш или авторучку между двумя цепями и начните его двигать вдоль двойной спирали без вращения. Тем самым вы смоделируете процесс транскрипции: карандаш моделирует РНК-полимеразу, а двойной шнур — ДНК. Из такого эксперимента станет ясно, что по мере того, как РНК-полимераза ползет по ДНК, она должна перезакручивать двойную спираль впереди себя и раскручивать ее за собой. Иными словами, ДНК становится положительно сверхспирализованной впереди РНК-полимеразы и отрицательно сверхспирализованной позади нее. Уонг с сотрудниками из Гарварда убедительно доказал, что такие волны сверхспирализации действительно имеют место и в прокариотических, и в эукариотических клетках.
Если вы продолжите опыт со шнуром и карандашом, то вскоре убедитесь, что не сможете больше двигать карандаш, так сильно шнур перекручен впереди карандаша. Следовательно, приходится допустить, что либо молекула ДНК и РНК-полимераза могут вращаться относительно друг друга, либо клетка способна снимать как положительную, так и отрицательную сверхспирализацию. С одной стороны, трудно ожидать, что очень длинная молекула ДНК и громоздкая транскрипционная машина, в случае прокариот еще нагруженная трансляционной машиной (рис. 15), будут вращаться вокруг друг друга. С другой стороны, топоизомеразы как раз способны менять сверхспирализацию. Основываясь на приведенных простых аргументах, Лерой Лю и Джэймс Уонг выдвинули в 1987 году концепцию волн сверхспирализации. Но как же обнаружить эти волны? Ведь при выделении ДНК из клетки память о волнах сверхспирализации теряется, поскольку волна не меняет величину Lk ДНК.
Хотя Уонг с сотрудниками не смог непосредственно наблюдать волны сверхспирализации в клетке, они сумели убедительно доказать реальность этих волн путем выключения различных топоизомераз. Наиболее убедительным было наблюдение положительной сверхспирализации плазмидной ДНК в клетках E. Coli, в которых выключена ДНК-гираза. Объяснение этого замечательного факта состоит в том, что в этом случае топоизомераза I продолжает снимать отрицательные сверхвитки, в то время как происходит накопление положительных сверхвитков, которые в норме снимаются ДНК-гиразой.
Опыты Уонга заставили пересмотреть вопрос о биологической роли сверхспирализации. В самом деле, до этих опытов считалось, что ДНК-гираза существует в E. Coli, чтобы создавать отрицательную сверхспирализацию. Совместно с топоизомеразой I, действующей в противоположном направлении, они поддерживают некую «естественную» или, как говорят биологи, нативную отрицательную сверхспирализацию в клетке. Считалось даже, что путем изменения значения сверхспирализации может грубо регулироваться экспрессия генов.
Опыты Уонга перевернули все эти представления. Оказывается, ДНК-гираза в клетке выполняет работу по снятию положительных сверхвитков, а вовсе не по созданию отрицательной сверхспирализации. Понятие нативной сверхспирализации потеряло всякий смысл, так как локальная сверхспирализация может оказаться сильно положительной, сильно отрицательной или вообще нулевой в зависимости от положения промоторов, от соотношения между скоростью перемещения РНК-полимеразы вдоль ДНК и эффективностью работы топоизомераз по снятию сверхвитков, создаваемых движением РНК-полимеразы.
Физики и математики за работой
Конечно, чтобы понять как следует, в чем состоит роль сверхспирализации, необходимо всесторонне изучить не только ее влияние на биологические функции ДНК, но и на физическую структуру молекулы. За дело взялись физики. Однако сразу же возникли серьезные проблемы. Разные физические методы, с помощью которых пытались измерить величину сверхспирализации, давали разные результаты.
Как-то в начале 1970-х годов Джером Виноград, открывший явление сверхспирализации и работавший в Калтехе (так называют сокращенно Калифорнийский технологический институт), встретил математика Брока Фуллера, также из Калтеха, и попросил его помочь разобраться в проблеме кольцевых ДНК, поскольку сам он к тому времени совершенно запутался. Фуллер живо заинтересовался рассказом Винограда. Он почувствовал, что здесь могут оказаться полезными некоторые результаты, как раз привлекшие внимание математиков в то время. Они касались неожиданной связи между топологией и дифференциальной геометрией.
Эти две области математики изучают одинаковые объекты, кривые и поверхности, но с абсолютно разных точек зрения. Дифференциальная геометрия исследует локальные свойства поверхности, такие как кривизна, кручение. Топологию, напротив, совершенно не интересуют эти характеристики, для нее имеет значение, например, есть ли в поверхности дырки (но не важно, какой формы эти дырки), сколько их и т. д. Так, мраморную статую может изучать и геолог, и искусствовед. Но геолога интересует только камень, а искусствоведа — форма, приданная камню скульптором. Вряд ли эти люди нашли бы между собой общий язык, подходя к делу строго профессионально.
Столь же неожиданной оказалась для математиков связь между дифференциально-геометрическими и топологическими характеристиками одного класса поверхностей — двусторонних полос. Знаменитый лист Мёбиуса — частный случай полосы. Чтобы смастерить лист Мёбиуса, возьмите полоску бумаги, перекрутите ее на 180° вдоль длинной оси и склейте концы полоски. Затем начните с любой точки и ведите карандашом линию, параллельную краям полосы. Вскоре вы увидите, что вернулись к исходной точке, ни разу не оторвав карандаша от листа. Это и есть замечательное, даже несколько загадочное свойство листа Мёбиуса — он имеет всего лишь одну сторону. Поэтому его называют односторонней полосой.
Теперь вырежьте еще полоску из бумаги и вновь склейте концы. Но при этом перекручивайте их не на 180°, как при склейке листа Мёбиуса, а на угол, равный m × 360°, где m — целое число. Вы всегда будете получать двусторонние полосы. У двусторонней полосы два края представляют собой замкнутые кривые, причем они могут быть незацепленными или образовывать зацепление с каким-то значением порядка зацепления Lk, причем очевидно, что Lk = m.
Фуллер быстро сообразил, что с точки зрения математики молекула зкДНК представляет собой двустороннюю полосу. Краями полосы следует считать сахарофосфатные цепи молекулы. То, что зкДНК может быть только двусторонней полосой, — факт чисто химический, связанный с существованием направления в каждой из цепочек ДНК, причем комплементарные цепи направлены навстречу друг другу, т. е. антипараллельны (о чем мы поговорим подробно в конце этой главы). Легко убедиться, что если из такой молекулы попытаться склеить лист Мёбиуса, то ничего не получится — концы комплементарных цепей подойдут друг к другу в положении «голова к голове» и «хвост к хвосту», т. е. не смогут соединиться.
То, что сообщил Фуллер в статье, опубликованной вскоре после его разговора с Виноградом, состояло в следующем. Топологическая характеристика зкДНК, т. е. полосы, Lk не выражается однозначно через какую-либо геометрическую, а следовательно, и физическую характеристику молекулы. Она связана сразу с двумя геометрическими характеристиками. Первая хорошо известна в дифференциальной геометрии. Это кручение, осевая закрутка полосы Tw (от английского слова twist). Это есть суммарное количество оборотов, которое делает вектор, лежащий в плоскости полосы и перпендикулярный оси полосы, при движении вдоль полосы. Вторая характеристика не имела названия. Фуллер впервые дал ей имя — райзинг Wr (от английского глагола writhe, что значит скрючиваться, корчиться), так что модой давать экзотические названия, возникшей сначала в физике элементарных частиц (вспомните кварки, очарование, цвет и т. д.), постепенно заразились и математики.
Результат, приведенный Фуллером, был впервые строго доказан американским математиком Джеймсом Уайтом в 1968 году. Он устанавливает однозначную связь между Lk, Tw и Wr:
Lk = Tw + Wr.
Поразительно то, что столь простая формула (она вполне могла бы принадлежать Гауссу) была открыта столь поздно. Она оказала неоценимую помощь в изучении свойств кольцевых ДНК. В чем же состоит значение этой, казалось бы, простой до примитивности формулы?
Прежде всего очень важно то, что величина Wr зависит только от формы, которую имеет ось полосы в пространстве, но совершенно не зависит от того, как полоса закручена вокруг своей оси. Далее, для Wr существует общая формула, позволяющая вычислить эту величину для любой кривой. Эта формула была известна очень давно и называется интегралом Гаусса, но истинный смысл этого интеграла как разности между Lk и Tw для полосы стал ясен только после построения теории полос.
Наконец, совсем необычно то, что в левой части формулы Уайта стоит величина, которая может принимать только целочисленные значения (это непосредственно следует из определения Lk — ведь количество протыканий поверхности не может быть не целым). В то же время обе величины, стоящие справа, могут принимать любые значения, вовсе необязательно целочисленные.
В этом месте может, даже должен возникнуть целый каскад недоуменных вопросов. Ведь величина Tw — это число оборотов, которые делает полоса вокруг своей оси. Почему же это не целое число, если полоса замкнута? Да и вообще, существует ли райзинг? Чем, собственно, Lk отличается от Tw? Не находим ли мы, вычисляя Lk и Tw, разными способами одну и ту же величину?
Чтобы разобраться во всем этом, поставим опыт. Вырежем из бумаги узкую полоску шириной сантиметр. Обмотаем ею какой-нибудь цилиндрический предмет (типа того, как показано на рис. 29) несколько раз, причем сделаем это так, чтобы полоска при наматывании не закручивалась вокруг собственной оси. Затем чуть-чуть выдвинем концы полоски так, чтобы их можно было склеить. Это не вызовет сколько-нибудь значительной осевой закрутки.

Рис. 29. Полоса, намотанная на цилиндр
Так мы получим замкнутую полосу, у которой, по самому способу ее получения, Tw = 0. Чему же будет равно Lk? Это можно выяснить теперь экспериментально. Возьмем ножницы, проткнем ими полоску в любом месте и разрежем ее вдоль по всей длине. Получатся две сцепленные друг с другом совсем узенькие полоски. Порядок их зацепления и есть Lk краев исходной полосы.
Вот и выходит, что можно создать Lk, не создав никакого Tw. То, что мы делали, когда обматывали полоску вокруг цилиндрического предмета, — это придавали ей райзинг. Равенство Lk = Tw справедливо тогда, когда ось полосы лежит на плоскости. Ощущение, что так должно быть всегда, основано на том, что мы обычно представляем себе полосу (или молекулу ДНК) так, будто ее ось описывает простую фигуру, скажем, окружность или что-то вроде того.
После статьи Фуллера стало ясно, что противоречия при исследовании сверхспирализации возникли потому, что одни методы измеряют физические характеристики, зависящие от Wr, а другие — от Tw. Получив в руки надежный математический аппарат, физики начали планомерно изучать влияние сверхспирализации на свойства зкДНК.
Как раз в то время в обиход стал входить метод гель-электрофореза, о котором мы говорили в главе 5. Была продемонстрирована очень высокая разрешающая способность метода при разделении молекул ДНК, имеющих разную длину. И тогда немецкому ученому Вальтеру Келлеру пришла в голову сумасшедшая идея: а что если попробовать разделить при помощи гель-электрофореза молекулы зкДНК с разными значениями Lk? Принцип разделения здесь должен быть совсем не тот, что для линейных молекул ДНК разной длины.
У молекул, отличающихся только числом сверхвитков (такие молекулы называют топоизомерами), длина будет одинакова. Следовательно, одинаковы будут и заряд, и действующая со стороны электрического поля сила. Однако скорость движения молекулы в геле определяется не только приложенной к ней силой, но и сопротивлением, которое она испытывает при движении. А это зависит в свою очередь от формы молекулы. Ясно, что если молекула имеет форму сильно переплетенной веревки, как на рис. 28, то она будет испытывать гораздо меньшее сопротивление среды при движении в поле, чем расправленная молекула. Иными словами, чем больше райзинг по абсолютной величине, тем быстрее должна двигаться молекула. Речь идет о райзинге, а не об Lk, потому что сопротивление среды определяется пространственной формой оси двойной спирали и не зависит практически от того, как закручена спираль вокруг оси.
Рассуждая таким образом, Келлер стал работать с гелем и вскоре показал, что если нанести на гель препарат сверхспиральной ДНК, выделенной из клетки, то получится набор отдельных полос, отстоящих друг от друга приблизительно на равные расстояния. Единственная дискретная характеристика зкДНК — величина Lk. Значит, молекулы ДНК, находящиеся в этих полосах, могут отличаться друг от друга только значением Lk, т. е. каждая полоса отвечает определенному топоизомеру. Скорее всего, соседние топоизомеры отличаются по значению Lk на единицу. Впоследствии было доказано, что так оно и есть.
Результат разделения молекул зкДНК, отличающихся по величине сверхспирализации, показан на рис. 30. Справа дан снимок геля после окончания электрофореза. Чтобы ДНК была видна, гель прокрашивают флуоресцирующим красителем, который прочно связывается с ДНК и как бы метит ее. Слева показан график зависимости интенсивности флуоресценции красителя от координаты вдоль геля. Можно видеть, насколько четкого разделения удается достичь. По таким картинкам нетрудно подсчитать величину сверхспирализации, отвечающую каждому топоизомеру.

Рис. 30. Разделение молекул ДНК, отличающихся числом сверхвитков, методом гель-электрофореза. Опыт проводился с ДНК маленькой плазмидой рАОЗ, содержащей 1683 пары нуклеотидов. Первоначально молекулы были нанесены сверху, вблизи отрицательной обкладки (это место не показано на рисунке)
В изучении кольцевых ДНК и сверхспирализации метод гель-электрофореза дал столь же много, как и в определении ДНКовых последовательностей. Было сделано множество тонких измерений, позволивших определить важнейшие характеристики зкДНК. Именно с помощью гель-электрофореза была точно определена энергия, которая может быть запасена в ДНК с помощью сверхспирализации.
Какие изменения в структуре ДНК может вызывать сверхспирализация? Понятно, что выгодным будет любое изменение структуры, в результате которого произойдет ослабление напряжения, вызванного в зкДНК сверхспирализацией. Поэтому было ясно, что сверхспирализация должна способствовать образованию в двойной спирали раскрытых областей, а также крестообразных структур. Крестообразные структуры в ДНК могут возникать в участках с последовательностями-перевертышами.
Что такое перевертыши? Они существуют в любом языке, не только в ДНКовом. Вот пример на русском языке: ИСКАТЬТАКСИ. Читайте эту фразу слева направо или справа налево — будет одно и то же (промежутки между словами и знаки препинания при составлении перевертышей не принимаются во внимание). А вот перевертыш подлиннее: НАЖАЛКАБАННАБАКЛАЖАН.
В свое время, когда поступили первые сообщения о существовании и возможной важной роли перевертышей в ДНКовых текстах (это было после открытия рестриктаз), началось повальное увлечение сочинением перевертышей на русском языке среди специалистов по ДНК. Мне очень нравится перевертыш, придуманный в то время Валерием Ивановичем Ивановым, известным специалистом по физике ДНК: РИСЛИНГСГНИЛСИР. Я представляю себе при этом короля и его дворецкого, торжественно провозглашающего: «Рислинг сгнил, сир!»
В ДНКовых текстах часто встречаются перевертыши. Из-за того, что ДНК состоит из двух цепей (т. е. как бы из двух параллельных, точнее, антипараллельных текстов), перевертыши могут быть двух типов. Такие перевертыши, как в обычном, одиночном тексте, называют зеркальными. В ДНК чаще встречаются перевертыши, которые читаются одинаково по каждой из цепей в направлении, заданном химическим строением ДНК (еще раз напомним, что две цепи ДНК имеют противоположное направление).
Практически всегда такими перевертышами бывают те участки, которые узнаются рестриктазами. Вот примеры (слева дано название рестриктаз; эти названия весьма причудливы, так как включают в себя первые три буквы названия бактерии, из которой выделена рестриктаза; стрелками показаны места разрезания ДНК рестриктазой):

Так вот, замечательное свойство ДНКовых перевертышей состоит в том, что они могут образовывать крестообразные структуры. В самом деле, ведь обязательно левая половина перевертыша будет комплементарна правой, т. е. можно сделать так:

для места узнавания рестриктазой ЕсоRI и аналогично для любого другого перевертыша. Во всяком случае это не противоречит правилу комплементарности.
Однако сразу возникают вопросы. Разрешает ли структура ДНК существование таких резких изломов, какие должны возникнуть в двух вершинах креста? Ведь цепь ДНК обладает определенной жесткостью, не так просто сделать в ней резкий излом. В главе 3 мы уже обсуждали эту проблему в связи с укладкой ДНК в хромосомах. Двойная спираль — весьма жесткая штука, и для ее изгибания в хромосомах существуют специальные белки (гистоны и другие). Правда, одиночная цепь гораздо менее жесткая, так что вообще изломы в одиночной цепи возможны. Но они требуют затрат энергии. Поэтому совершенно неясно, зачем в ДНК будет возникать крест, если он может превратиться в регулярную двойную спираль. Но все это так в случае линейных молекул. А в сверхспирализованных?
Образование креста приводит к снятию сверхспирального напряжения. Не может ли это сделать выгодным образование креста в сверхспиральной ДНК? Какая сверхспирализация для этого необходима?
Чтобы ответить на все эти вопросы, группа теоретиков Института молекулярной генетики АН СССР — Вадим Аншелевич, Александр Вологодский, Александр Лукашин и автор этих строк — в 1979 году подробно проанализировала процесс образовании раскрытых и крестообразных структур в линейных и сверхспирализованных ДНК1. Теоретический анализ показал, что вероятность образования и раскрытых пар, и крестов в линейной ДНК очень мала. Особенно ничтожна вероятность возникновения креста — она порядка 10−15, т. е. практически равна нулю. С ростом сверхспирализации картина очень сильно меняется. Быстро увеличивается вероятность образования раскрытых пар. Но вероятность образования крестов в коротких перевертышах вроде тех, которые узнаются рестриктазами, остается пренебрежимо малой при любых значениях сверхспирализации.
Другое дело — более длинные перевертыши, содержащие 15–20 или более пар. Такие перевертыши редко, но встречаются в ДНК. Вот, например, перевертыш из плазмиды Соl Е1, он показан на рис. 31. Для таких длинных перевертышей вероятность образования крестов растет, согласно расчетам, фантастически резко с ростом сверхспирализации. При нормальных значениях сверхспирализации, типичных для многих ДНК, вероятность образования креста оказывается порядка единицы, т. е. становится в 1015 (миллион миллиардов!) раз больше, чем в линейной молекуле. После того как наши теоретические предсказания были опубликованы, многие экспериментаторы принялись искать крестообразные структуры в зкДНК. Первыми финишировали две команды — британская (Дэвид Лилли) и американская (Роберт Уэллс). Им удалось доказать, что длинные перевертыши в сверхспиральных ДНК действительно образуют кресты.

Рис. 31. Такой крест образуется в ДНК Со1Е1, когда она находится в сверхспиральном состоянии
Как же удалось это сделать? Ведь сами шпильки, возникающие в крестообразных структурах, слишком малы, чтобы их можно было разглядеть даже в электронный микроскоп. Поэтому для поиска крестов был применен такой прием. Сверхспирализованную ДНК обрабатывали ферментом — однонитевой эндонуклеазой. Этот фермент рвет только одиночную цепь ДНК, но не трогает двойную спираль. Поэтому обычную линейную, или кольцевую замкнутую, но не сверхспирализованную молекулу фермент не разрывает. Оказалось, однако, что сверхспирализованную ДНК он разрывает, причем в строго определенном месте. Определили последовательности нуклеотидов слева и справа от места разрыва. Оказалось, что во всех случаях разрезание шло строго в середине больших перевертышей, именно тех, в которых, согласно теоретическим расчетам, должны образовываться кресты. Такие опыты, казалось бы, могут иметь только одно объяснение: в сверхспирализованных ДНК в местах длинных перевертышей двойная спираль с большой вероятностью превращается в крестообразную структуру; однонитевая эндонуклеаза разрывает образующиеся при этом в вершинах креста однонитевые петли.
Однако вскоре возникли сомнения. Образуются ли кресты на самом деле в ДНК или они возникают лишь под действием белка, однонитевой эндонуклеазы? Чтобы рассеять эти сомнения, необходимо было зарегистрировать образование крестов каким-либо другим методом, без фермента. Но, как уже говорилось выше, непосредственно увидеть кресты нельзя даже под электронным микроскопом. Как же быть?
Вновь на помощь пришел метод гель-электрофореза. Воистину нет цены тем услугам, которые эта удивительно простая методика оказала и продолжает оказывать тем, кто занимается ДНК. Мы привыкли к тому, что научный прогресс немыслим без сложнейших, дорогостоящих установок, начиненных сверхсовременной электроникой, сверхмощными компьютерами, лазерами и бог знает чем еще. Эти установки многие годы разрабатывают мощные фирмы с многотысячным персоналом, и стоят они десятки и сотни тысяч долларов. А вот представьте себе, что вы попали в лабораторию 1980-х годов, где проводились работы по изучению структуры ДНК, пользующиеся широкой известностью, и попросили показать экспериментальную установку, на которой эти работы были выполнены. Вы были бы поражены. Вас бы провели в комнату, в которой ничего не было, кроме обычного химического стола. Среди всяких склянок с реактивами вам показали бы небольшую, явно самодельную прозрачную коробку из плексигласа, частично заполненную водой, от которой отходят два тоненьких провода. И все. И вам еще сказали бы, что в это самое время на этой установке идет важный опыт. Вы почувствуете себя одураченным, как на выступлении хорошего фокусника. «Не может быть, — воскликнули бы вы, — чтобы с помощью такой примитивной штуки можно было решать тончайшие вопросы структуры ДНК, которые не помогают выяснить ни самые мощные электронные микроскопы, ни другие чудеса современной техники! Это какой-то обман».
Никакого обмана нет. Просто, как в любом хорошем фокусе, самого главного не разглядишь. Разумеется, этот волшебный ящик был бы совершенно бесполезен, если бы в нем не лежала прозрачная пластинка геля, а на гель не был бы наслоен образец ДНК, который вы, конечно, не могли заметить. И весь фокус в том, что это за ДНК. Она была специально приготовлена с использованием самых изощренных методов генной инженерии. Прежде чем попасть в этот неказистый приборчик, ДНК прошла через руки многих людей, крупнейших экспертов в своем деле, разбросанных по лабораториям в разных частях света. И каждый использовал все свои знания, все свое умение, чтобы изменить свойства этой ДНК нужным ему образом. Наконец, где-то в одной из соседних комнат были проведены последние приготовления ДНК к запланированному опыту. Вот вам и разгадка фокуса. В последние десятилетия успех в исследовании структуры ДНК стал невозможен без освоения специалистами по структуре ДНК методов генной инженерии.
Но вернемся к крестам. Использование метода гель-электрофореза для регистрации крестов в ДНК основано на том, что в результате перехода участка ДНК, имеющего последовательность-перевертыш, в крестообразное состояние, происходит частичное снятие сверхспиральных напряжений в молекуле. Молекула расправляется, становится менее сверхскрученной и начинает медленнее двигаться в геле под действием электрического поля из-за большего сопротивления среды. В результате топоизомер, в котором образовался крест, оказывается на электрофореграмме, типа приведенной на рис. 30, выше, чем топоизомер, имеющий на единицу меньшее число отрицательных сверхвитков, но не несущий креста. Так что в случае образования крестов должна нарушаться регулярная «лесенка», в которой топоизомеры с ростом отрицательной сверхспирализации движутся все быстрее и быстрее. Происходит наложение двух «лесенок» — отвечающих топоизомерам без крестов и с крестами. В результате на опыте возникает довольно сложная картина полос, в которой легко запутаться.
Разобраться в этой картине помогает остроумный прием, придуманный в начале 1980-х годов и получивший название «двумерный гель-электрофорез».
Опыт проводят не в столбике геля, как в случае традиционного, одномерного гель-электрофореза, а в квадратной пластинке из геля. На один из углов пластинки наслаивают образец ДНК и к двум противоположным сторонам квадратной пластинки прикладывают электрическое поле. В результате получают систему полосок, идущих вдоль одной из сторон пластинки. Эта картина тождественна той, которая получается при одномерном гель-электрофорезе. Теперь электроды переключают так, чтобы электрическое поле было перпендикулярно тому полю, в котором проводили первое разделение. При этом гель насыщают молекулами хлорокина. Эти молекулы связываются с двойной спиралью ДНК и уменьшают осевую закрутку (т. е. величину Tw). Связывание приводит к резкому уменьшению сверхспирального напряжения во всех топоизомерах образца, и его оказывается недостаточным, чтобы вызвать образование крестов. Кресты исчезают, и, следовательно, при гель-электрофорезе во втором направлении должна образоваться только одна, регулярная «лесенка». То, что в результате получается, видно на рис. 32.
Самое главное в этой картине — это то, что в регулярном следовании пятен происходит разрыв. В том, что во всех топоизомерах, идущих после разрыва, действительно возник крест, легко убедиться с помощью однонитевой эндонуклеазы. Если провести двумерный электрофорез после обработки препарата ДНК однонитевой эндонуклеазой, то на получившейся картине исчезают все пятна, следующие после разрыва. Это происходит потому, что эндонуклеаза атакует однонитевые петли креста и рвет их. ДНК перестает быть замкнутой, топологические напряжения снимаются, и все топоизомеры превращаются либо в расправленные кольца, либо (после длительной обработки однонитевой эндонуклеазой) в линейные молекулы.
Если далее локализовать место разрыва на молекуле ДНК, то оказывается, что эндонуклеаза наносит разрыв в точности в центре главного палиндрома. Такие опыты, проведенные впервые Виктором Лямичевым и Игорем Панютиным все в том же Институт молекулярной генетики АН СССР, окончательно рассеяли всякие сомнения в том, что кресты действительно самопроизвольно возникают в ДНК при достаточной отрицательной сверхспирализации. Эти опыты также продемонстрировали, что наши теоретические предсказания вероятности образования крестов в сверхспиральных ДНК верны количественно.

Рис. 32. Типичная картина двумерного гель-электрофореза, наблюдаемая при образовании в ДНК крестообразных или других альтернативных структур, о которых речь будет идти в главе 9. Специально приготовленная смесь различных топоизомеров одной и той же ДНК, несущей вставку, способную переходить в альтернативную структуру, была помещена в левый верхний угол квадратной пластинки геля. Затем было приложено электрическое поле так, чтобы молекулы ДНК двигались сверху вниз вдоль левого края пластинки. После завершения разделения топоизомеров в первом направлении гель насыщали молекулами хлорокина, которые уменьшают сверхспиральное напряжение. Концентрацию хлорокина подбирали с таким расчетом, чтобы сверхспирального напряжения было недостаточно для образования альтернативной структуры. Затем направление электрического поля меняли так, чтобы молекулы двигались слева направо. В результате последовательность пятен во втором направлении соответствовала последовательности топоизомеров.
Самое верхнее пятно отвечает нулевому топоизомеру, т. е. релаксированной, несверхспирализованной ДНК. Пятна, следующие от этого пятна по часовой стрелке, отвечают положительным топоизомерам, а те, что против часовой стрелки, — отрицательным. Ясно виден скачок подвижности, наблюдающийся в данном случае между топоизомерами −10 и −12. Это означает, что в топоизомерах −12, −13,... альтернативная структура присутствует, а в топоизомерах..., −9, −10 она отсутствует. Топоизомер −11 занимает промежуточное положение — в нем альтернативная структура то образуется, то исчезает
Какова роль крестов в ДНК? Пока об этом ничего не известно. Думают, что крестообразные структуры могут служить местами посадки на ДНК каких-то белков. Во всяком случае кресты — это первый надежно доказанный пример того, что структура отдельных участков биологически активной ДНК может существенно нарушаться при условиях, близких к тем, в которых ДНК функционирует в живой клетке. Насколько важную роль играют эти и, возможно, другие нарушения, о которых будет рассказано в главе 9, в работе ДНК в клетке — это вопрос дальнейших исследований.
Проблема концов
Эволюция — бездарный инженер. Она действует методом тыка или, выражаясь по-научному, методом проб и ошибок. Эволюцию не заботят отдаленные последствия принятых решений, лишь бы как-то решить сиюминутную проблему. Она не считается с гибелью почти всех ради выживания немногих, лишь бы выжившие еще протянули. Такая недальновидная инженерия сплошь и рядом заводит в эволюционные тупики, приводит к полному вымиранию целых видов. Можно лишь поражаться, что такой бездарный инженер создал все это буйство жизни, которое нас окружает, и нас самих, способных оценить степень бездарности нашего создателя. И в дополнение к своей собственной бездарности эволюции приходится работать в условиях строгих ограничений, налагаемых изначально избранной химической природой главных биологических молекул, прежде всего ДНК и РНК.
Эта химическая природа диктует жесткие правила, которым должны подчиняться процессы синтеза самих этих молекул. Одиночная цепь ДНК (и РНК) имеет химически заданное направление, т. е. концы различны. Конец, который принято считать началом цепи, обозначают как 5’ и называют «пять-штрих конец». Противоположный конец обозначают как 3’ и называют «три-штрих конец».

В двойной спирали цепи антипараллельны, т. е. направлены навстречу друг другу.

Так вот, цепи ДНК (и РНК) могут удлиняться только с 3’-конца, точнее с 3’-концевой гидроксильной группы OH. Удлинение производится при помощи специальных ферментов: ДНК- и РНК- полимераз. Ну это для читателя не новость, об этих ферментах уже много говорилось выше. Напомним, что, чтобы вести синтез, полимеразам необходимы четыре предшественника нуклеотидов и матрица (цепь ДНК или РНК), чтобы полимераза знала, какой нуклеотид ставить следующим. Эволюция привнесла еще одно существенное ограничение или, если хотите, ляп. ДНК-полимераза не способна начать синтез ДНК, имея только матрицу: ей еще подавай затравку (называемую праймером) с 3’-концевой OH-группой, иначе она работать категорически отказывается. Это свойство всех ДНК-полимераз (и ревертаз). РНК-полимеразы не столь привередливы, им достаточно матрицы, чтобы начать синтез. Кстати, ДНК-полимеразе безразлична химическая природа праймера (ДНК или РНК), лишь бы была 3’-концевая OH-группа. Одиночная цепь ДНК с сидящим на ней праймером выглядит так:
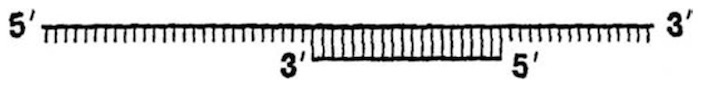
Вот на этой конструкции ДНК-полимераза работает с большим удовольствием, быстро и практически без ошибок превращая ее в такую:

Проблема праймирования уже обсуждалась нами в главе 5 в связи с секвенированием ДНК методом Сэнгера. В лаборатории эта проблема решается просто: вы заказываете нужный праймер в одной из множества фирм, синтезирующих кусочки ДНК (олигонуклеотиды) по заказу. Праймеры почти ничего не стоят, и их делают очень быстро. Это прекрасно, но как же быть клетке, если ей необходимо реплицировать свою ДНК? Тоже прикажете в фирму обращаться? Наш инженер вроде бы нашел выход из положения. Он приспособил к делу РНК-полимеразу, благо ей праймер не нужен. Такая РНК-полимераза, которая играет в клетке роль фирмы по синтезу РНКовых праймеров, называется праймазой. Вот вам и еще один пример былого величия РНК.
Может, наш инженер не так уж глуп, просто, когда еще в эпоху предбиологической эволюции впервые понадобилась ДНК-полимераза, проще оказалось воспользоваться уже готовой РНК-полимеразой, чем создавать ДНК-полимеразу, способную работать без праймера. Да, возможно, наш инженер и не глуп, но уж точно недальновиден. Проблема с репликацией ДНК все-таки возникла, причем серьезнейшая. Скорее всего, не сразу, а гораздо позже, в ходе биологической эволюции, когда что-либо изменить в ДНК-полимеразе было уже невозможно — все поломаешь. В чем же проблема?
Представим себе одноцепочечную линейную ДНКовую матрицу, и пусть праймаза сделает праймер на самом 3’ краю нашей матрицы:

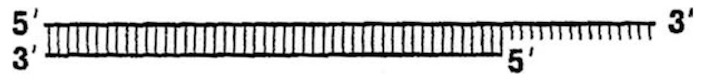
(Мы выделили праймер волнистой линией, чтобы подчеркнуть его РНКовую природу.) ДНК-полимераза достроит комплементарную цепь ДНК начиная с 3’-конца праймера и до самого 5’ конца матрицы. Получится почти полноценная двойная спираль ДНК:

Вот именно, что «почти»: ведь на 5’-конце новой цепи сохранился кусочек РНК! Конечно, этот РНКовый кусочек легко удалить, для этой цели существует специальный фермент:
Но проблему это не решает. Как заполнить удаленную часть ДНКовыми нуклеотидами? Матрица есть, а 3’-конца-то нет, вместо него никчемный 5’-конец! Получается, что при каждом цикле репликации ДНК укорачивается на размер РНКового праймера. Самоедство какое-то, да и только. Все-таки никудышный инженеришко нам достался. Опять надо как-то выкручиваться, а то постепенно весь геном проедим. И прокариоты, и эукариоты нашли выход из тупика, в который их завела недальновидная эволюция, но они вышли из трудного положения совершенно по-разному.
Представим себе, что наша матрица замкнута сама на себя. Тогда, дойдя до праймера и уткнувшись в его 5’-конец, ДНК-полимераза может подождать, пока другой фермент (или экзонуклеазный домен самой ДНК-полимеразы) удалит РНКовый праймер, а затем ДНК-полимераза продолжит синтез ДНК до полного покрытия матрицы (рис. 33). Именно так решают проблему бактерии и вирусы, у которых ДНК всегда реплицируется в кольцевом состоянии (также реплицируется и митохондриальная ДНК в цитоплазме эуакариот). Не правда ли, изящное решение? Здесь наш инженер превзошел самого себя, надо отдать ему должное.

Рис. 33. У кольцевой ДНК не возникает укорочения при синтезе комплементарной цепи. На последнем этапе брешь залечивается ДНК-лигазой
Не так славно дело обстоит с геномной ДНК эукариот, т. е. у нас с вами. Здесь найденное решение изящным не назовешь. Судите сами. У эукариот геномная ДНК всегда линейна. У нас с вами в каждой клетке тела находятся ровно 46 линейных молекул ДНК, по числу хромосом. Как же быть с их неизбежным укорочением при каждом клеточном делении? Оказывается, на обоих концах всех этих ДНК имеются длиннющие последовательности, называемые теломерами, которые ничего не кодируют и представляют собой регулярные повторы. В частности, у человека (да и у всех позвоночных) повторяется мотив из шести букв: 5’ТТАГГГ3’. Много тысяч раз этот мотив повторяется в виде двухцепочечной ДНК, только на самом конце хромосомные молекулы ДНК имеют одноцепочечный хвост, содержащий десятки повторов 5’ТТАГГГ3’, причем всегда выступает 3’-конец. Наличие теломеров позволяет основной части ДНК оставаться в целости и сохранности в ходе многих циклов репликации, каждый раз жертвуя несколькими теломерными повторами. Понятно, однако, что так можно только оттянуть развязку, но не решить проблему самоедства.
Загадка концов хромосом была разгадана Элизабет Блэкбёрн в середине 1980-х годов, когда она работала в Калифорнийском университете в Беркли. Блэкбёрн обнаружила необычный фермент, который она назвала теломеразой и который способен наращивать теломерные концы. Как же он это делает, ведь 3’-конец торчит наружу, не хватает матрицы? Оказалось, что теломераза таскает матрицу с собой в виде довольно длинной молекулы РНК (опять РНК!), которая содержит несколько повторов, комплементарных торчащим наружу теломерным повторам (т. е. РНК содержит повтор 5’ЦЦЦУАА3’). Белковая часть фермента представляет собой ревертазу. Фермент подставляет РНКовую матрицу к однонитевому 3’-концу хромосомной ДНК, и этот конец служит праймером для ревертазы-теломеразы, которая удлиняет конец (рис. 34). Так делается много раз, а затем праймаза синтезирует праймер на нарощенной цепи, и ДНК-полимераза синтезирует вторую цепь.
Вот таким хитроумным способом эукариотическая клетка защищает свои гены от самоедства. За открытие теломеразы Блэкбёрн была удостоена Нобелевской премии по физиологии и медицине за 2009 год.

Рис. 34. Удлинение теломерных концов теломеразой у эукариот. Одноцепочечный 3’ — конец хромосомной ДНК связывается с комплементарным участком теломеразной РНК и служит праймером, в то время как теломеразная РНК служит матрицей для белковой части теломеразы, которая работает в качестве ревертазы. После акта полимеризации цепи ДНК и РНК расходятся, 3’ — концевой участок вновь связывается в начале матричной части теломеразной РНК, и все повторяется. В результате таких циклов наращивается длинный одноцепочечный «хвост», который в дальнейшем превращается в двойную спираль с помощью обычной ДНК-полимеразы. Остается лишь короткий 3’ — концевой хвостик, как на верхней части рисунка
Интересно, что теломераза работает только в половых клетках. Так что, пока мы живем и клетки нашего тела (соматические клетки) делятся, они используют резерв теломерных концов, нарощенных в половых клетках. Московский ученый Алексей Оловников впервые предположил еще в начале 1970-х годов, что исчерпание этого резерва теломерных повторов и поедание самих генов является одной из основных причин старения. Пока неясно, насколько это так, но теломеры в наших клетках действительно укорачиваются с возрастом.
1 Много воды утекло с той поры. Нет больше СССР, разбросало по миру участников работы: Вадим Аншелевич перебрался в Даллас (Техас), Саша Вологодский — в Нью-Йорк. Только Саша Лукашин, вплоть до своей безвременной кончины в 2004 году, находился поблизости от автора этих строк, правда, не в Москве, а в Бостоне.
-
"Молекулы ДНК как следует не кристаллизовались и давали весьма бедные рентгенограммы вроде той, что приведена на рис. 3. Нечего было даже пытаться решить с помощью таких рентгенограмм обратную задачу рентгеноструктурного анализа, т. е. научиться восстанавливать пространственную структуру молекулы, как это пытались сделать для белков Перуц и Кендрю. Однако кое-какие очень важные параметры молекулы все же удалось извлечь. Эти параметры, полученные Р. Франклин, а также детальные данные о химическом строении ДНК и были положены Уотсоном и Криком в основу их работы."












Рис. 26. В замкнутой кольцевой ДНК две комплементарные цепочки образуют зацепление высокого порядка