Не расплыться как бактерия
Что делают с нашим организмом антибиотики
Владислава Казюкова,
химический факультет МГУ
«Коммерсантъ Наука» №10(2), апрель 2020

Биохимикам МГУ удалось экспериментально проверить математическую модель того, как один из самых эффективных на данный момент антибиотиков — моксифлоксацин — взаимодействует с клеточной мембраной. Модель подтвердилась. Оказалось, что антибиотик даже слишком хороший.
Инфекционные заболевания лечатся антибиотиками — веществами, способными замедлить рост и размножение патогенных грибков, бактерий и простейших. К тому же существуют антибиотики, которые демонстрируют противоопухолевую активность. Вопреки распространенному мнению, на вирусы они никакого эффекта не оказывают.
Антибиотики воздействуют на различные компоненты клетки возбудителя. В этом отличие антибиотиков от других медикаментов: они устраняют причину заболевания, а не борются с симптомами болезни.
Но патогены совершенствуются, что требует других лекарств, поэтому поиск источников новых антибиотиков — одна из интереснейших задач современных ученых. Существует и другой подход к созданию соединений, обладающих бактерицидным эффектом, — синтетический, однако пока что он не очень эффективен. Особенно учитывая то, что препарат, убивающий микроорганизмы, часто вызывает у пациента неспецифическую реакцию, что связано с воздействием антибиотика на собственные клетки тела. Например, нобелевский лауреат Пауль Эрлих синтезировал и протестировал 606 препаратов, прежде чем найти лекарство от сифилиса, которое лишь незначительно вредило лабораторным мышам и полностью избавляло их от бактерии-возбудителя. Конечно, Эрлих проводил свои исследования в начале XX века и потому не обладал техникой и вычислительными мощностями, которые доступны науке сейчас. Однако и спустя сто лет предсказательной способности алгоритмов все еще недостаточно для того, чтобы быстро смоделировать вещество с необходимой активностью.
Где в природе искать антибиотики
Подавляющее количество соединений, обладающих антибиотической активностью, выделено из микроорганизмов и грибов.
Как определить, что какой-либо организм продуцирует антибактериальные вещества? В начале золотого века антибиотиков это делалось так: определенный штамм бактерий, грибов или плесени помещался на чашку Петри, куда заранее были высеяны лабораторные бактерии на твердую питательную среду. Если через какое-то время хранения этой чашки в благоприятных для тестируемого организма условиях оказывалось, что вокруг него образовалась «плешь», то есть лабораторные микроорганизмы умерли, то подопытный точно вырабатывает бактерицидное вещество. Затем его клетки разрушали и методично анализировали содержимое, в конце концов находя биологически активное вещество.
В наше время стала доступна технология секвенирования — расшифровки генома. С ее помощью можно обнаружить участок ДНК, кодирующий новый антибиотик, аккуратно его вырезать и внедрить в штаммы-продуценты.
Новые вещества, схожие по строению с уже известными, обнаруживаются в высших растениях (класс антибактериальных фитонцидов был открыт в 1929 году) и глубоководных рыбах, которые никогда не болеют опухолевыми заболеваниями. К тому же из-за совершенствования технологий моделирования молекул открываются возможности получения полностью синтетических препаратов. Немаловажно, что полностью сконструированные человеком в лаборатории препараты очистить от бесполезных или токсичных примесей намного труднее, чем природные: организмы чаще всего имеют ферментативную систему для этой цели, тогда как синтетикам приходится довольствоваться лабораторными методами, не обладающими энзиматической селективностью.
Битва бактерий с антибиотиком
Использование антибиотиков сопряжено со сложностями.
Во-первых, постепенно патогенные микроорганизмы могут обрести резистентность к используемым против них средствам. Например, биохимиков, которые долгое время работали со штаммами клеток, устойчивых к канамицину, нельзя им лечить от инфекций, потому что штаммы могли попасть в организм ученых и в результате горизонтального переноса генов привить внешнему патогену устойчивость к данной молекуле. Положительная селекция с геном устойчивости к определенному антибиотику применятся в молекулярной биологии: при выращивании клеточной культуры на чашке Петри в агар — питательную твердую среду для бактерий — добавляется определенный бактерицидный препарат, и выживают только те колонии, которые могут противостоять его действию, получив резистентность в результате деления. Тот же процесс протекает и в нашем организме при несистематическом лечении антибиотиками.
Механизмы устойчивости
Переданные гены могут кодировать следующие механизмы устойчивости:
Эффлюкс. Это активное выведение активного вещества из клетки посредством белкового насоса, встроенного в мембрану клетки. В разных видах организмов движущая сила у этого процесса разная, но схема одна: как только вредоносная молекула обнаруживается в цитоплазме, она переносится к насосу, и при прохождении через него клетка «закачивает» внутрь иное вещество: ионы натрия, водорода.
Защитный белок. Он нужен для инактивации антибиотика. Например, пенициллины содержат в своем составе бета-лактамное кольцо, а многие бактерии производят фермент бета-лактамазу, который гидролизуют одну из связей в кольце и, как следствие, разрушает молекулу антибиотика. А класс веществ, схожий с пенициллинами строением, — аминогликозиды — подвергается ферментативной модификации, чтобы они не могли связываться с рибосомами и мешать синтезу белка.
Во-вторых, некоторые антибиотики действуют на всю микрофлору, которая есть в организме человека. Известный модельный организм для биологических исследований, кишечная палочка, которая существует в кишечнике теплокровных, тоже может подвергаться атаке антибиотиков наряду с патогенными бактериями. Именно поэтому после курса антибиотиков врачи рекомендуют пить восстанавливающие баланс в пищеварительной системе лекарства и принимать витамин К.
В-третьих, прием антибиотиков связан с побочными эффектами: от головокружения и изменения восприятия вкусов до лейкопении и повреждения суставов. Каким бы ни задумывался эффект фармацевтического препарата, его активное вещество — очень сложная органическая молекула, состоящая из многих атомов, связанных разными взаимодействиями. Она может неспецифично связываться с составляющими эукариотических клеток, повреждая или деформируя их.
Чтобы выяснить, как именно та или иная компонента лекарства воздействует на организм человека, исследователи все чаще используют компьютерное моделирование. С помощью математических расчетов химических, электростатических и других взаимодействий можно предсказать поведение клеток, вблизи которых оказалась молекула антибиотика. Особенно интересно исследовать взаимодействие препаратов с клеточной оболочкой, потому что прежде чем достичь цели, молекулы лекарственного препараты должны миновать множество тканей организма пациента, не нарушив их целостности. Но компьютерное моделирование, каким бы сложным оно ни было, требуют экспериментального подтверждения. И здесь в игру вступают химики-энзимологи.
Поколения антибиотиков
Бактерицидные препараты разбиты на «поколения»: препараты первого поколения — те, которые были выделены из природных источников (например, пенициллин из плесени) и используются без химических модификаций. Но из-за приобретенной микроорганизмами устойчивости некоторые лекарства перестают действовать. В таком случае структурные фрагменты антибиотика, инактивируемые или разрушаемые бактериями, защищаются дополнительным заместителем — появляются лекарства второго поколения. Так, внося коррективы в формулу действующего вещества для повышения эффективности и скорости его действия, а также совершенствуя способ применения, ученые создают последующие поколения антибиотиков.
Антибиотик против оболочки клетки
Сотрудники кафедры химической энзимологии химического факультета МГУ им. М. В. Ломоносова вместе с исследователями ИНЭОС РАН под руководством доктора химических наук Елены Кудряшевой впервые экспериментально проверили математически рассчитанную модель взаимодействия моксифлоксацина с липидной оболочкой клетки. Моксифлоксацин — один из самых действенных антибиотиков широкого спектра, поражающий множество как грамположительных, так и грамотрицательных бактерий-возбудителей. Это противомикробное средство класса фторхинолонов IV поколения, которое с 2012 года включено в Перечень жизненно необходимых и важнейших лекарственных препаратов.
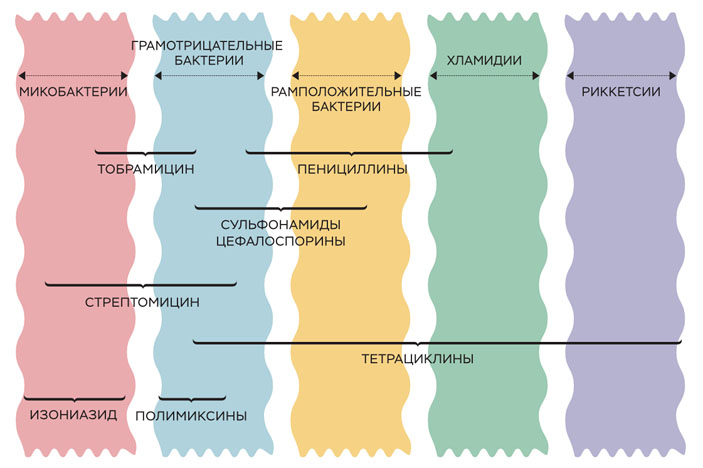
Болезнетворные микроорганизмы и спектры действия антибиотиков
Структура моксифлоксацина предупреждает его эффлюкс из клетки патогена (из-за дополнительного кольца в положении 7). Он применяется при лечении острого бронхита, внебольничной пневмонии, острого бактериального синусита и прочих заболеваний дыхательных путей, кожных инфекций и поражений мягких тканей.
Как и у всех хинолонов и фторхинолонов, его действие направлено на ингибирование ДНК-гираз и бактериальной топоизомеразы IV, активность которых необходима для протекания таких фундаментальных процессов, как репликация и транскрипция. Из-за ингибирования этих ферментов невозможно свернуть обратно раскрученную суперспираль ДНК — «разрезать» ее гираза может, а вот «сшить» обратно — уже нет.
В ходе предыдущих исследований было выяснено, что большинство часто встречающихся побочных эффектов у пациентов, принимающих моксифлоксацин, — чувствительность к свету, тромбоз и прочее — вызвано неспецифическим взаимодействием препарата с клеточными оболочками. Теперь предстояло выяснить, что же именно происходит в клетке.
Клеточная мембрана человека включает в себя белки и жиры, которые в основном представлены фосфолипидами. Молекула такого липида состоит из полярной «головы» — фосфатной группы, которая обладает гидрофильными свойствами, и неполярных хвостов — длинных углеводородных цепей. Фосфолипиды образуют двойную структуру: гидрофильные остатки в сторону клетки и наружу, а между ними — прослойка из двух гидрофобных частей, называемая бислоем. В общепринятой у биологов жидкостно-мозаичной модели мембраны считается, что белковые молекулы растворены в жидком фосфолипидном бислое. Получающаяся тонкая мембранная пленка походит на мыльный пузырь — переливчатая, существующая в основном из-за сил поверхностного натяжения.
Чтобы изучить влияние антибиотика, в качестве модельной «клетки» организма-носителя исследователями использовалась липосома, сконструированная из дипальмитоилфосфатидилхолина (DPPC), окруженная стабильным частично проницаемым бислоем фосфолипида — кардиолипина (CL2-).
При pH = 7,4 — физиологическом значении кислотности в организме — моксифлоксацин существует в виде цвиттер-иона, то есть и карбоксильная группа, и аминогруппа заряжены. Последняя заряжена положительно, и из-за этого происходит образование комплекса моксифлоксацин — гидрофильный слой липидов. Этот вывод подтвержден методом ИК-спектроскопии, которая позволила уточнить, что связывание протекает между азотом моксифлоксацина с ацильными и фосфатными фрагментами кардиолипина, тогда как гидрофильная часть DPPC защищена положительно заряженной холиновой группой. К тому же, при исследовании образования комплекса фторхинолон — липидная оболочка в ультрафиолетовом диапазоне выяснено, что спектр излучения антибиотика становится менее интенсивным, что говорит об изменении его ионного состояния.
«Комплексообразование моксифлоксацина с липидным бислоем влияет на температуру фазового перехода клеточной мембраны: полное ожижение мембраны при добавлении антибиотика достигается при температуре на 2–3 градуса ниже, чем в контрольной системе, то есть нарушается ее текучесть, — рассказывает один из соавторов работы, сотрудник кафедры химической энзимологии химического факультета МГУ кандидат химических наук Ирина Ле-Дейген. — Из-за последующих нарушений подвижности белковых компонентов в жидком фосфолипидном бислое нарушаются важнейшие функции клеточных мембран — регуляторная, транспортная и защитная. Предположительно, в крайнем случае взаимодействие моксифлоксацина с отрицательно заряженной поверхностью мембраны может привести к разрушению целостности эукариотической клетки».
Как говорят авторы работы, данное исследование не просто позволяет лучше понять, как антибиотики, повсеместно применяемые для лечения теплокровных, могут негативно воздействовать на их организм. Речь идет об изменении направлений разработки новых антибиотиков на основе полученных данных. Скорее всего, изменения в формулах будущих препаратов будут направлены не столько на повышение их эффективности, сколько на уменьшение количества побочных эффектов. Меньшее количество сопутствующих воздействий может быть достигнуто и с помощью адресной доставки, которая на данный момент не применяется к хинолонам и фторхинолонам.
Механизмы воздействия антибиотиков
Большинство существующих препаратов способствуют разрушению клеточной мембраны микроорганизма. Так, например, действуют пенициллины. Они связываются с ферментом-катализатором одной из стадий образования пептидных сшивок в муреине (основном компоненте клеточной оболочки грамположительных бактерий), потому что по своей структуре напоминают его субстрат. Другой своей частью — бета-лактамным кольцом — молекула антибиотика приближается к остатку серина в составе фермента и образует прочную с ним связь, которая блокирует активный центр. Этот процесс способствует синтезу ослабленной клеточной стенки и ведет к гибели клетки микроорганизма. Чаще всего такие антибиотики применяются вместе с ингибиторами бактериальных ферментов бета-лактамаз, которые могут нарушить структуру вещества. Сходным механизмом воздействия обладают и цефалоспорины.
Другой тип препятствует нормальной выработке белков, ингибируя трансляцию, воздействуя на рибосому, мРНК и проч. Некоторые классы антибиотиков — аминогликозиды и тетрациклины — мешают нормальному функционированию малой субъединицы рибосомы, то есть синтезу белка. Одни провоцируют появление ошибок при сборке белка с матричной РНК — в белковую последовательность встраиваются не те аминокислоты. Другие мешают связыванию малой субъединицы рибосомы с аминокислотой, которая должна продолжить синтезируемую цепь пептида.
Еще один класс антибиотиков мешает синтезу ДНК в процессе репликации, блокируя действия ферментов — гираз и топоизомераз. Эти энзимы необходимы для «разворачивания» двойной спирали ДНК в клетке: для этого требуется сделать надрез, а потом зашить одну из цепей. Но антибиотики вроде хинолонов и фторхинолонов ингибируют сшивку, из-за чего в ДНК остается одноцепочечный разрез. Преимущество использования таких препаратов в том, что они фармацевтически воздействуют исключительно на бактериальный фермент топоизомеразу IV. Также они оказывают эффект на ДНК-гиразу или топоизомеразу II, которая присутствует в эукариотических клетках. Поэтому этот класс антибиотиков применяется в качестве цитостатических препаратов.
Существуют и интеркалирующие агенты — препараты, встраивающиеся между парами оснований в двойной спирали ДНК и препятствующие и репликации, и транскрипции, например, антрациклиновый класс. Но химически ДНК в прокариотических и эукариотических клетках одинакова, поэтому подобные антибиотики очень токсичны для организма-носителя. Они применяются лишь для лечения злокачественных опухолей.
Ещё один интересный тип антибиотиков — транспортный. Они интегрируются в плазматическую мембрану бактерии и, работая как ионные каналы, выводят ионы из ее клетки, вследствие чего она погибает.





























Фото: Анатолий Жданов / Коммерсантъ