Знакомьтесь — это FACT!
Наталия Малюченко, Мария Валиева, Михаил Кирпичников, Алексей Феофанов, Василий Студитский
«Природа» №11, 2017
Теперь известно даже старшеклассникам, что чрезвычайно длинные молекулы ДНК плотно упакованы в крошечном ядре. Над расшифровкой механизма, посредством которого это достигается, трудилось множество научных коллективов с 60-х годов прошлого столетия [1]. В группе Р. Корнберга (R. Kornberg) молекулы ДНК изучали с помощью электронной микроскопии и обнаружили, что хроматин (полимер, в котором ДНК связана с белками) похож на дисковидные бусины, нанизанные на нитку [2] (рис. 1). Впоследствии выяснилось, что эти «бусины», диаметром около 11 нм, представляют собой комплекс, состоящий из ДНК и гистонового октамера — набора из четырех пар гистоновых белков (Н2А, Н2В, Н3 и Н4). Этот октамер образует белковую сердцевину, на которую как на катушку намотана в 1,7 оборота нить двуспиральной ДНК (порядка 146 пар нуклеотидов). Потом тянется свободный от белков участок (его называют линкерной ДНК) — «нитка», длина которой равна примерно 30–50 парам нуклеотидов и зависит от вида организма. Затем — следующая «бусина» и т. д. Такая повторяющаяся упорядоченная структура, названная нуклеосомной, являет собой элементарную единицу хроматина.
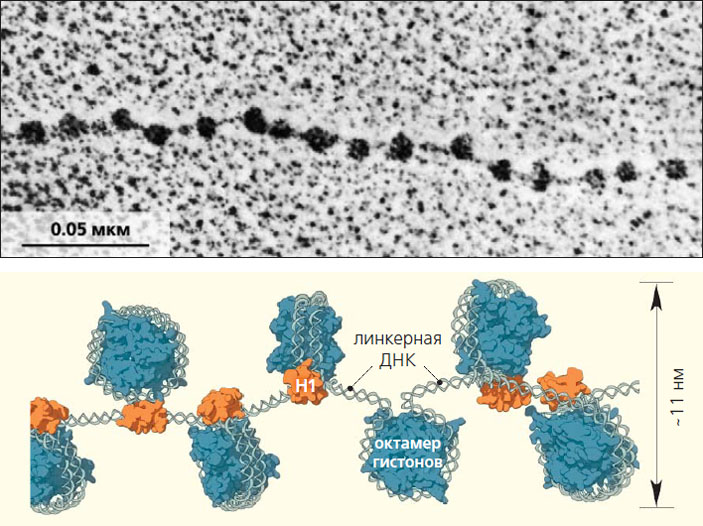
Нуклеосомная упаковка фактически не изменилась в ходе эволюции эукариот, что лишь подчеркивает значимость подобной пространственной организации ДНК [3]. (Заметим, в каждой нашей клетке находится более 20 млн нуклеосом, на которых размещено до 90% всей клеточной ДНК.) Совершенно очевидно, что и такого уплотнения ДНК (до 10-кратного) еще недостаточно — она остается слишком длинной для упаковки в ядро.
Следующий уровень организации ДНК был выявлен в структурных исследованиях хроматина, которые проводились в группе А. Клуга (А. Klug) в 1970-х годах. Выяснилось, что шесть нуклеосом укладываются в упорядоченные «стопки», которые перекручиваются одна вокруг другой. В результате образуется 30-нанометровая фибрилла ДНК [4] (рис. 2), а вся молекула дополнительно сжимается до 50 раз. Однако и такая упаковка еще не обеспечивает размещение нити ДНК почти двухметровой длины в ядре размером около 10 мкм. Позже стало ясно, что хроматиновые фибриллы множество раз сворачиваются в глобулы, причем так, чтобы ни одна петля не обвивалась вокруг другой (см. рис. 2). Это позволяет достичь минимального объема, и в итоге ДНК помещается в ядре клетки.
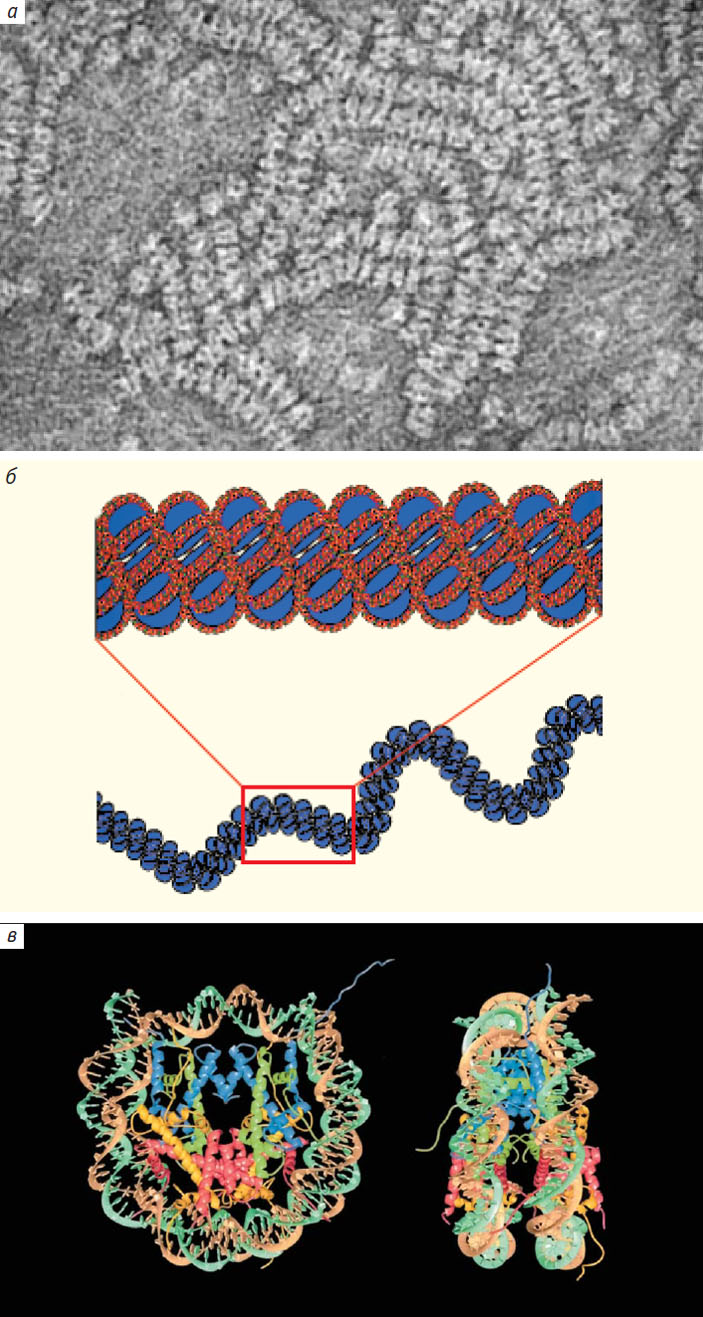
Рис. 2. Электронная микрофотография нуклеосом (а), уложенных в стопки [4], полученная нобелевским лауреатом А. Клугом, и хроматиновая фибрилла в виде соленоида (б). Структурная модель нуклеосомы (в) расшифрованная К. Люгер и Т. Ричмондом [7]. Четыре пары гистонов, из которых построена сердцевина нуклеосомы, показаны разным цветом: Н2А — желтым, Н2В — красным, Н3 — голубым, Н4 — зеленоватым
С той поры, как была расшифрована пространственная организация нуклеосомы [5, 6], началось создание различных моделей работы хроматин-связывающих белков, а также РНК- и ДНК-полимераз, топоизомераз, хеликаз и других факторов, необходимых для функционирования генов. Здесь мы лишь очень кратко остановимся на описании механизма транскрипции, которую осуществляют РНК-полимеразы (РНКП), т.е. на считывании информации с того или иного гена — синтезе РНК на матричной цепи ДНК. Ясно, что этому процессу компактная упаковка ДНК отнюдь не способствует. Как же столь массивный белковый комплекс как РНК-полимераза проникает в нуклеосомы (этот процесс называется инициацией, но мы коснемся — совсем кратко — только элонгации — удлинения цепочки РНК) и движется по очень компактно уложенной в них ДНК? Оказалось, перемещение фермента могут обеспечивать значительные конформационные изменения нуклеосом, причем лишь дестабилизирующие их, но не приводящие к полному нарушению нуклеосомной укладки.
В 2009 г. группа одного из авторов статьи (В. М. Студитского) расшифровала механизм транскрипции нуклеосомной ДНК РНК-полимеразой 2 (она снимает РНК-копии с большинства генов эукариот) [7]. Чтобы этого добиться, была создана «минимальная» экспериментальная модель — мононуклеосомные матрицы, собранные в пробирке из очищенных компонентов. Так удалось избежать многих сложностей и артефактов, возникающих при проведении исследований в многокомпонентных клеточных системах. Суть механизма заключается, в том, что РНКП2 движется по спирали вдоль нуклеосомных витков ДНК, расплетает ее часть, и та теряет связь с поверхностью октамера. Фермент прочитывает эту свободную от связей с белками часть цепи ДНК. РНК-полимераза движется дальше, продолжая наращивать цепь РНК, а ДНК позади РНКП2 закручивается обратно на нуклеосомную сердцевину (рис. 3).
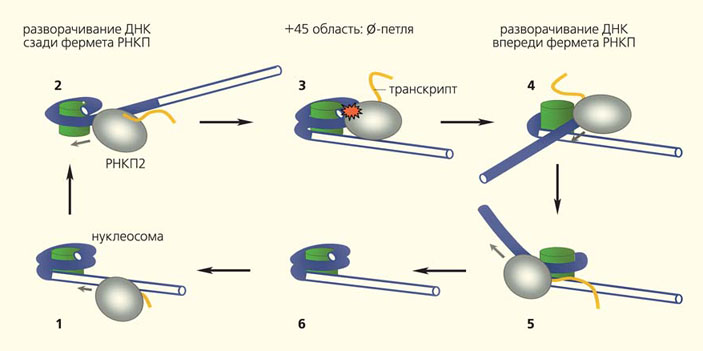
Рис. 3. Схема возможного механизма «выживания» нуклеосом при транскрипции РНК-полимеразой 2 (РНКП2), который обусловлен формированием очень малой внутринуклеосомной петли ДНК [8]. Начальная стадия — это инициация транскрипции (направление указано стрелками) с образованием комплекса 1. Затем РНКП2 приближается к нуклеосоме (комплекс 2), и ДНК (синий цвет), находящаяся за ферментом, частично разворачивается и отходит от октамера (зеленый цилиндр). Полимераза «прочитывает» эту часть ДНК (т.е. образуется РНК-копия участка — транскрипт, показанный желтым) и движется дальше (штриховые стрелки). «Прочитанная» ДНК восстанавливает связь с гистонами (комплекс 3), а РНКП2 оказывается в ∅-петле (так как ДНК связана с ними и перед, и за ферментом). ∅-петля способствует сохранению гистонов на матрице и разворачиванию ДНК, находящейся перед РНКП2 (комплекс 4). Транскрипция через нуклеосому завершается, после прохождения фермента восстанавливаются ДНК-гистоновые контакты (комплекс 5) и нуклеосома возвращается в первоначальную позицию на ДНК (комплекс 6)
Важно отметить, что при таком процессе нуклеосома сохраняется на своем месте: ДНК не теряет связи с гистонами Н3/Н4, а димеры гистонов Н2А и Н2В подвергаются временному удалению с последующим (после прохождения РНК-полимеразы) возвращением в состав нуклеосомы. Связанные с ДНК гистоны Н3/Н4 служат ориентиром для димеров Н2А и Н2В при восстановлении исходной нуклеосомной структуры. По сути, в ходе транскрипции происходит конформационное изменение нуклеосом, не простых катушек для упаковки ДНК, а механизмов, регулирующих доступ к генетической информации.
Факты о FACTе
Один из механизмов конформационных перестроек хроматина, связан с работой специальных белковых комплексов — ремоделеров. Известно уже, что ремоделеры могут передвигать нуклеосомы вдоль цепи ДНК и открывать ее участки для синтеза РНК-копии гена полимеразой. Этот процесс не протекает без энергетических затрат, и белки-ремоделеры пользуются той энергией, которая высвобождается при гидролизе АТФ.
Существует еще один механизм ремоделирования, причем энергии АТФ он не требует. Секрет этого связан с работой белка FACT* (англ. FAcilitates Chromatin Transcription — ‘облегчает транскрипцию хроматина’). Название он получил в лаборатории Д. Рейнберга (D. Reinberg), где и была открыта эта способность белкового помощника [9]. Годом раньше в лаборатории Т. Формозы (T. Formosa) в опытах с дрожжами обнаружили связь FACTа с удвоением генома перед делением клетки [10]. Сейчас известно множество процессов с участием ДНК, в которых задействован этот белковый комплекс. Он необходим для поддержания и изменения структуры хроматина, участвует в обмене гистонов, сборке нуклеосом, важен в клеточной дифференцировке, транскрипции, репликации, репарации ДНК, а также может быть вовлечен в развитие злокачественных новообразований [11]. Примечательно еще одно: FACT почти не изменился в ходе эволюции, что говорит о важности его функций.
FACT — это гетеродимерный белковый комплекс, шаперон гистонов с особыми свойствами. В нашей лаборатории для изучения действия FACTа, а также других белков, регулирующих процесс транскрипции, были созданы нуклеосомы, в которых на соседние витки ДНК добавлялись флуоресцентные метки [12] (рис. 4). Одна из них служила донором энергии, вторая — акцептором. Под действием лазерного излучения метка-донор либо становится зелено-желтой, либо передает энергию акцептору, который приобретает красный свет. Передача энергии с донора на акцептор происходит только в том случае, если метки расположены очень близко другу к другу (это Фёрстеровский резонансный перенос энергии — Förster Resonance Energy Transfer, FRET) [13]. Анализируя спектры флуоресценции, можно оценить относительные расстояния между витками нуклеосомной ДНК в области расположения меток. Более того, донор-акцепторную пару вводили в разные участки ДНК (ближе к месту входа РНКП в нуклесому, в ее середину и ближе к выходу РНКП из нуклеосомы), и таким образом можно было следить за структурными изменениями. Именно благодаря этому в опытах обнаружена способность дрожжевого FACTа обратимо разворачивать нуклеосому без использования энергии АТФ [12].

Рис. 4. Флуоресцентно меченные нуклеосомы в изучении действия дрожжевого FACTа (уFACTа). Флуородонор (зеленая звездочка) и флуороакцептор (красная звездочка), введенные в три положения ДНК на нуклеосоме (а), при взаимодействии с субъединицами уFACTа (Spt16/Pob3 и Nhp6) отдаляются друг от друга (б) и сигнал FRET (в) снижается, что свидетельствует о раскручивании нуклеосомы. Это хорошо видно на графике эффективности FRET (в), где красной кривой показан сигнал от нуклеосом, обработанных уFACTом, черной — от исходных, зеленым — от восстановленных нуклеосом после диссоциации комплекса нуклеосома-FACT [12]. N 35/112 — номера меченых нуклеотидов
Когда образуется комплекс FACT — нуклеосома, «нитка» с «катушки» разматывается практически полностью, но при этом ДНК и гистоны остаются связанными друг с другом. Если в опытах убирали FACT из комплекса, то нуклеосомная ДНК снова наматывалась на гистоновый октамер, и исходная структура нуклеосомы полностью восстанавливалась. Как именно выглядят нуклеосомы, раскрученные с помощью FACT, пока неизвестно — это предмет дальнейшего изучения. Возможно, такие процессы, протекающие в клеточном ядре без затрат дополнительной энергии, особенно важны, когда хроматин нужно быстро изменить — например, если требуется активировать какой-либо ген.
Как же работает FACT? До сих пор не существует однозначного понимания последовательности событий, посредством которых FACT реорганизует нуклеосому. Благодаря работам Т. Формозы и А. Ладурнера (A. Ladurner) появились ценные данные о структуре этого удивительного белкового комплекса. У животных и растений он представляет собой гетеродимер, состоящий из двух субъединиц — Spt16 и SSRP1 [14], у дрожжей аналогом SSRP1 служат две субъединицы — Pob3 и Nhp6 [15]. В исследованиях выяснилось, что с различными нуклеосомными участками могут взаимодействовать определенные домены FACTа [16]. В частности, концевая отрицательно заряженная область субъединицы Spt16 связывается электростатически с положительно заряженными хвостами гистона Н2В, которые находятся снаружи нуклеосомы. Дальнейшее продвижение FACTа в глубь глобулы, возможно, происходит за счет «нуклеосомного дыхания». Суть его заключается в том, что примерно 20 концевых пар нуклеотидов ДНК на нуклеосоме способны спонтанно распрямляться и накручиваться обратно [17]. При расплетании ДНК обнажаются ранее скрытые поверхности гистонов и становятся мишенью для связывания других участков Spt16. Такое взаимодействие приводит к дальнейшему вытеснению ДНК из комплекса ДНК — гистоны, а с ней уже может соединяться другая субъединица FACTа — SSRP1 [16, 18, 19].
Зачем изучать FACT?
Изучать функции белкового комплекса FACT важно не только для фундаментальной науки, но и для медицины, поскольку обнаружена его тесная взаимосвязь с процессом злокачественной трансформации клеток. FACT традиционно рассматривали как комплекс «домашнего хозяйства», представленный во всех клетках организма [20], и только сравнительно недавно обнаружили, что в нормальных тканях FACT синтезируется в основном в стволовых и недифференцированных клетках [21]. Высокий уровень комплекса FACT выявлен в некоторых клетках костного мозга, тимуса, лимфатических узлов (больше всего в зародышевых центрах лимфоидных фолликулов); в лимфоцитах слизистых оболочек [21]. В высоко дифференцированных клетках FACTа существенно меньше. В 2011 г. впервые обнаружили, что в ряде опухолевых клеток FACTа больше, чем в нормальных [22]. Через два года были опубликованы результаты определения уровня FACTа в 793 образцах различных опухолей [23] из банка тканей, находящегося в Институте рака Розуэлла Парка (Roswell Park Cancer Institute, США). Оказалось, содержание субъединиц FACTа в большинстве опухолей (правда, не во всех) повышено. Более того, высокий уровень SSRP1 соотносился с повышенным метастазированием злокачественных опухолей молочной железы, почек, легкого и предстательной железы.
Возникает вопрос о механизмах, посредством которых FACT может участвовать в канцерогенезе. Некоторые ученые полагают, что FACT регулирует экспрессию генов, ассоциированных с опухолью, взаимодействуя с факторами транскрипции [22]. С помощью методов биоинформатики обнаружено взаимодействие с FACTом различных регуляторных генов, важных для опухолевой трансформации [23]. В ряде исследований выяснилось, что в опухолевой клетке возникает порочный круг: FACT активирует транскрипцию онкогенов, а онкогены в свою очередь активируют транскрипцию генов субъединиц FACTа. Наиболее нагляден этот механизм на примере нейробластомы [24] (эта злокачественная опухоль нервной системы обнаруживается преимущественно у детей в возрасте 2–3 лет).
Несмотря на недостаточное понимание роли FACTa в метаболизме клетки, уже сейчас очевидно, что FACT сам способен воздействовать на регуляторы, управляющие судьбой клетки и запускающие или останавливающие различные программы ее развития. Активация этого фактора, возможно, стимулирует репрограммирование и дедифференцировку, в ходе чего клетка возвращается к своему стволовоподобному состоянию. Происходит неизбежное нарушение регуляции ее метаболизма и как печальный итог — злокачественное перерождение.
Но чрезмерная активация FACTа в опухолевой клетке может стать ее «ахиллесовой пятой». А. В. Гудков и К. В. Гурова (Онкологический институт имени Розвелла Парка в Баффало, США) создали соединения, способные инактивировать повышенную активность FACTа в опухолевых клетках. Такие вещества получили название кураксины (от английского cure — ‘излечивать’). Оказалось, что кураксины встраиваются в ДНК и способствуют необратимому связыванию FACTа с нуклеосомой (рис. 5). Это явление Гурова называет «c-trapping» (от англ. chromatin trapping — ‘хроматиновый капкан’ [25]). Фиксация FACTа приводит к тому, что белок уже не может свободно работать в хроматине и влиять на транскрипцию. Как следствие, изменяются три ключевых молекулярных каскада танскрипционных факторов (вовлеченных в развитие опухоли): p53, NF-kB и HSF1 [22]. Напомним, в норме белок p53 регулирует клеточный цикл, вызывает апоптоз и подавляет образование злокачественных опухолей, а в опухолевых клетках он инактивирован. Ядерный фактор NF-kB, наоборот, тормозит самоубийство клетки и способствует злокачественной трансформации. HSF1 — один из многих молекулярных шаперонов, принадлежащих классу белков теплового шока. В частности, HSF1 исправляет поврежденные белки в опухолевых клетках и тем способствует их выживанию.

Рис. 5. Модель улавливания FACTа в хроматине (chromatin trapping, c-trapping) с помощью кураксинов [24]. Когда одна молекула кураксина CBL0137 связывает 10–100 пар оснований ДНК, FACT улавливается нуклеосомой (n-trapping) через субъединицу Spt16 (фиолетовые домены). На этой фазе процесса из октамера уходят гистоны H2A (желтый цвет) и H2B (красный), но пары H3 (синий цвет) и H4 (зеленый) остаются. Если же плотность кураксина высока — одна или несколько молекул на каждые 10 пар оснований, в конце фазы нуклеосома разбирается полностью, а FACT через свою субъединицу SSPR1 (голубые домены) улавливается z-формой ДНК (z-trapping)
Кроме упомянутых изменений каскадов, вызываемых кураксинами, некоторые из них могут ингибировать:
- индукцию транскрипции генов, кодирующих матриксные металлопротеиназы ММР1 и MMP8 (эти ферменты играют важную роль не только во многих нормальных физиологических процессах, но и в патологических, в частности, в злокачественном росте, способствуя инвазии опухоли и метастазированию);
- сигнальные каскады PI3K/AKT/mTOR (каскад отвечает за уход от апоптоза, пролиферацию клеток, метаболизм и вовлечен, например, в патогенез меланомы);
- активность ингибитора cIAP-1;
- ДНК-топоизомеразу II;
- ряд онкогенов, например, c-MYC и др.
Использование кураксинов в терапии опухолей, возможно, позволит преодолеть одну из самых основных проблем в химиотерапии, связанную с развитием устойчивости злокачественных клеток к лекарственному средству. Известно, что при монотерапии (лечения, направленного против единственного внутриклеточного молекулярного пути) резистентность развивается достаточно часто. Преодолеть подобные сложности можно с помощью комбинации препаратов, нацеленных на различные внутриклеточные мишени [26]. Как уже сказано, кураксины запускают веерный каскад противоопухолевых реакций, отличный от стимулируемых многими существующими препаратами. Поэтому такие вещества могут оказаться перспективными реагентами для создания комбинированной схемы терапии с целью преодоления лекарственной устойчивости [27].
Мы завершаем короткое знакомство с FACTом, этим необычным представителем регуляторных белков. Но исследования FACTа далеки от завершения. Самая главная загадка, которую предстоит отгадать — детальный механизм изменения структуры хроматина под действием FACTа без затрат энергии. Возможно, благодаря этому шаперону гистонов ученые откроют совершенно новые молекулярные процессы в ядре клетки.
Работа выполнена при финансовой поддержке Российского научного фонда (проект 14-24-00031).
Литература
1. Alberts B., Johnson A., Lewis J. et al. Molecular Biology of the Cell. N.Y., 2015.
2. Kornberg R. D., Thomas J. O. Chromatin structure; oligomers of the histones // Science. 1974; 184(4139): 865–868. DOI: 10.1126/science.184.4139.865.
3. White C. L., Suto R. K., Luger K. Structure of the yeast nucleosome core particle reveals fundamental changes in internucleosome interactions // EMBO J. 2001; 20(18): 5207–5218. DOI: 10.1093/emboj/20.18.5207.
4. Finch J. T., Lutter L. C., Rhodes D. et al. Structure of nucleosome core particles of chromatin // Nature 1977; 269: 29–36. DOI: 10.1038/269029a0.
5. Richmond T. J., Finch J. T., Rushton B. et al. Structure of the nucleosome core particle at 7 Å resolution // Nature. 1984; 311: 532–537. DOI: 10.1038/311532a0.
6. Luger K., Mader A. W., Richmond R. K. et al. Crystal structure of the nucleosome core particle at 2.8 Å resolution // Nature. 1997; 389: 251–260. DOI: 10.1038/38444.
7. Kulaeva O. I., Gaykalova D. A., Pestov N. A. et al. Mechanism of chromatin remodeling and recovery during passage of RNA polymerase II // Nat. Struct. Mol. Biol. 2009; 16(12): 1272–1278. DOI: 10.1038/nsmb.1689.
8. Кулаева О. И., Малюченко Н. В., Никитин Д. В. и др. Молекулярные механизмы транскрипции хроматина РНК-полимеразой 2 // Мол. биол. 2013; 47(5): 754–766.
9. Orphanides G., LeRoy G., Chang Ch. H. et al. FACT, a factor that facilitates transcript elongation through nucleosomes // Cell. 1998; 92: 105–116. DOI: 10.1016/S0092-8674(00)80903-4.
10. Wittmeyer J., Formosa T. The Saccharomyces cerevisiae DNA polymerase alpha catalytic subunit interacts with Cdc68/Spt16 and with Pob3, a protein similar to an HMG1-like protein // Mol. Cell. Biol. 1997; 17(7): 4178–4190. DOI: 10.1128/MCB.17.7.4178.
11. Safina A., Garcia H., Commane M. et al. Complex mutual regulation of FACT subunits on mRNA and protein levels in human cells // J. Biol. Chem. 2013; 12(15): 2423–2434. DOI: 10.4161/cc.25452.
12. Valieva M., Armeev G. A., Kudryashova K. S. et al. Large-scale ATP-independent nucleosome unfolding by a histone chaperone // Nat. Struct. Mol. Biol. 2016; 23(12): 1111–1116. DOI: 10.1038/nsmb.3321.
13. Hillisch A., Lorenz M., Diekmann S. Recent advances in FRET: distance determination in protein-DNA complexes // Curr. Opin. Struct. Biol. 2001; 11(2): 201–207. DOI: 10.1016/S0959-440X(00)00190-1.
14. Orphanides G., Wu W.-H., Lane W. S. et al. The chromatin-specific transcription elongation factor FACT comprises human SPT16 and SSRP1 proteins // Nature. 1999; 400: 284–288. DOI: 10.1038/22350.
15. Formosa T. The role of FACT in making and breaking nucleosomes // Biochim. Biophys. Acta. 2012; 1819(3–4): 247–255. DOI: 10.1016/j.bbagrm.2011.07.009.
16. Hondele M., Stuwe T., Hassler M. et al. Structural basis of histone H2A-H2B recognition by the essential chaperone FACT // Nature. 2013; 499: 111–114. DOI: 10.1038/nature12242.
17. Koopmans W. J., Buning R., Schmidt T. et al. spFRET using alternating excitation and FCS reveals progressive DNA unwrapping in nucleosomes // Biophys. J. 2009; 97(1): 195–204. DOI: 10.1016/j.bpj.2009.04.030.
18. Hondele M., Ladurner A. G. Catch me if you can: how the histone chaperone FACT capitalizes on nucleosome breathing // Nucleus. 2013; 4(6): 443–449. DOI: 10.4161/nucl.27235.
19. Winkler D. D., Muthurajan U. M., Hieb A. R. et al. Histone chaperone FACT coordinates nucleosome interaction through multiple synergistic binding events // J. Biol. Chem. 2011; 286(48): 41883–41892. DOI: 10.1074/jbc.M111.301465.
20. Singer R. A., Johnston G. C. The FACT chromatin modulator: genetic and structure / function relationships // Biochem. Cell. Biol. 2004; 82(4): 419–427. DOI: 10.1139/o04-050.
21. Garcia H., Fleyshman D., Kolesnikova K. et al. Expression of FACT in mammalian tissues suggests its role in maintaining of undifferentiated state of cells // Oncotarget. 2011; 2(10): 783–796. DOI: 10.18632/oncotarget.340.
22. Gasparian A. V., Burkhart C. A., Purmal A. A. et al. Curaxins: anticancer compounds that simultaneously suppress NF-кB and activate p53 by targeting FACT // Sci. Transl. Med. 2011; 3(95): ra74. DOI: 10.1126/scitranslmed.3002530.
23. Garcia H., Miecznikowski J. C., Safina A. et al. Facilitates chromatin transcription complex is an «accelerator» of tumor transformation and potential marker and target of aggressive cancers // Cell Rep. 2013; 4(1): 159–173. DOI: 10.1016/j.celrep.2013.06.013.
24. Carter D. R., Murray J., Cheung B. B. et al. Therapeutic targeting of the MYC signal by inhibition of histone chaperone FACT in neuroblastoma // Sci. Transl. Med. 2015; 7(312): ra176. DOI: 10.1126/scitranslmed.aab1803.
25. Safina A., Cheney P., Pal M. et al. FACT is a sensor of DNA torsional stress in eukaryotic cells // Nucleic. Acids Res. 2017; 45(4): 1925–1945. DOI: 10.1093/nar/gkw1366.
26. Di Bussolo V., Minutolo F. Curaxins: a new family of non-genotoxic multitargeted anticancer agents // ChemMedChem. 2011; 6(12): 2133–2136. DOI: 10.1002/cmdc.201100476.
27. Burkhart C., Fleyshman D., Kohrn R. et al. Curaxin CBL0137 eradicates drug resistant cancer stem cells and potentiates efficacy of gemcitabine in preclinical models of pancreatic cancer // Oncotarget. 2014; 5(22): 11038–11053. DOI: 10.18632/oncotarget.2701.
* Эта английская аббревиатура воспринимается как слово мужского рода, поэтому мы позволили себе склонять ее, но писать без апострофа. — Примеч. ред.
-
За последние 2 года оказалось, что 11нм бусины на нити ДНК -- артефакт методики микроскопирования. А соленоидной модели сворачивания предпочитают зигзаг- модель укладки.
И в целом спутанность ДНК на хромосоме -- как клубок нитей распущенного свитера -- только "издалека". Что подтверждает loop- extrusion -- координация хроматина при транскрипции.



















Рис. 1. Нуклеосомы: электронная микрофотография, полученная лауреатом Нобелевской премии по химии Р. Корнбергом и построенная им модель «бусины на нитке» [2]