Поверхность молекулы — источник биологической информации
Антон Чугунов, Роман Ефремов
«Природа» №10, 2014
Многочисленные процессы, происходящие в каждой отдельно взятой клетке живого организма, основаны на избирательном контакте одних молекул с другими: ферментам удается найти нужные субстраты, лиганды «узнают» свои мишени. На этой поразительно четкой системе зиждется вся молекулярная биология, а значит, и жизнь вообще. Генетическая программа реализуется в форме замысловатых многоклеточных организмов за счет распознавания биомолекулами друг друга, к тому же оно определяет саму возможность существования такой программы. Удивительная сложность живых организмов не «записана» в ДНК буквально (ведь там не заданы, например, координаты всех атомов тела), а получается как бы сама собой, благодаря самоорганизации и «сознательному выбору» одними молекулами других.
Так, ДНК- и РНК-полимеразы с очень высокой точностью распознают матрицу — молекулу нуклеиновой кислоты, которая на первый взгляд одинакова во всех местах и похожа на моток однородной проволоки, однако отличается последовательностью нуклеотидов. Матричная РНК, посредством которой закодированная в ДНК информация превращается, допустим, в белок-рецептор, безошибочно узнается рибосомой и многочисленными факторами инициации, элонгации и терминации трансляции. Удлинение синтезируемой полипептидной цепочки на каждый новый аминокислотный остаток происходит вследствие распознавания триплета молекулой транспортной РНК. Если белку суждено стать секретируемым или мембранным (т. е. ему нужно попасть из цитоплазмы, где работает синтезирующая его рибосома, в другое место), он содержит специальную сигнальную последовательность, благодаря которой его направляют по нужному «адресу». Подобных взаимодействий в каждой клетке бесчисленное множество.
Процесс распознавания неотделим от понятия молекулярной поверхности. Именно она, представляя собой своеобразную зону коммуникации, определяет, «подойдут» ли участники контакта друг другу. Мерой такого распознавания служит свободная энергия взаимодействия, а вызываемая им передача сигнала происходит из-за электронно-конформационных переходов, приводящих после образования комплекса к изменению пространственного расположения атомов и/или свойств молекул. Очевидно, что их поверхность — абстракция, так как обычные физические поверхности (например, воды или металла) перестают существовать при переходе к атомарному масштабу. Однако молекулярная поверхность, представленная в виде совокупности сфер, изображающих отдельные атомы, или каким-то схожим образом, — очень удобный инструмент для описания соответствующих взаимодействий. Компьютерное моделирование биологических молекул часто основано не на квантовой механике, описывающей строение вещества максимально корректно, а на наборе приближений, уводящих от физических «истоков», но позволяющих с помощью ЭВМ решать важные практические задачи: искать новые лекарства или изучать механизмы развития заболеваний. Одно из таких упрощений — концепция молекулярных поверхностей, представляющая молекулу в виде твердого тела с распределенными на нем физико-химическими свойствами.
Типы и применение молекулярной поверхности

Рис. 2. Поверхность Ван-дер-Ваальса знакома нам по масштабным макетам молекул в виде разноцветных сфер. На фотографии прославленный молекулярный биолог Джеймс Уотсон с моделями двойной спирали ДНК [1]
Образующие молекулу атомы, строго говоря, нельзя представлять в виде шариков — они не имеют отчетливо выраженной внешней границы и более чем на 99% состоят из «пустоты» (вспомним характерные размеры протона, нейтрона и электрона и сравним с размерами образованных ими структур). Впрочем, в практических целях считать атомы твердыми сферами оказалось удобно. Впервые это сделал голландский ученый Ян Дидерик Ван-дер-Ваальс, и с тех пор именно его имя носит средний эффективный радиус атома, изменяющийся в пределах 1–2 Å для разных химических элементов. По сути, это половина минимального расстояния, на которое можно сблизить (без образования химической связи) два одинаковых атома, принадлежащих разным молекулам. Вандерваальсова поверхность состоит из точек, которые лежат на воображаемых сферах (атомах), не попадая внутрь соседних (рис. 1). Она составляет основу распространенного «молекулярного конструктора» Кори — Полинга — Колтуна, использующего известное всем со школы цветовое обозначение атомов различных химических элементов (рис. 2). Вандерваальсова модель молекулы внутри изобилует пустотами и может содержать сквозные просветы. В ней много свободного места, как в мешке с елочными шарами, в который, однако, еще один уже не добавишь. Молекулы растворителя (чаще всего воды) не могут проникнуть в эти небольшие полости. Это привело ученых к концепции поверхности, доступной растворителю. Предложенная в 1971 г. Б. Ли и Ф. М. Ричардсом, она рассчитывается математически как множество точек, равноудаленных от вандерваальсовой поверхности молекулы. Доступная растворителю поверхность описана центром сферической молекулы воды (эффективный радиус 1,4 Å), «прокатанной» вокруг атомов (см. рис. 1). А вот нижние границы шариков воды, находящихся в контакте с целевой молекулой, составляют поверхность Коннолли (см. рис. 1). Она получается исключением из объема точек, в которые может попасть растворитель. Именно этот тип поверхности преимущественно используется для визуализации молекул и для расчета их физико-химических свойств (рис. 3, 4).
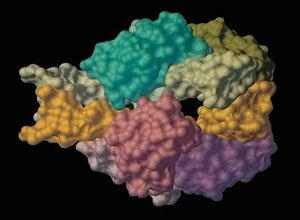
Рис. 3. Фермент аспартаткарбамоилтрансфераза из оригинальной статьи М. Коннолли [2]
Чаще всего к молекулярной поверхности прибегают, чтобы вычислить полярную и неполярную составляющие ее площади. Их соотношение определяет свободную энергию переноса из одной фазы (например, неполярной) в другую (полярную) данной молекулы и, соответственно, степень ее гидрофобности или гидрофильности. Так называемый гидрофобный эффект участвует в сворачивании биополимеров, стремящихся экранировать свои «водобоязненные» фрагменты от полярного растворителя (или наоборот, если речь идет о мембранных белках), так как контакт воды с неполярными веществами термодинамически невыгоден*.
Процесс формирования пространственной структуры (фолдинг) напрямую связан с поверхностными явлениями и минимизацией площади контакта некоторых фрагментов гибкой белковой цепочки с окружающей средой. Как и географическую карту, двумерное изображение поверхности молекулы можно сделать информативным, нанеся на него различные физико-химические характеристики и/или особенности структуры. Например, часто проводят расчет и цветовую визуализацию электростатического потенциала, определяющего зарядовые взаимодействия. Или картируют молекулярный «рельеф» поверхности — расположение «ущелий», «холмов» и «равнин», наглядно показывающих гладкость или шероховатость на том или ином участке. Вместе с локализацией на «карте» позиций доноров и акцепторов водородной связи это определяет нахождение сайтов связанной воды — мест, где растворитель задерживается особенно долго. Безусловно, форма поверхности и ее свойства меняются вместе с конформацией молекулы (из-за тепловых колебаний атомов или межмолекулярных взаимодействий). Поэтому поверхность молекулы — ее своеобразный динамический «портрет», к которому можно добавить еще и временную компоненту. Собрав большую коллекцию таких «портретов» (например, в результате расчета молекулярной динамики), можно создать усредненную карту поверхности, а также выявить на ней наиболее статичные и подвижные области. Так можно наглядно изобразить, насколько гибкими или жесткими могут быть в данных условиях отдельные участки молекулы. Одно из самых актуальных применений концепции молекулярных поверхностей в современной компьютерной биологии — докинг (стыковка), метод, предсказывающий наиболее выгодную для образования устойчивого комплекса ориентацию и положение одной молекулы по отношению к другой. С позиций молекулярной биологии это позволяет реконструировать часть эстафеты распознавания и передачи сигналов. Для практики же наибольшее значение имеет область рационального дизайна лекарственных средств и биологически активных веществ, специфически взаимодействующих с выбранными мишенями и корректирующих работу того или иного молекулярного пути.

Рис. 4. Трехмерная модель капсида сателлита вируса табачной мозаики (STMV). Поверхность вируса раскрашена в зависимости от значения электростатического потенциала. Фото: ks.uiuc.edu
Молекула — квантово-механический объект. Поэтому редукция ее описания от многоэтажных гамильтонианов до простой геометрии (что происходит при использовании понятия поверхности) — несомненное и намеренное упрощение. На аналогичных допущениях, кстати, строится все молекулярное моделирование, базирующееся на концепции эмпирических силовых полей**.
Из практических соображений корректная и неподъемная квантовая механика заменяется на ньютоновскую физику, простую, но тем не менее способную достаточно адекватно описать динамические свойства биополимеров (хотя и оставляя «за бортом» химические превращения или спектроскопические эффекты). Однако молекулярная поверхность и сама по себе — сложный объект как чисто геометрически, так и с позиций вычислительных алгоритмов: компьютерные файлы с рассчитанными поверхностями и значениями различных физико-химических параметров очень громоздки (особенно в случае больших биополимеров и при выборе высокой плотности точек на поверхности). Иногда можно пойти в упрощениях еще дальше. Если поверхность молекулы или ее часть без существенных потерь можно представить в виде какой-либо простой геометрической формы — плоскости, цилиндра или сферы, анализ сложного трехмерного объекта сведется к (квази)двумерному случаю. Рассмотрим три наглядных примера того, как расчеты с молекулярными поверхностями позволяют извлечь из компьютерного моделирования осмысленную биологическую информацию.
Плоскость и уязвимость бактериальной мембраны
Мембрана — принципиально важный клеточный компонент, ее строение весьма консервативно и имеет свои отличительные черты для каждого из трех доменов живых организмов. Так, бактериальная мембрана отличается от эукариотической, в целом электронейтральной, отрицательным зарядом, а также наличием особой молекулы с длинным гидрофобным изопреноидным «хвостом» и гидрофильной «головкой» пептидогликановой природы — липида-II (рис. 5) [3]. Он служит челночным переносчиком этого муреинового фрагмента — жизненно необходимого «строительного блока» бактериальной стенки. Эта уникальная молекула встречается только в бактериальной мембране и, не будучи биополимером, последовательность которого легко мутирует с участием генетических механизмов, обладает консервативной химической структурой. Именно поэтому на липид-II направлены атаки множества природных антибиотиков, специфически его распознающих и имеющих бактериостатическое или бактерицидное действие.
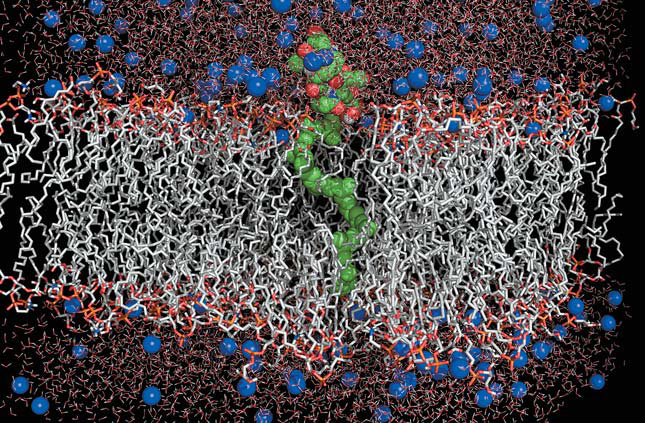
Рис. 5. Компьютерная модель «ахиллесовой пяты» бактериальной мембраны — липида-II. Серым показаны «хвосты» липидов мембраны, красно-оранжевым — их «головки», зеленым — липид-II, синим — ионы натрия в растворителе (воде)
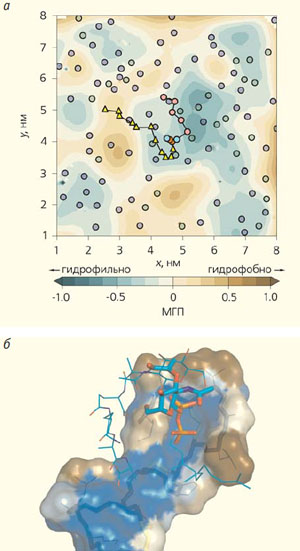
Рис. 6. Липид-II на карте молекулярного гидрофобного потенциала (МГП) участка бактериальной мембраны (а) и в комплексе с низином (б). На карте МГП кружками изображены молекулы фосфолипидов, ломаной линией, соединяющей цветные геометрические фигуры, — липид-II. В присутствии его гибкой молекулы возникает долгоживущий амфифильный участок, напоминающий океанский атолл: подковообразная гидрофобная область и гидрофильная «лагуна» в центре. В комплексе липида-II и низина гидрофобная поверхность молекулы антибиотика показана коричневым, гидрофильная — голубым, а «скелет» — палочками внутри поверхности; фрагмент молекулы липида-II изображен снаружи. Толстые палочки обозначают те области, которые, по-видимому, играют решающую роль во взаимном распознавании этих молекул. Структура, возникающая, когда низин «вцепляется» в липид-II, — «пирофосфатная клетка». Видно, что пространственные гидрофобные свойства антибиотика повторяют таковые для «атолла», образующегося на бактериальной мембране вокруг молекулы липида-II: в середине гидрофильная область, а по краям — гидрофобная. Такое соответствие объясняет, как низину удается обнаружить столь редкую молекулу липида-II на мембране
Когда установили пространственную структуру комплекса липида-II с одним из узнающих его антибиотиков — низином [4], оказалось, что главный структурный фрагмент, «выдающий» липид-II и делающий его «ахиллесовой пятой» бактериальной мембраны, — пирофосфат, химическая группировка, которая не встречается в окружающих липидах. Однако объяснить четкое распознавание этим антибиотиком липида-II очень непросто: на достаточно большой (по сравнению с размером липида) поверхности бактериальной мембраны расположено очень мало (около 2000) молекул липида-II, а действующие концентрации низина крайне низки. Каким образом в этих условиях происходит первичная встреча антибиотика и его «жертвы»?
В результате компьютерного анализа поверхности бактериальной мембраны в окрестностях липида-II мы выяснили, что последний, в силу гибкости своего длинного «хвоста», вносит существенные изменения в структуру окружающих его фосфолипидов и в распределение гидрофобных свойств на мембране [5]. Для ее фрагмента мы провели расчет методом молекулярной динамики, а в качестве контроля приняли равный по размеру фрагмент мембраны эукариот. На проекционных «картах», изображающих динамическое распределение гидрофобности, липид-II оказался в центре гидрофобного «атолла» достаточно большого размера и характерного времени жизни (рис. 6). Видимо, существование этого амфифильного участка, отсутствующего в мембране эукариот даже при расчете с липидом-II, — уникальная особенность, привносимая на поверхность мембраны бактерий длинной и гибкой молекулой липида-II. Сделанные расчеты позволяют предположить, что распознавание антибиотиком своей мишени происходит в два этапа. Второй, более специфичный, — захват пирофосфатной группы липида-II в «клетку» водородных связей, образуемых макроциклами в структуре низина (см. рис. 6, б). В нахождении им амфифильной области, «выдающей» липид-II, скрывающийся в мембране, возможно, заключается первая стадия. Учет этого гипотетического механизма поможет создать новое поколение мембранных антибиотиков, безопасных для человека и свободных от бремени резистентности, нависшего над большинством классических аналогов.
Цилиндр и димеризация трансмембранных доменов
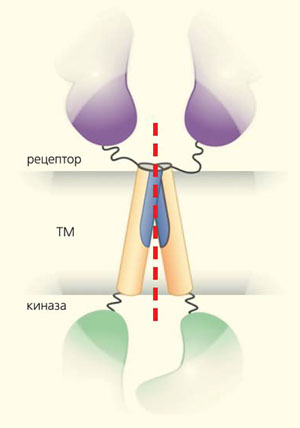
Рис. 7. Схема строения и димеризации рецепторных тирозинкиназ (рисунок А. А. Полянского). Рецепторный, трансмембранный (ТМ) и киназный домены показаны фиолетовым, бежевым и зеленым цветами, соответственно; пунктирная красная линия разделяет мономеры; синим изображена область димеризации
Рецепторные тирозинкиназы (РТК) — важные молекулы, участвующие в регуляции клеточного цикла и деления. Они воспринимают многочисленные факторы роста, цитокины и гормоны (в том числе инсулин и гормон роста). В геноме человека закодировано 58 таких рецепторов, подразделяемых на 20 семейств. Нарушение работы многих из этих белков приводит к развитию онкологических заболеваний, поэтому ее изучение — не только фундаментальная, но и медицинская задача. Эти рецепторы состоят из трех доменов. Два из них большие — внеклеточный, распознающий лиганды, и внутриклеточный, в котором осуществляется фосфорилирование и который передает сигнал на различные биохимические каскады. Соединяющий их трансмембранный домен, пронизывающий мембрану клетки, состоит из единственной α-спирали. Механизм активации рецепторных тирозинкиназ при связывании лиганда (например, фактора роста фибробластов) заключается в димеризации двух молекул рецептора именно в этом домене (рис. 7).
В последние годы в экспериментальном определении пространственной структуры таких димеров был достигнут значительный прогресс [6]. Однако методы компьютерного моделирования также играют существенную роль в решении этой биологической задачи. В ряде случаев они позволяют решить проблему предсказания структуры димера с меньшими затратами, а главное, предложить сразу несколько вероятных вариантов упаковки (т. е. создать ансамбль возможных конформаций), каждый из которых может реализоваться при определенных условиях. В нашей лаборатории подошли к решению этой задачи не «в лоб» (поместив два трансмембранных фрагмента рецептора в мембрану и запустив длительный расчет методом молекулярной динамики), а приняв во внимание во многом геометрическую суть задачи — установить возможный мотив скрещивания двух примерно цилиндрических тел. При этом помимо пространственной комплементарности трансмембранных спиралей учитывалось и соответствие их физико-химических свойств (гидрофобности). Все вычисления производили на уровне цилиндрических карт-разверток, сравнивать которые намного проще, нежели трехмерные тела сложной формы (рис. 8) [7]. Соответствующий алгоритм был реализован на веб-сервере PREDDIMER [8], который позволяет реконструировать набор димерных структур для заданных трансмембранных последовательностей, а также визуализировать полученные конформации в виде 3D-моделей и 2D-карт поверхностной гидрофобности α-спиралей с отмеченной областью димеризации. Тестирование сервера на 11 трансмембранных последовательностях, для которых ранее методом ЯМР-спектроскопии были получены 3D-конформации, показало, что алгоритм делает предсказания с довольно высокой точностью. Понимание механизма димеризации рецепторных тирозинкиназ позволит с помощью компьютерного дизайна создать вещества, корректирующие ее нарушение и исправляющие повышенную активность этих рецепторов, которая часто приводит к раковому перерождению клеток.

Рис. 8. Предсказание механизма димеризации трансмембранных доменов рецепторных тирозинкиназ (рисунок А. А. Полянского). Схема работы алгоритма PREDDIMER на примере сегмента эфринового рецептора (EphA), который участвует в эмбриогенезе. Сначала конструируется идеальная α-спираль на основе аминокислотной последовательности трансмембранного домена (а). Затем производится расчет гидрофобных / гидрофильных свойств на молекулярной поверхности (МГП — молекулярный гидрофобный потенциал), которые изображены коричневым и синим (б). Далее строятся двумерные цилиндрические карты-развертки (z — координата вдоль оси цилиндра) поверхности, показывающие одновременно гидрофобность и «рельеф» (в). Наконец, ищется оптимальное совмещение двух карт с наилучшим соответствием поверхностей (г) и реконструируется структура спирального димера (д)
Сфера и яд скорпионов
В природных ядах часто содержатся нейротоксины, мишень которых — ионные каналы и рецепторы в мембранах клеток нервной системы или мышц. Изучение этих молекул помогает понять работу нейрорецепторов и научиться ее регулировать, что важно как для фундаментальных задач, так и для медицинских приложений, заключающихся в коррекции нарушений работы нервной системы. Например, в яде скорпионов обнаружены так называемые α-нейротоксины, специфически воздействующие на ионные каналы насекомых или млекопитающих: первые можно назвать инсекто-, а вторые — млекотоксинами. В чем причина их специфического действия? Детально изучив атомное строение и свойства молекул двух групп α-токсинов, мы должны были найти значимые структурные отличия, определяющие селективность этих веществ. Сравнив структуры инсекто- и млекотоксинов, мы действительно выявили заметные различия между ними. Для этого был создан алгоритм «белковой топографии» [9], название которого отражает его отчетливое сходство с картированием земной поверхности, так как форма нейропептидов была практически идеально приближена к сфере (рис. 9, а). Используя метод молекулярной динамики, расчет поверхности с распределением на ней гидрофобных свойств и построение сферических проекций, мы искали на двумерных картах токсинов общие закономерности и специфические участки, а затем сопоставляли эти данные с известными активностью и избирательностью действия таких белков. Мы выявили в исследованных молекулах функциональные «модули», которые отличаются по своим свойствам и, предположительно, отвечают за специфическое действие инсекто- и млекотоксинов (рис. 9, б). Чтобы проверить эту гипотезу, мы синтезировали токсин с заранее неизвестной специфичностью, на основании наших расчетов предсказали его избирательность (насекомые или млекопитающие) и затем экспериментально измерили его биологическую активность. Результат полностью подтвердил сделанное предсказание [10]. Алгоритм белковой топографии, основанный на работе с молекулярными поверхностями и расчетах молекулярной динамики, поможет в поиске структурно-функциональных зависимостей в биоактивных пептидах и небольших белках. Биоинженерный подход, требующий знания этих зависимостей, можно применять к созданию специфических аналогов природных нейропептидов и нейромодуляторов. А это откроет новые перспективы для медицины и сельского хозяйства.

Рис. 9. Структурные отличия млеко- и инсектотоксинов, определяющие специфичность их действия. Карта-развертка, полученная методом белковой топографии, который основан на картировании свойств, распределенных на поверхности сферы (а). В результате на карте можно «разглядеть» молекулу целиком со всех сторон. Карты гидрофобных / гидрофильных свойств (МГП — молекулярный гидрофобный потенциал) для млеко- и инсектотоксинов (б). Наибольшее различие двух карт наблюдается в районе модуля специфичности, очерченного красным контуром. Синие точки соответствуют проекциям аминокислотных остатков, среди последних зеленым выделены те, которые характеризуются повышенной эволюционной вариабельностью
Итак, сравнительно несложные манипуляции с молекулярными поверхностями позволяют извлекать из компьютерных расчетов биополимеров по-настоящему уникальную информацию. Помимо наглядного представления это дает возможность напрямую сравнивать физико-химические характеристики поверхностей разных молекул, количественно оценивать изменения их свойств, происходящие в результате связывания или конформационных переходов, и т. д. Применяя вычислительные технологии для расчета свойств молекулярных поверхностей, можно выявить детали, недоступные традиционным структурным методам. Это открывает новые пути в таких практически важных областях, как создание новых антибиотиков, лечение раковых и неврологических заболеваний, разработка безопасных для человека инсектицидов. «Механистический» подход к квантовым объектам (молекулам), безусловно, не претендует на абсолютную физическую корректность, поскольку не моделирует статистические ансамбли и не рассчитывает термодинамические константы. Зато он позволяет по-новому взглянуть на хорошо зарекомендовавшую себя концепцию молекулярных поверхностей и раскрыть их смысл для биологии.
Работа выполнена при поддержке Российского научного фонда (проект 14-24-00118).
Литература
1. Wagstaff A. Jim Watson: DNA revealed the causes, it may never reveal a cure // Cancer World. 2013. V. 56. P. 4–11.
2. Connolly M. L. Solvent-accessible surfaces of proteins and nucleic acids // Science. 1983. V. 221. P. 709–713.
3. Breukink E., Kruijff B. de. Lipid II as a target for antibiotics // Nat. Rev. Drug Discov. 2006. V. 5. P. 321–332.
4. Hsu S. T., Breukink E., Tischenko E. et al. The nisin-lipid II complex reveals a pyrophosphate cage that provides a blueprint for novel antibiotics // Nat. Struct. Mol. Biol. 2004. V. 11. P. 963–967.
5. Chugunov A. O., Pyrkova D. V., Nolde D. E. et al. Lipid-II forms potential «landing terrain» for antibiotics in simulated bacterial membrane // Sci. Rep. 2013. V. 3. P. 1678.
6. Bocharov E. V., Volynsky P. E., Pavlov K. V. et al. Structure elucidation of dimeric transmembrane domains of bitopic proteins // Cell Adh. Migr. 2010. V. 4. P. 284–298.
7. Polyansky A. A., Volynsky P. E., Efremov R. G. Multistate organization of transmembrane helical protein dimers governed by the host membrane // J. Am. Chem. Soc. 2012. V. 134. P. 14390–14400.
8. Polyansky A. A., Chugunov A. O., Volynsky P. E. et al. PREDDIMER: a web server for prediction of transmembrane helical dimers // Bioinformatics. 2014. V. 30. P. 889–890.
9. Koromyslova A. D., Chugunov A. O., Efremov R. G. Deciphering fine molecular details of proteins’ structure and function with a Protein Surface Topography (PST) method // J. Chem. Inf. Model. 2014. V. 54. P. 1189–1199.
10. Chugunov A. O., Koromyslova A. D., Berkut A. A. et al. Modular organization of α-toxins from scorpion venom mirrors domain structure of their targets — sodium channels // J. Biol. Chem. 2013. V. 288. P. 19014–19027.
* Подробнее см.: Чугунов А. О., Полянский А. А., Ефремов Р. Г. Физическая водобоязнь // Природа. 2013. № 1. С. 24–34 (PDF, 4 Мб).
** Подробнее см.: Чугунов А. О., Ефремов Р. Г. Компьютерные игры в молекулярную биофизику // Природа. 2010. № 12. С. 36–43 (PDF, 7 Мб).

















Рис. 1. Схематическое изображение трех типов молекулярной поверхности — вандерваальсовой (проходящей по «контуру» атомов), доступной растворителю и Коннолли (которые получаются с помощью алгоритма «катящейся сферы» радиусом r)