Наномеханика: адресная доставка лекарств
Мария Ефремова, Александр Мажуга, Юрий Головин, Наталья Клячко
«Природа» №7, 2016
Трудно представить, сколько раз за последние несколько десятилетий в научном сообществе всплывало словосочетание «адресная доставка лекарств». И не случайно, ведь эта магическая формула, реализованная на практике, может совершить коренной переворот в современной медицине. К сожалению, все теоретическое многообразие систем доставки на практике часто сводится лишь к одному носителю — липосомам [1], да и то проблема контролируемого высвобождения лекарств из них окончательно не решена. В качестве возможной альтернативы «контейнерам» для адресной доставки лекарств в данной статье рассматривается механический подход с участием магнитных наночастиц.
Адресная доставка лекарств
Впервые о возможности адресной доставки лекарств заговорил в конце XIX в. великий немецкий бактериолог Пауль Эрлих (1854–1915), придумав термин «волшебная пуля» (рис. 1). Под ней подразумевался препарат, который при введении в организм больного избирательно находил бы и убивал возбудителя болезни (например, опухолевые клетки), не повреждая при этом здоровые ткани [2]. Строго говоря, концепция волшебной пули порождает две проблемы: направленное конструирование новых лекарственных препаратов — драг-дизайн (drug design) — и систем для их адресной доставки (drug delivery).

Основные понятия, используемые как в драг-дизайне, так и в задачах доставки, — это «мишень» и «лекарство». Мишень — макромолекулярная биологическая структура, предположительно связанная с определенной функцией, нарушение которой приводит к заболеванию. Чтобы излечиться от него, на эту структуру необходимо оказать определенное воздействие. Лекарство — это химическое соединение, специфически взаимодействующее с мишенью и модифицирующее клеточный ответ, создаваемый ею. Если в качестве мишени выступает рецептор, то лекарство будет, скорее всего, его лигандом (соединением, избирательно связывающимся с активным сайтом рецептора). Задача драг-дизайна состоит в том, чтобы, во-первых, выбрать правильную мишень, воздействуя на которую можно специфическим образом регулировать конкретные биохимические процессы, а во-вторых, найти или создать химические соединения, которые потенциально могут стать лекарствами. Задача адресной доставки, соответственно, заключается в транспортировании лекарства к мишени.
В современном научном мире под адресной доставкой лекарств понимают транспортировку молекул лекарственного вещества к мишени с помощью управляемого носителя, коим могут выступать другие молекулы или частицы (и даже клетки, например эритроциты). Почему же это направление исследований столь заманчиво для ученых?
В терапии трудноизлечимых на сегодняшний день заболеваний определяющую роль играет подбор оптимальной концентрации препарата в очаге поражения. Чтобы лекарство было эффективным, его молекулы должны попасть к нужным клеткам: антидепрессанты — к клеткам мозга, противоопухолевые препараты — к раковым клеткам и т. д. В действительности большая часть целевого препарата попадает в печень и там инактивируется, а затем выводится из организма почками. Наиболее очевидное решение этой проблемы — повышать начальную концентрацию вводимых веществ. Однако тогда многие из них могут стать токсичными, т. е., оказывая положительное воздействие на одни клетки, начнут подавлять жизнедеятельность других. Это особенно важно в случае противоопухолевых препаратов, о которых мы и будем говорить дальше.
Вот почему ученые всего мира активно развивают это направление исследований — адресную доставку лекарств, которые будут попадать точно в цель, не повреждая другие клетки. Следовательно, важно защитить лекарство, чтобы оно не вступало в химические реакции по пути к опухоли, а начало действовать лишь в нужном месте. Это можно сделать, поместив молекулы в защитный «контейнер», к которому предъявляется ряд требований:
- его материал не должен сам вступать в химические реакции, которые нарушили бы взаимодействие лекарства с опухолевыми клетками;
- его материал должен каким-либо образом способствовать транспорту лекарства в опухоль;
- само его строение и состав должны содействовать контролируемому высвобождению лекарства только после успешной доставки в опухоль.
Наибольшую проблему на сегодняшний день представляет именно высвобождение лекарства из «контейнера», что, как правило, требует дистанционного регулирования. Как добиться того, чтобы, например, оболочка «контейнера», непроницаемая в процессе его транспортировки и тем самым защищающая лекарство, после его доставки в место назначения стала проницаемой, позволяя содержимому выйти наружу и начать действовать?

Рис. 2. Система для адресной доставки лекарств на основе магнитных наночастиц
Поскольку идеального решения, удовлетворяющего всем критериям, до сих пор не найдено, в лаборатории химического дизайна бионаноматериалов химического факультета МГУ имени М. В. Ломоносова был предложен и разработан новый вариант системы для адресной доставки лекарственных препаратов. В ее состав входят три основных компонента: магнитные наночастицы, действующее вещество и его блокатор (рис. 2).
Действующее вещество — это и есть то лекарство, которое нужно доставить к больным тканям. Блокатор полностью подавляет его действие, т. е. не дает преждевременно вступать в химические реакции — имитирует «контейнер». Как же доставить магнитные наночастицы в опухоль и как сделать лекарство активным после транспортировки?
Доставка магнитных частиц в опухоль
Магнитные частицы выбраны в качестве носителей лекарства, поскольку ими можно управлять с помощью внешних магнитных полей. Однако не совсем верно полагать, что, просто водя вдоль тела больного по некоторой траектории постоянным магнитом, можно заставить частицы попасть в нужное место. Необходимо четко различать два вопроса: проникновение магнитного поля в ткани как таковое и его способность удерживать в требуемой области организма определенный процент введенных магнитных частиц.
Единственный фактор, от которого зависит проникновение переменного магнитного поля в ткань, — его частота. Поле частотой 1–10 МГц способно «пройти» лишь на 10–20 см вглубь, в то время как использование частоты 50–60 Гц обеспечивает на два-три порядка большую глубину проникновения. Следовательно, проникновение низкочастотного магнитного поля в любые ткани человека, в том числе опухолевые, практически ничем не ограничено.
Способность же переменного магнитного поля удерживать в нужном месте организма определенную долю введенных магнитных частиц не зависит от частоты, зато зависит от силовой характеристики поля, а также от проницаемости тканей для частиц. Что касается последнего аспекта, то для опухолей характерен так называемый эффект повышенной проницаемости и накопления (EPR-эффект, Enhanced Permeability and Retention), обусловленный «рыхлостью» стенок сосудов в пораженной области [3]. При этом магнитного поля индукцией 1 Тл вполне достаточно, чтобы удерживать магнитные частицы в конкретном месте после их доставки, т. е. сопротивляться потоку крови. Это продемонстрировали авторы статьи [4], смоделировав поток крови в сосудах под давлением. Они использовали установку, состоящую из перистальтического насоса, гонящего буферный раствор по силиконовой трубке из одной емкости в другую (рис. 3). Шприцем в трубку вкалывали магнитные частицы и изучали, как они удерживаются постоянным магнитом в определенном месте. При умеренных скоростях потока (6 мм/с) и расстоянии между потоком и источником магнитного поля 1 см в требуемой области удерживалось 50–60% введенных частиц.
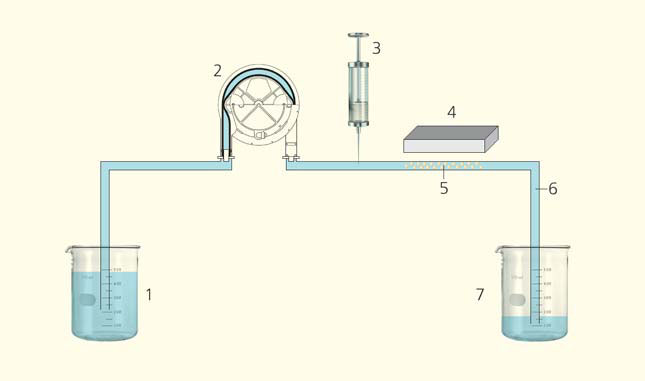
Рис. 3. Схема установки для изучения того, как в определенном месте потока магнитные частицы удерживаются магнитным полем. 1 — емкость с буферным раствором, 2 — перистальтический насос, 3 — шприц с магнитными частицами, 4 — постоянный магнит, 5 — место удержания частиц, 6 — силиконовая трубка, 7 — сливная емкость
Однако приложение сильного магнитного поля лишь в одной точке вне организма недостаточно полно разрешает вопрос доставки частиц к опухолям глубоко залегающих органов. Ведь в этом случае магнитные частицы будут накапливаться не только в целевой области, но также и по всему поперечному сечению от внешнего источника магнитного поля до глубины, которая служит пределом эффективного поля. Самое простое решение этой проблемы — одновременное использование двух источников магнитного поля, расположенных симметрично относительно области поражения. При этом геометрию и градиент суммарного поля можно подобрать таким образом, чтобы точка его фокусировки располагалась именно в опухоли. Также высказываются предложения хирургически имплантировать магниты в организм вблизи целевой области [5].
Комплекс «блокатор — лекарство»

Рис. 4. Иллюстрация принципа «ключ — замок» для комплекса фермента и его субстрата
Примеры «парных» молекул известны всем, кто занимается биохимией, — это комплексы «антиген — антитело», «фермент — субстрат», «фермент — ингибитор», «рецептор — лиганд» и др. Очень упрощенно можно сказать, что в основе взаимодействий этих молекул лежит принцип «ключ — замок», когда две молекулы настолько хорошо подходят друг другу по форме, заряду и т. д., что стремятся «найти» друг друга и образовать очень прочную связь (рис. 4).
Антитела и ферменты могут выступать в качестве лекарственных препаратов [6], теряя свою активность в присутствии соответствующих антигенов или ингибиторов. В нашей экспериментальной работе роль лекарства выполняли именно ферменты, поэтому остановимся подробнее на комплексах «фермент — субстрат» и «фермент — ингибитор».
Ферменты — биологические катализаторы, ускоряющие протекание многих реакций в организме. Фермент образует комплекс со своим субстратом — веществом, которое в ходе химической реакции превращается в ее продукт (рис. 5, вверху). Структуры фермента и субстрата подходят друг к другу так же, как ключ к замку. Именно это обусловливает их прочную связь, а также высокую избирательность ферментов к типу реакции, на скорость которой они могут повлиять. Однако существует еще один класс молекул, способных образовывать не менее устойчивые комплексы с ферментами, — их ингибиторы. Они схожи по структуре с субстратами, однако не превращаются в продукты реакции, а лишь препятствуют связыванию фермента с субстратом (рис. 5, внизу).

Рис. 5. Схематическое изображение комплексов «фермент — субстрат» (вверху) и «фермент — ингибитор»
Таким образом, если мы хотим использовать фермент в качестве прицельно доставляемого лекарства, то, конечно, рассчитываем, что его терапевтическим действием будет как раз превращение субстрата в продукт, причем происходить это должно исключительно в пораженной ткани. В качестве блокатора мы берем ингибитор, который не дает ферменту вступать в химические реакции. Однако, как только фермент достигнет определенного места в организме, нужно отделить от него ингибитор, позволяя ферменту начать взаимодействие с субстратом. В этом нам помогут магнитные частицы.
Снятие блокировки фермента
Мы уже говорили, что магнитными частицами в организме можно управлять извне с помощью магнитного поля. Рассмотрим случай, когда частицы состоят из молекул, обладающих собственным магнитным моментом (он обусловлен внутренним движением электронов). Соответственно, вся частица также будет обладать некоторым суммарным магнитным моментом, причем его направление будет произвольным относительно магнитных моментов других частиц. В своей работе мы синтезировали наночастицы оксида железа Fe3O4, образующего в природе минерал магнетит.
Мысленно поместим такие частицы между полюсами постоянного магнита, пренебрегая при этом сопротивлением среды и тепловыми флуктуациями (рис. 6). Внешнее магнитное поле будет стремиться повернуть хаотично ориентированные магнитные моменты частиц в одну сторону, по направлению своих силовых линий. Расчеты показывают [7], что при диаметре более 13–14 нм магнитные моменты частиц магнетита становятся сонаправленными силовым линиям внешнего поля преимущественно за счет механического поворота самих частиц.

Рис. 6. Схема, иллюстрирующая поведение магнитных частиц в поле постоянного магнита. В отсутствие внешнего поля магнитные моменты частиц (изображены маленькими стрелками) ориентированы хаотично (слева). Внешнее же магнитное поле стремится повернуть магнитные моменты частиц в одну сторону, сонаправленно с его силовыми линиями (тонкие стрелки)
Получается, если к магнитным частицам в растворе, помещаемом в магнитное поле, мы прикрепим какие-то молекулы, то поворачиваться, выстраиваясь по полю под действием возникающих механических сил, частицы будут вместе со своим «грузом». Мы провели численные оценки этих сил [8, 9], и в первом приближении оказалось, что они не зависят от вязкости раствора и частоты переменного поля, но линейно зависят от его индукции. В такой системе для магнитных наночастиц радиусом 10 нм в поле индукцией 0,1 Tл можно получить силу около 100 пН, а для наночастиц радиусом 20 нм в поле индукцией 0,2 Тл — 1000 пН. Благодаря исследованиям по силовой спектроскопии одиночных молекул [10, 11] известно, что такого диапазона сил достаточно для проведения манипуляций с белковыми макромолекулами. Именно это и лежит в основе разрыва связи между ферментом и ингибитором в нашей системе для адресной доставки лекарств.
Итак, первоначально у нас есть две порции наночастиц магнетита Fe3O4, покрытых золотой (инертной) оболочкой. К одной порции мы «пришиваем» фермент, а к другой — его ингибитор (рис. 7, слева). Затем смешиваем обе порции частиц друг с другом — и они попарно взаимодействуют между собой, образуя комплексы, в которых фермент связывается с ингибитором и становится неактивным (рис. 7, справа). Осталось добиться механического разрыва связи между ферментом и ингибитором или как минимум ее деформации, а следовательно, ослабления, что позволит ферменту вновь стать активным и начать действовать. Безусловно, активация фермента актуальна только после доставки описанных комплексов к нужным клеткам.

Рис. 7. Образование комплекса между ферментом и ингибитором на магнитных наночастицах

Рис. 8. Схема, иллюстрирующая поведение магнитных наночастиц с «пришитыми» к ним молекулами фермента и ингибитора во внешнем магнитном поле катушки с током. В отсутствие внешнего поля магнитные моменты (изображены черными стрелками) двух наночастиц магнетита в комплексе ориентированы произвольным образом (вверху). Во внешнем магнитном поле катушки с током магнитные моменты частиц будут ориентироваться в направлении силовых линий поля (если ток течет по обмотке по часовой стрелке, то силовые линии катушки по правилу правой руки направлены вниз, как показано тонкими прямыми стрелками) за счет механического вращения самих частиц (направления вращения показаны тонкими стрелками вверху). В результате связь между ферментом и ингибитором будет растягиваться и деформироваться. Если же пустить через катушку переменный ток, меняющий свое направление на противоположное с определенной частотой, то и магнитное поле катушки тоже будет менять ориентацию, а значит, многократные повороты частиц в разных направлениях через некоторое время неизбежно разорвут связь фермента с ингибитором (внизу)
Каждая из двух наночастиц магнетита в комплексе обладает собственным магнитным моментом, в общем случае — произвольно направленным (рис. 8, вверху). Поместим систему во внешнее магнитное поле, например, внутрь катушки с постоянным током. Тогда магнитные моменты частиц будут ориентироваться в направлении силовых линий магнитного поля катушки. Поворот магнитных моментов будет происходить за счет механического вращения самих частиц, в ходе которого связь между ферментом и ингибитором, очевидно, растягивается и деформируется. Учитывая, что диаметр используемых наночастиц равен приблизительно 20 нм, а размеры фермента и ингибитора намного меньше — около 2 нм, при любом начальном положении магнитных моментов двух частиц, кроме идеально совпадающего, во внешнем магнитном поле они будут «тянуть» фермент и ингибитор в разные стороны. А если пустить через катушку переменный ток, меняющий свое направление на противоположное с определенной частотой, то и магнитное поле катушки тоже будет менять ориентацию, а значит, повороты частиц будут происходить многократно в разных направлениях. При таких условиях через некоторое время связь фермента с ингибитором неизбежно разорвется (рис. 8, внизу). Фермент станет доступным для субстрата (который не связан с магнитной наночастицей и поэтому более подвижен) — и между ними произойдет нужная каталитическая реакция.
Чего удалось достигнуть
Мы получили водные растворы наночастиц магнетита Fe3O4 диаметром 10 нм и покрыли их защитной оболочкой из золота толщиной около 6 нм (рис. 9, 10) [12]. Затем к половине частиц «пришили» фермент альфа-химотрипсин (диаметр молекулы около 2 нм), а к другой половине — соевый ингибитор трипсина, способный блокировать действие нашего фермента. В организме человека химотрипсин содержится в секрете поджелудочной железы и участвует в расщеплении белков в тонком кишечнике. Разумеется, теоретически возможна ситуация, когда альфа-химотрипсин понадобится прицельно доставить в организм человека, страдающего расстройством пищеварения. Однако на данном этапе мы, скорее, выбрали этот фермент как хорошо изученную модель с известными характеристиками (размером, молекулярной массой, структурой, химическими свойствами и т. д.). Эксперименты с магнитными наночастицами, несущими фермент или его ингибитор, проводили in vitro, не помещая частицы в живой организм.

Рис. 9. Схема получения наночастиц магнетита для экспериментальной работы. Наночастицы магнетита образовывались в процессе соосаждения солей железа (II, III) в щелочной среде. Затем частицы прикапывали в кипящий раствор соли золота HAuCl4, которая адсорбировалась на их поверхности, и добавляли к ним цитрат натрия, восстанавливающий ионы Au3+ до металлического золота. Так частицы магнетита оказывались покрыты золотой оболочкой. Их отделяли из смеси центрифугированием, далее покрывали лигандом — липоевой кислотой (L—SH), избыток которой удаляли диализом. Этот лиганд служил линкером между магнитными наночастицами и молекулами фермента или ингибитора
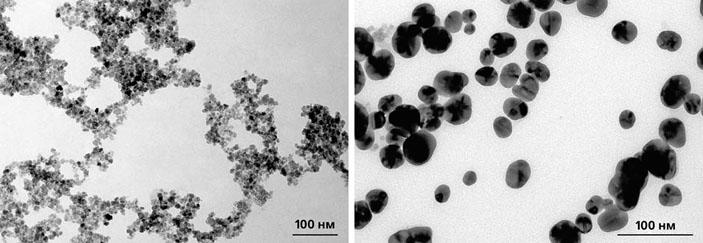
Рис. 10. Полученные наночастицы магнетита диаметром 10 ± 2 нм (слева) и наночастицы магнетита, покрытые золотом, диаметром 23 ± 3 нм. Фотографии сделаны с помощью просвечивающего электронного микроскопа

Рис. 11. Принцип определения активности протеолитического фермента с помощью хромогенного субстрата. Исходный субстрат имеет максимум поглощения в области короткого ультрафиолета, а свободный паранитроанилин (pNA) — около 380 нм. Протеаза отщепляет от молекулы субстрата pNA, что приводит к сдвигу максимума поглощения раствора в длинноволновую область. Это регистрируется спектрофотометром. Итоговая концентрация pNA пропорциональна активности протеазы и определяется по увеличению поглощения света с длиной волны 405 нм
Чтобы судить об успешности эксперимента, нужно иметь возможность оценивать активность фермента. Ведь он не просто должен быть доставлен в конкретное место организма, а еще и способен эффективно работать после отделения от ингибитора. Альфа-химотрипсин катализирует гидролиз пептидных связей, поэтому в качестве субстрата мы выбрали паранитроанилид-N-бензоил-L-тирозин (BTNA). Фермент отщепляет от субстрата паранитроанилин, что сдвигает максимум поглощения раствора в длинноволновую область (рис. 11). В нашей лаборатории специально сконструировали прибор, совмещающий в себе функции спектрофотометра и катушки с током. С его помощью мы можем одновременно прикладывать внешнее магнитное поле и измерять зависимость поглощения раствора от времени.
Итак, мы сравнивали скорость реакции гидролиза BTNA под действием альфа-химотрипсина в различных условиях.
- Все магнитные наночастицы связывали только с альфа-химотрипсином, ингибитора не было вообще. К частицам в отсутствие внешнего магнитного поля добавляли субстрат BTNA и помещали раствор в спектрофотометр, чтобы определить максимальную эффективность работы фермента.
- Часть магнитных наночастиц связывали с ферментом, часть — с его ингибитором и инкубировали оба раствора вместе для образования комплексов. Затем к ним в отсутствие внешнего магнитного поля добавляли субстрат BTNA и помещали раствор в спектрофотометр, чтобы определить, насколько эффективно ингибитор подавляет действие фермента.
- Наконец, к магнитным наночастицам с образованными, как в пункте 2, комплексами фермента с ингибитором добавляли субстрат BTNA, помещали раствор в спектрофотометр и включали внешнее магнитное поле.
Скорость гидролиза BTNA в отсутствие ингибитора (характеризующую максимальную активность фермента) принимали за 100%. При связывании альфа-химотрипсина с ингибитором активность протеазы падала до 25–30%, однако при включении внешнего магнитного поля повышалась приблизительно в два раза, до 50–55%, т. е. комплекс фермента с ингибитором частично разрушался — и фермент лучше взаимодействовал с субстратом (рис. 12).
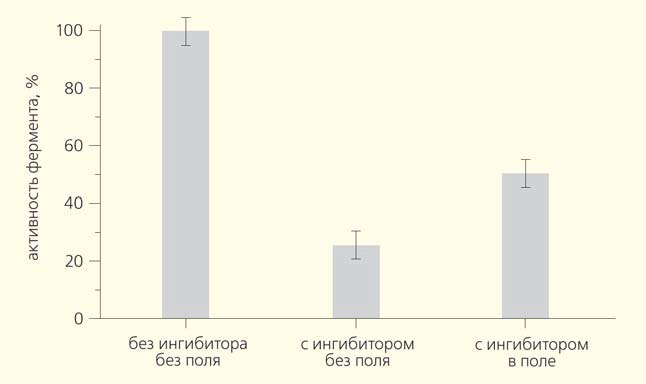
Рис. 12. Скорость реакции гидролиза субстрата (активность фермента) при различных условиях эксперимента
Любой человек, знакомый с термином «магнитная гипертермия» (направленный нагрев опухолевых клеток — с целью их уничтожения — с помощью магнитных наночастиц), может возразить, что наблюдаемое изменение скорости реакции объясняется не структурными перестройками связи фермента с ингибитором, а локальным нагревом в растворе. Однако мы специально использовали низкую частоту переменного поля (50 Гц по сравнению с частотой 100–1000 кГц, которая применяется для магнитной гипертермии). Поскольку интенсивность нагрева пропорциональна частоте, любые термические эффекты были сведены к минимуму [13]. «Обработка» магнитным полем фермента либо фермента в комплексе с ингибитором без магнитных наночастиц не приводила к изменению скорости реакции.
В идеальном случае в отсутствие внешнего магнитного поля ингибитор должен был бы полностью (до 0%) подавлять активность фермента при образовании комплексов соответствующих магнитных наночастиц. После же включения магнитного поля активность фермента восстанавливалась бы до исходной (100%) — той, что регистрировалась в отсутствие ингибитора и поля. В своих экспериментах мы не достигли такого максимального эффекта: по-видимому, условия были подобраны не оптимально. Например, могло оказаться, что не все молекулы альфа-химотрипсина связались с магнитными частицами на этапе синтеза или что часть молекул фермента «пришилась» сразу к нескольким частицам каждая, в результате став пространственно недоступной. Такой фермент (или ингибитор, ведь с ним могло произойти то же самое) — словно бисерина, зажатая на нитке между двумя большими бусинами (магнитными частицами). Очевидно, что продеть нитку (образовать химическую связь) одновременно через эту бисерину и какую-нибудь еще, прикрепленную к одной или двум другим большим бусинам, практически невозможно. Эти недостатки мы планируем устранить, аккуратно подобрав соотношение количества магнитных частиц и молекул фермента с ингибитором, к ним «пришиваемым».
В будущем, когда модельная система с альфа-химотрипсином и его ингибитором будет доработана, мы перейдем к экспериментам с ферментом аргиназой и ее ингибитором (например, норвалином). Аргиназа расщепляет аргинин до орнитина и мочевины. Несколько лет назад установили, что снижение концентрации аргинина в крови эффективно замедляет развитие рака печени у человека [14]. Поэтому данное направление исследований крайне актуально. Изучаемая нами система доставки на основе магнитных наночастиц, которая высвобождает фермент из его комплекса с ингибитором под действием внешнего магнитного поля, безусловно, может помочь в решении проблемы, как транспортировать аргиназу в клетки печени, не потеряв при этом активности фермента.
Итак, в нашей лаборатории был разработан и экспериментально подтвержден принципиально новый подход к высвобождению лекарства, который может быть использован при его адресной доставке в требуемое место организма. Действующее вещество транспортируется магнитными наночастицами прицельно в клетки опухоли (безусловно, при правильной фокусировке и оптимизации индукции и частоты прикладываемого переменного магнитного поля). При определенных размерах молекул фермента и ингибитора по сравнению с размером самих наночастиц, к которым они «пришиты», связи между молекулами лекарства-фермента и его блокатора-ингибитора механически разрываются под действием магнитного поля. Учитывая малые масштабы такой системы, этот способ был назван наномеханическим. Мы рассчитываем, что проведенные эксперименты станут основой для развития нового направления в адресной доставке лекарств, в частности в терапии онкологических заболеваний печени, что приведет к созданию коммерчески доступного терапевтического препарата и даст пациентам с ныне неизлечимыми недугами надежду на выздоровление.
Авторы выражают благодарность А. В. Барулину за вклад в экспериментальную часть работы.
Работа выполнена при поддержке Российского научного фонда (проект 14-13-00731), в рамках Федеральной целевой программы № 14.607.21.0132 и Программы развития МГУ ПНР 5.13.
Литература
1. Allen T. M., Cullis P. R. Liposomal drug delivery systems: from concept to clinical applications // Adv. Drug Deliv. Rev. 2013. V. 65. P. 36–48. DOI: 10.1016/j.addr.2012.09.037.
2. Ивонин А. Г., Пименов Е. В., Оборин В. А. и др. Направленный транспорт лекарственных препаратов: современное состояние вопроса и перспективы // Известия Коми научного центра УрО РАН. 2012. Т. 1. № 9. С. 46–55.
3. Maeda H. Tumor-selective delivery of macromolecular drugs via the EPR effect: background and future prospects // Bioconjug. Chem. 2010. V. 21. P. 797–802. DOI: 10.1021/bc100070g.
4. Kayal S., Ramanujan R. V. Anti-сancer drug loaded iron — gold core — shell nanoparticles (Fe@Au) for magnetic drug targeting // J. Nanosci. Nanotechnol. 2010. V. 10. P. 5527–5539.
5. Reddy L. H., Arias J. L., Nicolas J., Couvreur P. Magnetic nanoparticles: design and characterization, toxicity and biocompatibility, pharmaceutical and biomedical applications // Chem. Rev. 2012. V. 112. P. 5818–5878. DOI: 10.1021/cr300068p.
6. Ren J., Wang F., Wei G. et al. MRI of prostate cancer antigen expression for diagnosis and immunotherapy // PLoS One. 2012. V. 7. e38350. DOI: 10.1371/journal.pone.0038350.
7. Jeyadevan B. Present status and prospects of magnetite nanoparticles-based hyperthermia // J. Ceram. Soc. Japan. 2010. V. 118. P. 391–401. DOI: 10.2109/jcersj2.118.391.
8. Головин Ю. И., Клячко Н. Л., Головин Д. Ю. и др. Новый подход к управлению биохимическими реакциями в магнитной наносуспензии с помощью низкочастотного магнитного поля // Письма в «ЖТФ». 2013. Т. 39. № 5. С. 24–32.
9. Golovin Y. I., Gribanovsky S. L., Golovin D. Y. et al. Towards nanomedicines of the future: Remote magneto-mechanical actuation of nanomedicines by alternating magnetic fields // J. Control. Release. 2015. V. 219. P. 43–60. DOI: 10.1016/j.jconrel.2015.09.038.
10. Puchner E. M., Gaub H. E. Single-molecule mechanoenzymatics // Annu. Rev. Biophys. 2012. V. 41. P. 497–518. DOI: 10.1146/annurev-biophys-050511-102301.
11. Mori T., Asakura M., Okahata Y. Single-molecule force spectroscopy for studying kinetics of enzymatic dextran elongations // J. Am. Chem. Soc. 2011. V. 133. P. 5701–5703. DOI: 10.1021/ja200094f.
12. Majouga A., Sokolsky-Papkov M., Kuznetsov A. et al. Enzyme-functionalized gold-coated magnetite nanoparticles as novel hybrid nanomaterials: synthesis, purification and control of enzyme function by low-frequency magnetic field // Colloids Surf. B Biointerfaces. 2015. V. 125. P. 104–109. DOI: 10.1016/j.colsurfb.2014.11.012.
13. Klyachko N. L., Sokolsky-Papkov M., Pothayee N. et al. Changing the enzyme reaction rate in magnetic nanosuspensions by a non-heating magnetic field // Angew. Chem. Int. Ed. Engl. 2012. V. 51. P. 12016–12019. DOI: 10.1002/anie.201205905.
14. Munder M. Arginase: an emerging key player in the mammalian immune system // Br. J. Pharmacol. 2009. V. 158. P. 638–651. DOI: 10.1111/j.1476-5381.2009.00291.x.
* Статью «Наномеханика для адресной доставки лекарств — насколько это реально?», участвовавшую в конкурсе «Био/мол/текст» 2015 г. в номинации «Своя работа», можно найти здесь. — Примеч. ред.

















Рис. 1. Пауль Эрлих и его концепция волшебной пули. Например, подобный «снаряд» способен поражать только серповидные эритроциты в крови больного серповидноклеточной анемией