Об антифризах — белках и не только
Аркадий Курамшин, кандидат химических наук
«Химия и жизнь» №12, 2016
Жизнь в полярных широтах сложна и полна ужасов. Соленая морская и океанская вода не замерзает до −2°C, такой холод вполне может погубить живое существо. Однако некоторые животные, неспособные регулировать температуру собственного тела, приспособились к этим температурам. Например, отдельные виды рыб весьма счастливы жизнью, которую ведут в туннелях и дырах, образующихся в плавающих островах из морского льда. Выживать в таких экстремальных условиях им, как и многим другим обитателям полярных широт, помогают сформировавшиеся в ходе эволюции вещества — белки-антифризы, о которых и пойдет речь.
Впервые эти вещества были открыты при изучении антарктических рыб в конце 1960-х годов. С тех пор минуло полвека, и оказалось, что многие другие биологические организмы вырабатывают сходные по структуре соединения, не дающие ледяным кристаллам образоваться в их теле. Рыбы, с изучения которых все началось, выдерживают охлаждение только до −1,9°C, а наземные организмы могут выживать в такие холода, по сравнению с которыми −2°C кажутся жарой. Более эффективные, чем у рыбы, белки-антифризы найдены у многих представителей флоры и фауны, а рекордсмены по холодостойкости — проживающие на Аляске жуки Dendroides canadensis, личинки которых подолгу сохраняют жизнеспособность при температуре −60°C и даже переживают кратковременную заморозку до −100°C (рис. 1).

Несмотря на значительные различия в строении этих соединений, появляются новые и новые свидетельства в пользу того, что все природные «незамерзайки» работают по близкому и не особо сложному механизму. Он интересен не только специалистам по животному и растительному миру Арктики и Антарктики: знание того, как работают природные антифризы, уже используется на практике.
Кровь не леденеет
Белки-антифризы привлекают внимание медиков и производителей замороженных полуфабрикатов в первую очередь биологической совместимостью, а также и тем, что принцип действия этих веществ кардинально отличается от антифризов, применяющихся, например, для защиты двигателей автомобилей. Главный компонент верного зимнего друга автолюбителя — этиленгликоль — понижает температуру замерзания воды за счет коллигативных эффектов: при добавлении его к раствору увеличивается неупорядоченность жидкой системы, и температура замерзания понижается. По такому же принципу понижают температуру таяния соли, входящие в состав противогололедных реагентов. Именно из-за растворенных в морской воде солей ее температура замерзания «уходит в минуса» и в среднем составляет −2°C.
В 1960-е годы исследователи, изучавшие кровь антарктических рыб, пытались определить соединения, понижающие ее температуру замерзания. Тогда предполагалось, что морозостойкость обитателей полярных широт тоже связана с коллигативными эффектами, поэтому исследователи искали многоатомные спирты (полиолы) и другие низкомолекулярные соединения, близкие по строению к антифризам, использующимся в технике. Представления того времени о физической химии растворов позволяли с уверенностью исключить белки из списка потенциальных антифризов — их концентрации в крови и иных биологических жидкостях полярных животных слишком малы, чтобы они могли понижать температуру замерзания по тому же механизму, что полиолы и соли. Вместе с тем выделенные из крови этих рыб низкомолекулярные вещества также не могли объяснить, почему кровь не замерзает.
Загадку смог разгадать специалист по биологии полярных рыб Артур Деврис (Arthur DeVries), опубликовавший результаты своего исследования в 1969 году (Science, 1969, 163, 3871, 1073–1075, doi: 10.1126/science.163.3871.1073). Он впервые установил, что необычный выделенный из крови полярных рыб гликопротеид — биомолекула, в которой углеводный фрагмент связан с полипептидной цепью, — не дает их крови превратиться в лед (рис. 2).

Рис. 2. Трематома-пестряк Trematomus bernacchii — героиня статьи Девриса 1969 года
Вскоре к исследовательской группе Девриса присоединился Джон Дюман. Темой его работы была идентификация веществ, понижающих температуру замерзания крови организмов, которые обитают на другом полюсе Земли, в арктических регионах. Дюману посчастливилось обнаружить белок-антифриз зимней камбалы Pseudopleuronectes americanus (рис. 3). Этот белок, в отличие от того, который обнаружил Деврис, не содержал углеводного фрагмента (Nature, 1974, 247, 5438, 237–238, doi: 10.1038/247237a0). Обнаружение второго белка-антифриза на какое-то время озадачило ученых — такими разными по строению оказались две биомолекулы, отвечающие за одинаковые свойства.

Рис. 3. Зимняя камбала Pseudopleuronectes americanus
Защитив диссертацию и начав собственную научную карьеру, Дюман переключился на изучение морозоустойчивых насекомых, которыми он и занимается по сей день. Один из самых интересных объектов в этой области — уже упомянутый жук Dendroides canadensis: его организм вырабатывает наиболее мощные белки-антифризы. В первичной структуре (то есть попросту в аминокислотной последовательности) одного из этих белков регулярно встречаются остатки треонина и цистеина, причем цистеины образуют дисульфидные мостики, укладывая белок зигзагом. Вторичная структура белка-антифриза — β-складчатая, а третичная обеспечивает равномерное распределение гидроксильных групп треонина по одной плоской стороне белка (рис. 4). Детальное строение этих белков различается не только у разных подвидов D. canadensis, но даже у насекомых, относящихся к одному биологическому виду. Дюман и его коллеги смогли обнаружить около 30 различных подтипов белков-антифризов, строение которых обеспечивает наиболее эффективную работу в различных отделах организма жука (или его личинки), от пищеварительной и кровеносной системы до покровных тканей.
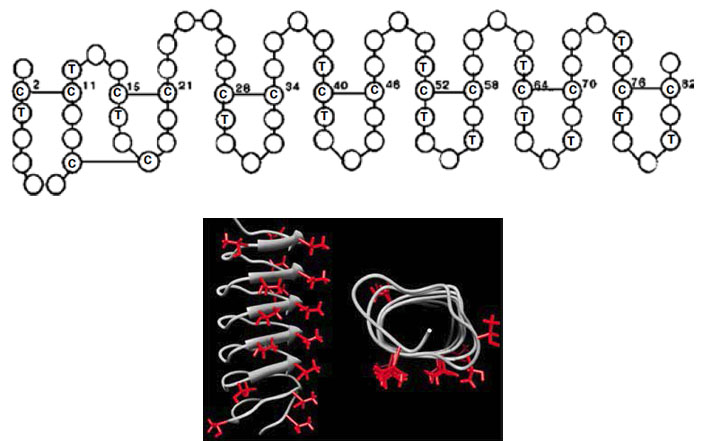
Рис. 4. Белок-антифриз DAFP-1 жука D. canadensis. С и Т — остатки цистеина и треонина. Этот белок не гликозилированный, углеводных групп у него нет. Снизу третичная структура того же белка. Все остатки треонина смотрят в одну сторону — эта сторона и будет взаимодействовать с ледяными кристаллами
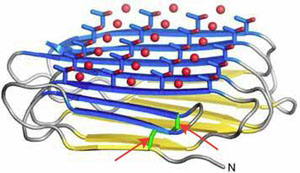
Рис. 5. Кристаллическая структура белка-антифриза жука Rhagium inquisitor со связанными молекулами воды. Гидрофильные фрагменты треонина обозначены стержневыми моделями, вода — сферами, дисульфидные связи между остатками цистеина показаны стрелками
Питер Дэвис, биохимик из канадского Университета Королевы Марии, изучающий соотношение «структура — свойства» белков-антифризов, отмечает, что строение этих белков зависит от того, к какому царству принадлежит организм, вырабатывающий антифризы, и от примерного времени, когда животное или растение (или их эволюционные предки) смогли «создать» белки, защищающие от холода. В настоящее время среди них известны белки и со спиральной, и со складчатой вторичными структурами, и простые, и сложные, с глобулярной или фибриллярной третичной структурой.
Тем не менее у них, по словам Дэвиса, есть общие структурные мотивы. Обычно одна из поверхностей белков-антифризов плоская, довольно часто гидрофильная, в некоторых случаях на ней располагаются регулярно повторяющиеся группы (рис. 5). Именно благодаря этой поверхности и понижается температура замерзания — с ней связываются зарождающиеся кристаллики льда, а она ограничивает их дальнейший рост.
От теории к практике
Еще в 1971 году Деврис предположил, что белки-антифризы могут препятствовать росту кристаллов льда (Science, 1971, 172, 3988, 1152–1155, doi: 10.1126/science.172.3988.1152). Это предположение блестяще подтверждается при изучении формы кристаллов, образующихся в присутствии белков-антифризов. Обычно кристаллы льда формируются в виде призм с шестью прямоугольными гранями и двумя шестиугольными основаниями, причем площадь оснований меньше площади боковых граней. Белки-антифризы рыб связываются с прямоугольными гранями ледяной призмы, не позволяя новым молекулам воды присоединяться к ним. Доступными для молекул воды остаются только шестиугольные грани-основания, что значительно замедляет рост кристаллов.
Для подтверждения этого механизма Дэвис и его коллеги проводили направленный мутагенез, изменяя определенные участки различных белков-антифризов, и убедительно доказали, что за связывание льда отвечает именно плоская гидрофильная поверхность белка. В настоящее время исследователи считают, что они вплотную подошли к пониманию взаимодействий белка и кристаллов льда на молекулярном уровне.

Печальный глаз зимней камбалы. Может быть, ей холодно?
Как поясняет Дэвис, механизм, который в настоящее время предложен для белков-антифризов рыб, возможно, применим ко всем белкам, собирающим на одной из своих поверхностей воду и кристаллы льда. Предполагается, что он напоминает механизм образования слоя квазижидкой воды на ледяных кристаллах, только вместо квазижидкой воды с кристаллом льда взаимодействуют гидрофильные фрагменты белка.
Хотя такой слой белка, имитирующий поведение квазижидкой воды на поверхности кристалла льда, пока невозможно наблюдать непосредственно, Дэвис с коллегами, используя кристаллографическое исследование белков и их квантово-химическое моделирование, собрали достаточно свидетельств в пользу такой модели. Дэвис заявляет, что большим прорывом было бы детальное изучение кристаллических структур надмолекулярных ассоциатов белков-антифризов со льдом. По его словам, результаты компьютерного моделирования свободных белков очень хорошо согласуются с результатами их исследования с помощью рентгеноструктурного анализа, однако для окончательного вывода необходимо получить еще и кристаллические структуры белков, связанных с водой.
Белки-антифризы интересны не только с точки зрения эволюционной и молекулярной биологии, они уже нашли практические применения. Так, в некоторые сорта мороженого фирмы Unilever добавляют «лед-формирующий белок» — так в списке ингредиентов называют белок-антифриз. Он нужен не для того, чтобы понизить температуру замерзания мороженого (и конечно же не для того, чтобы получить десерт со вкусом рыбы), здесь эксплуатируется другой талант белков-антифризов — способность ограничивать размеры кристаллов. Даже при небольшой добавке такого белка текстура мороженого сохраняется после очень глубокой заморозки, кристаллики льда не хрустят на зубах. Продукты питания, содержащие белки-антифризы, продаются в США и Австралии с начала 2000-х годов, а в 2009 году Unilever получил и разрешение Евросоюза. Разумеется, в промышленных количествах эти белки выделяют не из обитателей полярных широт, а из генетически модифицированных дрожжей.
Применение белков-антифризов сдерживается страхом потенциальных потребителей перед ГМО. Так, по словам Дэвиса, одна из интересных задач, которые можно было бы решить, — выведение устойчивых к низким температурам лососевых рыб. Идея проста: нужно внедрить в геном рыбы или даже растения ген, отвечающий за синтез белка-антифриза. Это позволило бы продлить время выращивания растений, а также выращивать сельхозкультуры или промысловую рыбу в гораздо более холодных регионах. В настоящее время у исследователей достаточно информации, чтобы получить ГМ-лосося, столь же устойчивого к холоду, как эндемичные для Арктики и Антарктики рыбы. Кстати, быстрорастущая генно-модифицированная семга AquAdvantage от компании AquaBounty Technologies уже признана безопасным пищевым продуктом в США и Канаде. Однако пока нет уверенности в том, что у владельцев рыбохозяйств и потребителей будет пользоваться спросом морозоустойчивый лосось.
Криоконсервация: чем заменить природные антифризы?
Другая возможная область применения белков-антифризов — криоконсервация органов, предназначенных для трансплантации. Однако здесь эти биомолекулы зарекомендовали себя не так хорошо, как многие надеялись. При контакте с биологическими тканями, подвергающимися криосохранению, белки-антифризы больше вредят им, чем защищают от повреждения. Проблемы возникают при разморозке донорского органа. Как поясняет специалист по химии биополимеров из Университета Уорвика Мэтью Гибсон, внешняя часть органа начинает оттаивать быстрее внутренней, это приводит к диспропорции в поглощении энергии в различных участках органа, в результате может начаться быстрое повторное образование кристаллов льда, которые и повреждают донорский орган. Способность белков-антифризов блокировать подход воды к боковым граням ледяных призм в данном случае играет злую шутку: кристаллы растут только со стороны оснований, образуются тонкие и острые ледяные иголки, которые протыкают клеточные мембраны и вызывают некоторые другие проблемы.
Гибсон с коллегами пытаются найти материалы, способные ингибировать кристаллизацию льда, не понижая температуру замерзания воды и не формируя кристаллы льда с опасной формой. В поисках подобных соединений исследователи решили испытать ряд синтетических полимеров, способных связывать воду.
Исследование, проведенное в группе Гибсона, привело к неожиданному результату. Оказалось, что поливиниловый спирт — продукт крупнотоннажного производства, к тому же разрешенный к применению в ряде стран в качестве пищевой добавки, — тоже ингибирует кристаллизацию воды при низких температурах (Polymer Chemistry, 2010, 1, 1141–1152, doi: 10.1039/C0PY00089B). Механизм антифризной активности поливинилового спирта еще менее изучен, чем механизм работы белков-антифризов; загадочности добавляет и то обстоятельство, что синтетические полимеры не образуют регулярных третичных структур, подобных белкам. Единственное, о чем с уверенностью говорят полимерщики из Уорвика, — увеличение молекулярной массы полимера приводит к возрастанию его антифризной активности.
Предположение, что для поливинилового спирта размер имеет значение, опровергается рядом работ, в которых показано, что ингибировать рост кристаллов льда могут и низкомолекулярные вещества, правда, опять же способные связаться с водой (рис. 6). В 2012 году Роберт Бен из Университета Оттавы обнаружил, что понижение температуры замерзания воды и замедление ее кристаллизации могут вызывать низкомолекулярные поверностно-активные вещества — октилгалактопиранозид и октилглюконамид (Chemical Science, 2012, 3, 1408–1416, doi: 10.1039/C2SC00885H). В 2016 году химики из Нью-Йорка наблюдали ингибирование роста кристаллов льда сафранином — красителем, который используют в биохимических исследованиях для подкрашивания клеточных ядер (Journal of American Chemical Society, 2016, 138, 40, 13396–13401, doi: 10.1021/jacs.6b08267). Исследователи предполагают, что механизм работы низкомолекулярных антифризов немного иной, чем у высокомолекулярных, — малые молекулы с гидрофильными фрагментами просто размещаются на кристалле льда и нарушают устойчивость границы раздела между слоем квазижидкой воды, окружающей кристалл, и обычной жидкой водой, что также не дает льду расти. Заметим, что коллигативные эффекты, характерные для других низкомолекулярных соединений — солей и многоатомных спиртов, в данном случае, так же, как и для белков, не играют особой роли.
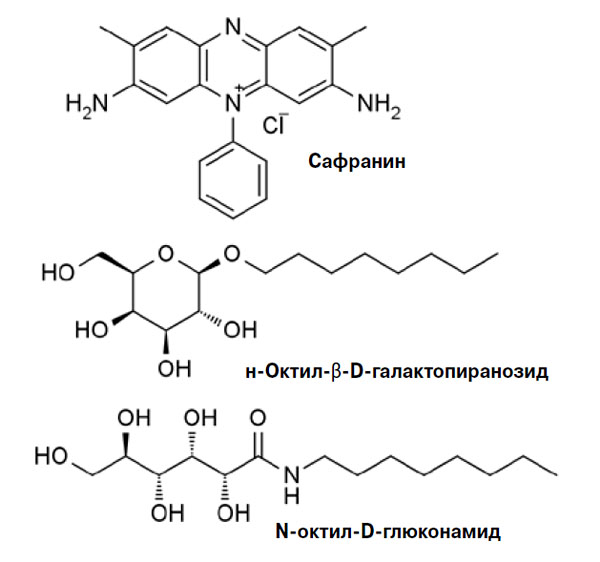
Рис. 6. Низкомолекулярные природные антифризы
Не белками едиными
С 1969 года, когда Артур Деврис обнаружил первый белок, защищающий полярных рыб от холода, началась гонка, целью которой были аналогичные или похожие белки других биологических видов. В 1960–1970-е годы все упорно искали только белки, возможно, поэтому открытия природного антифриза, не имеющего белкового строения, пришлось ждать несколько десятилетий.
Такое вещество выделил из организма морозоустойчивого жука Upis ceramboides все тот же Джон Дюман (Proceedings of the National Academy of Sciences USA, 2009, 106, 48, 20210–20215, doi: 10.1073/pnas.0909872106). В его лаборатории несколько месяцев пытались очистить выделенный из личинки жука белок, но все попытки получения чистой фракции оказывались неудачными. Как выяснилось затем, вещество, которое пытались чистить как белок, вовсе не было белком, а представляло собой гликолипид — вещество, содержащее углеводный и липидный фрагменты. (Поскольку к липидам относят любые гидрофобные молекулы, октилгалактопиранозид с октилглюконамидом вполне можно считать синтетическими гликолипидами.)
После открытия гликолипидного антифриза в 2009 году Дюман и его коллеги смогли выделить ингибирующие рост льда гликолипиды из одного вида растения, шести видов насекомых и одной лягушки, поэтому можно предположить, что эти вещества также часто используются в природе для защиты от холода. В отличие от белков-антифризов гликолипиды-антифризы, скорее всего, обеспечивают защиту клеточных мембран. Как полагает Дюман, некоторые виды выработали особый способ борьбы с низкими температурами: хотя их внеклеточная жидкость и замерзает, гликолипиды препятствуют проникновению льда через мембрану и фатальному для организма замерзанию внутриклеточной жидкости. Если это предположение подтвердится, то антифризы природного происхождения для криоконсервации органов будет логичнее искать среди гликолипидов.
В эти зимние дни, поднимая воротник, как парус декабря, стараясь побыстрее попасть из дома на работу, с работы домой, чтобы поменьше оставаться на морозной улице, не забудьте, что есть немало организмов, для которых температура, обычная для наших декабрьских и январских морозов, — не повод для отчаяния и анабиоза. Сохранять активность, жить и оставлять потомство при низких температурах этим организмам помогают антифризы природного происхождения — белки и гликолипиды.














Рис. 1. Личинка жука Dendroides canadensis выживает при отрицательных температурах благодаря белкам-антифризам