Борьба за выживание приводит к раку
Н. Л. Резник,
кандидат биологических наук
«Химия и жизнь» №10, 2015
Естественный отбор — всеобъемлющий процесс. За место под солнцем борются не только популяции и отдельные особи, но даже клетки. Между конкуренцией организмов и клеток есть разница, принципиальная для нас: отбор наиболее приспособленных особей ведет к процветанию вида, а отбор наиболее приспособленных, то есть быстро делящихся, хищникам не поддающихся и практически бессмертных клеток может убить их обладателя.
Отбор в клеточных популяциях исследуют многие ученые и не одно десятилетие. В их числе профессор Стэндфордского университета Ирвинг Вейсман, описавший в недавней публикации (Proceedings of the National Academy of Sciences, 2015, 112, 8922–8928, DOI:10.1073/ pnas.1505464112) результаты тридцатилетних экспериментов. Он и сотрудники его лаборатории наблюдали конкуренцию в популяциях стволовых клеток оболочника, сперматогенных клеток мыши и кроветворных клеток мыши и человека, а также превращение гемопоэтических стволовых клеток человека в раковые. А началось всё в 1980-х годах с исследования оболочников Botryllus schlosseri.
Конкуренция в колонии
Оболочники, они же личиночнохордовые, — морские животные. Их жизненный цикл представляет собой чередование полового и бесполого размножения, личинки подвижны, а взрослые особи оседают на дно и образуют колонии (рис. 1).
Плавучая личинка B. schlosseri развивается из оплодотворенного яйца, она напоминает головастика: голова с глазами, хвост, нотохорд (примитивная хорда), нервная трубка и сегментированная мускулатура. Головастик, поплавав, оседает на дно и превращается в беспозвоночное, нотохорд исчезает в результате апоптоза, и макрофаги поглощают его мертвые клетки. Взрослая особь, которая называется оозоидом, имеет обманчиво-простой вид: ротовой и клоакальный сифоны с пищеварительным трактом между ними, жаберные щели, эндостиль, который вырабатывает гормоны, простое трубкообразное сердце и кровеносная система, все это укутано студенистой туникой. Оозооид размножается почкованием, в ходе которого образует колонию генетически идентичных особей — зооидов, или бластозооидов (посматривайте на рисунок).

Почкование происходит еженедельно, пока жива колония. Когда одной из особей приходит пора умереть, все ее органы подвергаются апоптозу, а мертвые клетки достаются фагоцитам кровеносной системы. Кровеносная система зооидов разветвленная, ее сосуды выступают из тела в тунику, образуя в ней петли и пальцеобразные выросты (ампуллы). У зооидов одной колонии кровеносная система общая. Если же, как нередко бывает, несколько колоний растут в тесном соседстве, их кровеносные сосуды соприкасаются и между ними образуются временные соединения — анастомозы. Такие контакты заканчиваются двояко. В некоторых случаях начинается воспаление и на границе кровеносных систем образуется разделяющий соседей шрам. Но возможен и более счастливый исход: сосуды объединяются, и соседние колонии оказываются соединены общей кровеносной системой.
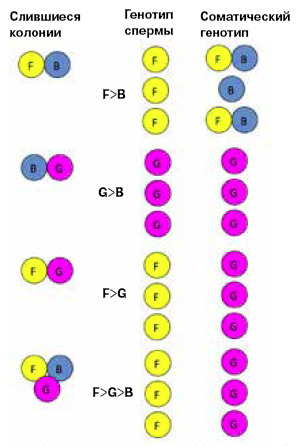
Феномен слияния зависит от единственного гена гистосовместимости, называемого BHF (Botryllus histocompatibility factor). У него около ста возможных вариантов (аллелей), а геном зооида может содержать только два, одинаковых или разных. Если у соседних колоний есть хотя бы один общий аллель BHF, их кровеносные системы объединятся, а если общих аллелей нет, образуется шрам. Вейсман подчеркивает, что иметь общие аллели и образовывать химерные колонии могут лишь родственные, генетически близкие особи.
Объединившиеся колонии обмениваются не только клетками крови, но и стволовыми клетками (СК), которые начинают конкурировать друг с другом за право образовать новые зооиды. Стволовые клетки делятся медленно, причем одна из двух дочерних клеток вступает на путь дифференцировки, и судьба ее предрешена, а другая остается точной копией материнской. Благодаря этому свойству, которое называется самообновлением, СК в отличие от специализированных клеток способны воспроизводить свою популяцию. СК делятся на клетки зародышевой линии, из которых образуются гаметы, и клетки сомы, дающие начало всем остальным тканям. Сотрудники Вейсмана исследовали сперму, клетки крови и другие ткани у нескольких долгоживущих (трехмесячных) химерных колоний, возникших в результате слияния двух соседних. Они наблюдали в этих химерах разные варианты конкуренции СК (рис. 2). СК зародышевой линии колонии F победили конкурентов G, поэтому все гаметы этой химеры образованы из клеток F и генетически идентичны, но их соматические СК обычно проигрывают. СК зародышевой линии F выигрывают также у В, но соматические СК обеих колоний «сыграли вничью» и сосуществуют с небольшим перевесом В, соматические ткани этой химеры образованы СК обеих колоний. Стволовые клетки G побеждают В и в зародышевой линии, и в соме. Исследователи позволили образоваться химере из трех этих колоний, и иерархия сохранилась: среди СК зародышевой линии вне конкуренции оказались клетки F, а среди соматических — G.
Исследователи также наблюдали несколько случаев, когда почкование в одной из колоний химеры прекращается и все ее зооиды погибают и рассасываются, при этом СК зародышевой линии погибшей колонии сохранились и производили гаметы в оставшейся колонии.
Тут, конечно, возникает вопрос: если соматические СК одной особи настолько хороши, что полностью вытесняют конкурентов и создают исключительное по качеству тело, то как гены, обеспечивающие приспособленность этого тела, передаются следующему поколению, если его гаметы имеют другой генотип? Исследователи проблему признают, но ответа пока не знают.
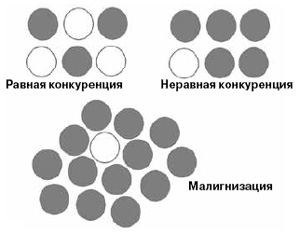
Стволовые клетки-суперконкуренты могли бы захватывать колонию за колонией, образуя поля оболочников с одинаковыми геномами. Такая ситуация чем-то сродни росту опухоли (рис. 3). К счастью, у оболочников есть ген гистосовместимости BHF , который блокирует проникновение СК в неродственные колонии и поддерживает генетическое разнообразие вида. У позвоночных отторжение чужеродных тканей обеспечивают гены главного комплекса гистосовместимости МНС. Но хотя МНС и BHF выполняют аналогичные функции, последовательности этих генов не сходны.
Следующим этапом в работе Вейсмана стало изучение конкуренции СК в организмах, стоящих на более высокой ступени эволюционной лестницы, которые не размножаются почкованием и не сливаются друг с другом, например в мышах и людях.
Конкуренция в организме
Чтобы исследовать конкуренцию СК зародышевой линии мышей, исследователи создали химеру, используя эмбриональные стволовые клетки из внутренней массы бластоцисты четырех разных мышей. На этой стадии эмбрион еще не переходит к формированию зародышевых листков. Клетки разных эмбрионов постоянно экспрессировали флуоресцентные белки красного, синего или зеленого цветов, что позволяло проследить за судьбой их потомков. Ученые ввели по 5 окрашенных эмбриональных клеток (всего 15) в неокрашенную бластоцисту четвертой мыши и имплантировали ее в матку пятой. Затем исследователи анализировали распределение цветных клеток в семенниках нескольких десятков родившихся мышей. Для исследования брали только таких животных, в коже и внутренних органах которых присутствовали клетки всех четырех цветов. Если где-то образуется большое количество соседствующих друг с другом клеток одного цвета, например зеленых, это значит, что все они — потомки одной клетки того же цвета.
Исследования показали, что семенники формируются всего из четырех стволовых клеток зародышевой линии. Поскольку их мало, в их число, как правило, не попадают клетки всех четырех цветов, обычно двух или трех. Эти клетки делятся, перемещаются и формируют зачатки гонад. На этом этапе популяция СК зародышевой линии состоит примерно из 4 тысяч клеток. Однако спустя 14–21 день после рождения большинство клеток каждого цвета подвергается апоптозу, а немногие оставшиеся формируют семенные канальцы. Анализ ДНК показал, что множество смежных семенных канальцев — потомки одной клетки.
Следовательно, среди СК зародышевой линии млекопитающих также имеет место конкуренция, и выдерживают ее немногие. Это напоминает ситуацию с оболочниками. Что именно приводит к массовой гибели СК зародышевой линии, исследователи пока не знают. По их мнению, в большинстве СК на определенном этапе формирования гонад происходят мутации, препятствующие образованию функциональной спермы. Ученые предполагают, что могло бы вызвать эти изменения, но гипотезу надо доказывать.
Конкуренцию СК сомы ученые исследовали на гемопоэтических (кроветворных) стволовых клетках, ГСК (рис. 4). Каждая ГСК теоретически может дать начало клеткам крови любого типа, практически же популяция ГСК неоднородна. Некоторые клетки (назовем их сбалансированными ГСК) образуют примерно в равных пропорциях миелоидные элементы (тромбоциты, эритроциты, гранулоциты, моноциты и макрофаги) и лимфоциты разных типов. Но есть клетки, активность которых смещена, и они производят преимущественно миелоидные клетки.

У молодых мышей и людей кроветворные органы заселяют преимущественно сбалансированные ГСК, а у старых особей обоих видов преобладают «миелоидные» ГСК. Экспериментальные данные, полученные в лаборатории Вейсмана, показали, что субпопуляции ГСК отличаются уровнем экспрессии клеточного рецептора Slamf1, который, в том числе, определяет способность клеток к самообновлению. Среди ГСК с «миелоидным» уклоном есть клетки с высоким уровнем экспрессии Slamf1 и потенциалом самообновления, со временем именно они начинают преобладать в пуле стволовых клеток, вытесняя «сбалансированную» популяцию (подробнее об этом см. Proceedings of the National Academy of Sciences, 2010, 107, 5465–5470, DOI:10.1073/pnas.1000834107).
Ирвинг Вейсман предполагает, что отбор в пользу миелоидных ГСК вызван изменением потребностей в разных типах иммунного ответа. Сбалансированные ГСК производят лимфоциты, вырабатывающие антитела против патогенов. Многие из них иммунная система «запоминает» и образует долгоживущую популяцию лимфоцитов, настроенных на производство определенного антитела. Иммунная система формировалась в те давние времена, когда люди и животные не носились по всему миру на самолетах и поездах, а проводили жизнь на относительно небольшой территории и встречались с ограниченным количеством патогенов. Достигнув второй половины жизни, они уже успели повстречаться с подавляющим большинством инфекций своей местности, поэтому их иммунная система все, что нужно, помнит. А необходимость в остром воспалительном ответе, реакции на проникновение паразита или чужеродное тело, которые осуществляют клетки миелоидного ряда, есть всегда, поэтому и происходит отбор миелоидных ГСК. Так это или нет, мы не знаем, но для нас сейчас важнее другое: в организмах позвоночных животных идет отбор наиболее конкурентоспособных стволовых клеток, и он может привести к медленной прогрессии здоровых клеток в раковые, например миелодиных ГСК в клетки миелоидного лейкоза.
Конкуренция со смертельным исходом
Естественный отбор стволовых клеток идет все время, пока жив их носитель. Если за это время в одной из клеток произойдет мутация или другое изменение, которое увеличит ее выживаемость и конкурентоспособность, ее потомки потеснят другие клетки. Таких изменений может произойти несколько, одно за другим, и самообновляющаяся стволовая клетка все их сохранит. Но эти мутации, накапливаясь, могут постепенно превратить нормальную СК в раковую. Когда Вейсман с сотрудниками исследовали экспрессию генов миелоидных ГСК, они обнаружили, что из 32 наиболее активно работающих генов 17 действовали как протоонкогены при остром миелоидном лейкозе. Протоонкоген — это ген, контролирующий деление клеток и способный в результате мутации превратиться в онкоген, продукт которого стимулирует образование злокачественной опухоли.
Миелоидный лейкоз — избыточное образование клеток миелоидного ряда: гранулоцитов и их предшественников. Болезнь может развиваться медленно и поначалу бессимптомно (хронический миелоидный лейкоз) или быстро (острый миелоидный лейкоз — одно из самых злокачественных миелоидных заболеваний). Острый миелоидный лейкоз обычно развивается после 50 лет, это болезнь пожилых людей. Исследователи проследили за тем, как изменяются ГСК при развитии миелодного лейкоза.
На ранних стадиях миелоидного лейкоза и при и других заболеваниях, связанных с активным делением клеток миелоидного ряда, существует пролиферативная фаза, во время которой в костном мозге накапливаются мутантные СК, постепенно вытесняющие нормальные клетки, но этот процесс еще не носит взрывного характера. На этой стадии ученые выделили у пациентов миелоидные ГСК, которые несут мутации, позволяющие им успешно конкурировать с нормальными ГСК и вытеснять их из популяции, но общее количество стволовых клеток при этом не увеличивается (это неравная конкуренция на рис. 3). Вейсману и его сотрудникам удалось проследить, как ГСК накапливают мутации. У больных миелоидным лейкозом они обнаружили ГСК с единственной мутацией (1), с двумя мутациями (1 + 2), с тремя (1 + 2 + 3). Большинство этих мутаций влияли на способность клеток дифференцироваться. Это наблюдение подтверждает предположение о том, что ГСК накапливают предраковые изменения и передают их как самообновляющимся потомкам, так и клеткам-предшественникам, вступившим на путь дифференцировки. На более поздних стадиях заболевания мутации происходят уже в клетках-предшественниках, среди них, как правило, и возникают лейкозные клоны. Обычно это мутации, вызывающие активную пролиферацию. Однако на этом раковая прогрессия не заканчивается.
Предраковые, в данном случае предлейкемические клетки несут мутации, которые толкают их на самоубийственный путь, ведущий к апоптозу. Программируемая клеточная гибель обычно сопровождает программируемым удалением мертвых, но еще не разрушенных клеток. Чтобы привлечь макрофагов, на которых лежит функция уничтожения, обреченные клетки экспрессируют специальный сигнал, который Вейсман назвал «ешь меня». В начале прогрессии опухоли наиболее конкурентоспособные клеточные клоны научились блокировать апоптоз, но сигнал «ешь меня» они по-прежнему испускают, поэтому ограничены в своей подвижности: вокруг них готовые наброситься макрофаги. Ирвинг Вейсман обнаружил, что способность перемещаться по организму, вызывая метастазы, обретают клетки с повышенным уровнем белка CD47 — сигналом «не ешь меня». Экспрессия этого гена усилена во всех наиболее злокачественных опухолях мыши и человека, в том числе и в лейкозах. Исследователи показали, что антитела к CD47, блокирующие передачу сигнала «не ешь меня» на рецептор SIRP макрофагов, приводят к тому, что макрофаги набрасываются на раковые клетки и поедают их. Эти антитела лечат человеческие опухоли, пересаженные иммунодефицитным мышам, и Вейсман сообщает о клинических испытаниях, которые проверяют возможность использования антител к CD47 для терапии рака.
Вейсман полагает, что злокачественная опухоль любой ткани развивается одинаково: сначала тканевые СК накапливают предраковые мутации (не случайно рак возникает лишь в тех тканях, где есть стволовые клетки), затем клетки обретают способность к нерегулируемой пролиферации. Общее количество и набор мутаций, приводящих клетку к раку, могут быть различными, но заканчивается все обретением сигнала «не ешь меня». А в основе лежит вполне мирный процесс: обычная для всех многоклеточных конкуренция между стволовыми клетками, естественный отбор, борьба за существование.












