Механическое чувство тромбоцита
Н. Л. Резник
«Химия и жизнь» №12, 2014
Тромбоцит на амбразуре
Один миллилитр человеческой крови содержит от 150 до 300 тысяч тромбоцитов, называемых иногда кровяными пластинками, — они плоские и безъядерные. Длина тромбоцита в самой протяженной его части составляет 1–4 мкм, толщина 0,5–0,75 мкм. В этом объеме помещаются митохондрии, гликоген, гранулы с биологически активными веществами и ионами кальция, ферменты, необходимые для жизнедеятельности самой клетки, а также молекулы актина и миозина, составляющие цитоскелет. Образуются тромбоциты в костном мозге, 5–11 дней циркулируют в крови и находят свой конец в печени, легких или селезенке.
Для чего на свете тромбоциты? Главным образом для того, чтобы образовывать тромб (рис. 1). Тромбообразование для них состоит из трех этапов: адгезии, активации и агрегации.

Формирование тромба в здоровом теле начинается с повреждения сосуда. При этом разрушается внутренняя оболочка, эндотелий, и тромбоциты контактируют с обнажившимся коллагеновым слоем сосудистой стенки: тромбоцит как бы прокатывается по ней. А на поверхности у него рецепторы, которые взаимодействуют с коллагеном и белком, покрывающим коллаген, — фактором фон Виллебранда (ФВ). Взаимодействие с ФВ позволяет тромбоцитам удержаться на коллагене, иначе их смыло бы потоком крови. Как только клетка прикрепилась к коллагену, она буквально распластывается на нем и активируется. Ее форма при этом меняется, и она уже не напоминает пластинку (см. рисунок в начале статьи). Активированный тромбоцит секретирует различные тромбоцитарные факторы — серотонин, АДФ и многие другие, — которые сужают просвет сосуда, привлекают к поврежденному участку следующие тромбоциты, стимулируют их активацию и агрегацию. В результате каждый активированный тромбоцит оказывается связан с поверхностью сосуда и/или с другими тромбоцитами. Вместе они затыкают сузившийся просвет.

Одновременно в месте повреждения кровеносного сосуда и агрегации тромбоцитов протекает каскад реакций коагуляции. Его также запускают обнажившаяся соединительная ткань и тканевой фактор, который выделяют клетки поврежденного эндотелия. В этом каскаде участвуют белки (факторы коагуляции), присутствующие в плазме крови в неактивной форме. Активируясь, каждый фактор служит для активации следующего. Тромбоциты также участвуют в этом процессе, молекулы на их поверхности необходимы для многих реакций коагуляции. В результате череды реакций из неактивного белка протромбина образуется протеаза тромбин и превращает растворимый белок фибриноген в фибрин. Образование фибрина и есть цель каскада коагуляции. Мономеры фибрина полимеризуются, формируя нерастворимые нити, которые складываются в сеть сложной структуры. Фибриновая сеть удерживает тромбоциты и укрепляет тромб. Эритроциты тоже запутываются в ней, поэтому тромб красный.
Но это мы немного вперед забежали. Вернемся к тому моменту, когда тромбоциты только начали агрегацию. Чтобы соединение между ними получилось прочным, необходимы два белка: интегрин и уже знакомый нам фибриноген (рис. 2).
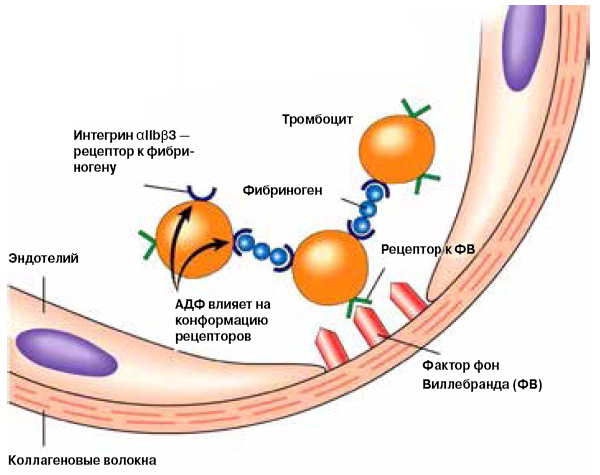
Интегрины находятся на поверхности тромбоцита и обеспечивают взаимодействие клеток со средой, то есть передачу внешних сигналов в клетку и информации из ее глубин наружу. Фактически интегрины — это рецепторы, которые связываются с различными сигнальными молекулами. Самый распространенный интегрин тромбоцитов, αIIbβ3, обеспечивает их связь с фибриногеном. Соединяясь с интегрином, мономеры фибриногена сшивают тромбоциты в плотный сгусток, который может разрушить только фермент плазмин. Кроме того, фибриноген, взаимодействуя с интегрином, выступает в роли сигнала активации.
Фибриногеновая спайка обеспечивает не только прочность тромба, но и его сжимаемость. Через несколько часов после образования сгустка актиновые и миозиновые тяжи тромбоцита сокращаются, и клетка сжимается. А поскольку тромбоциты соединены друг с другом, а также с внеклеточным фибрином, сжимается весь тромб и стягивает края раны. Потом происходит восстановление поврежденного участка, и тромб рассасывается.
Тромбоцит садится на ощупь
Каскад коагуляции и образование тромба описаны тут в общих чертах. Желающий узнать подробности найдет их в учебнике, биохимические сигналы, управляющие поведением тромбоцитов, хорошо изучены. Однако на тромбоциты действуют и механические силы: ток крови, контакты с полимеризованным фибрином и соседями по тромбу. И поскольку структура и механические свойства тромба весьма неоднородны, способность их ощущать была бы полезна кровяным пластинкам.
Гипотезу о механочувствительности тромбоцитов проверяли специалисты Университета Эмори и Технологического института Джорджии, Атланта, США, под руководством доктора медицины Уилбура Лэма (Proceedings of the National Academy of Sciences, 2014, 111, 14430–14435; DOI:10.1073/pnas.1322917111). Исследователи изготовили полиакриламидные гели разной жесткости (от 0,25 до 100 кПа), а сверху нанесли на них фибриноген в одинаковой концентрации. Таким образом, плотность молекул, которые связывают и активируют тромбоциты, во всех случаях оставалась постоянной, менялась только жесткость биохимически инертной полиакриламидной подложки.
Кусочки геля в течение двух часов инкубировали в суспензии тромбоцитов, полученных от здоровых людей, а затем определяли, сколько клеток прикрепилось к подложке (рис. 3). Количество тромбоцитов, заякорившихся на поверхности геля, росло с увеличением его жесткости и при 50 кПа достигало максимума — 10 тысяч клеток на квадратный миллиметр. При дальнейшем увеличении жесткости количество прикрепленных клеток не изменялось. Зависимость адгезии от жесткости геля сохраняется и в потоке жидкости.

Как мы помним, прикрепившись к поверхности, тромбоцит прижимается к ней. Средняя площадь распластанной клетки также растет с увеличением жесткости геля и максимальна при 50 кПа — около 23 квадратных микрометров.
Очевидно, тромбоциты реагируют на жесткость поверхности, с которой контактируют. Но оставалось непонятным, как они это делают. Обычно механическое чувство клеток обеспечивают различные элементы, связанные с ядром. Однако у тромбоцитов нет ядра и цитоскелет устроен значительно проще, чем у других клеток, следовательно и ощущать они ничего не могут.
Логично предположить, что, если механическое чувство у тромбоцитов есть, его обеспечивают те же факторы, которые принимают участие в адгезии и активации. Ученые использовали ингибиторы, избирательно блокирующие действие этих факторов, и наблюдали, влияют ли они на зависимость адгезии тромбоцитов и распластанности клеток от жесткости геля. После сложных экспериментов исследователи предложили механизм механочувствительности тромбоцитов (рис. 4).

Ее обеспечивает интегрин αIIbβ3, взаимодействующий с фибриногеном. Когда тромбоцит контактирует с подложкой, он касается ее интегрином, который можно уподобить шасси самолета. При посадке на мягкий субстрат клетка испытывает небольшое сопротивление, и интегрин переходит в низкоаффинное состояние, то есть выполняет функции рецептора довольно вяло и вызывает относительно низкую активацию и адгезию тромбоцитов. Удар о более жесткую подложку включает интегрин на полную мощность. Белок передает полученный извне сигнал внутрь клетки, где его принимает фактор Rac1. У него много функций: он управляет секрецией тромбоцитарных факторов и стимулирует белок Rap1b, который также активирует интегрин, однако не снаружи, а изнутри. А еще Rac1 регулирует образование актиномиозиновых тяжей тромбоцита, и они, сокращаясь, обеспечивают распластывание клетки на подложке. Распластывание, между прочим, важный этап активации: только в этом состоянии тромбоциты экспонируют на поверхности мембраны фосфатидилсерин, участвующий в каскаде коагуляции. Кроме того, именно сокращение актомиозина обеспечивает изменение формы активированных тромбоцитов.
Итак, связка «интегрин — Rac1 — Rap1b» образует механочувствительное устройство, которое включается при жесткой посадке, вызывает дальнейшую активацию тромбоцитов, их необратимую агрегацию и образование тромбов.
Не следует, однако, впадать в крайность, полагая, что на адгезию и активацию тромбоцитов влияет исключительно жесткость субстрата. Концентрация фибриногена на нем тоже имеет значение. Исследователи показали, что тромбоциты лучше прикрепляются к поверхности с более низкой концентрацией фибриногена. Они объясняют это тем, что молекулы фибриногена, свободно распределенные по стеклу, открывают интегрину больше сайтов связывания. А если белка на таком же стекле слишком много, его молекулы ориентированы вертикально и открывают лишь часть сайтов связывания. Следовательно, агрегация тромбоцитов наиболее эффективна, когда сайтов связывания с интегрином на подложке больше, а сама она жестче.
Исследования механочувствительности тромбоцитов интересны еще и тем, что позволяют предвидеть скорость их адгезии на поверхности разной жесткости. Дело в том, что фибриноген оседает не только на коллагене поврежденной сосудистой стенки, но и на атеросклеротической бляшке, а также на искусственных поверхностях, включая медицинское оборудование: искусственные сосуды, имплантаты и катетеры. А интегрин αIIbβ3 связывается с фибриногеном даже в том случае, когда тромбоцит не активирован. Поэтому на разрушающихся бляшках и биоматериалах образуются кровяные сгустки, создающие массу проблем пациентам и медикам. Несколько изменив жесткость материала, теоретически можно ослабить интенсивность адгезии и агрегации тромбоцитов. Но это дело будущего.














