Туннельные нанотрубки микроглии

На видео — нейрон (в левой нижней части) в окружении нескольких клеток микроглии. Подвижная микроглиальная клетка в центре как будто вытягивает из нейронального отростка тонкую нить. Эта нить представляет собой так называемую туннельную (или мембранную) нанотрубку (см. Tunneling nanotube, or membrane nanotube) — длинный мембранный отросток, который может соединять отдаленные клетки. Посредством такой трубки микроглия напрямую соединяется с нейронами и может выводить из них токсичные белки. На черно-белой части видео красной стрелкой показан перенос по нанотрубке черных крупиц — белка альфа-синуклеина (см. Alpha-synuclein). Ученые предполагают, что этот механизм играет роль в смягчении прогрессирования нейродегенеративных заболеваний.
Туннельные нанотрубки были открыты только 20 лет назад, поэтому вопросов пока гораздо больше, чем ответов. Сейчас активно изучаются механизмы, лежащие в основе переноса альфа-синуклеина и митохондрий между нейронами и микроглией.
Микроглия (см. картинку дня Микроглия через конфокальный микроскоп) относится к глиальным клеткам и имеет важное значение для поддержания здоровья мозга и функции нейронов. Она может очищать нейроны от внеклеточных белковых агрегатов (см. Protein aggregation), то есть неправильно свернутых белков, в том числе патологического альфа-синуклеина. Накопление белковых агрегатов, которые слипаются друг с другом, — отличительная черта нескольких нейродегенеративных расстройств, таких как болезнь Альцгеймера, лобно-височная деменция (см. Frontotemporal dementia) и болезнь Паркинсона. Альфа-синуклеин агрегирует при болезни Паркинсона и нарушает функцию нейронов. Агрегаты этого белка передаются от клетки к клетке и вызывают неправильное сворачивание белков в соседних нейронах, тем самым распространяя повреждение нейронов.
Микроглия обычно сталкивается с патологическими белками только после гибели нейронов, что является началом нейродегенеративных процессов. Однако микроглия способна поглощать не только внешние агрегаты, высвобождающиеся после гибели нейронов, но и агрегаты, находящиеся внутри нейронов, — как раз посредством туннельных нанотрубок.
Туннельные нанотрубки используются для коммуникации между различными клетками. Они представляют собой трубчатые каналы, богатые белком актином (см. картинку дня Раскрашенный цитоскелет). Обычно это тонкие мембранные выступы толщиной 20–700 нм, причем их толщина может варьировать даже в пределах одного типа клеток. Были предложены два основных механизма образования нанотрубок. Первый основан на способности клеток образовывать выступы, содержащие актин. Такой выступ может затем удлиняться путем полимеризации актина в направлении целевой клетки, а его кончик — вступать в физический контакт с ней. Как только кончик выступа устанавливает физический контакт с целевой клеткой, мембраны двух клеток сливаются. Это происходит благодаря специальным белкам, которые способны вызывать нарушение основы мембраны клетки — бислоя — и кривизну мембраны.
Второй предложенный механизм образования нанотрубок основан на смещении клеток. Когда две клетки вступают в контакт, они могут слиться. Затем их смещение в противоположных направлениях вытягивает нанотрубку, которая может происходить либо только из одной, либо из обеих вовлеченных клеток. И здесь тоже важную роль играет актин: предполагается, что именно он влияет на стабилизацию возникающей нанотрубки. Эту модель иллюстрирует заглавное изображение: мы отчетливо видим подвижную микроглиальную клетку, которая сначала вступает в контакт с неподвижным нейроном, а затем смещается вправо, вытягивая туннельную нанотрубку. Предполагается, что это основной механизм образования такого типа контактов в различных типах клеток. Механизм же, основанный на образовании выступов, типичен для относительно неподвижных клеток (например, нейронов и эпителиальных клеток). Время образования нанотрубок вне зависимости от способа их образования измеряется несколькими минутами, а продолжительность их жизни может достигать нескольких часов.
Межклеточная коммуникация обеспечивает возникновение сложного поведения, вызванного скоординированным взаимодействием отдельных клеток. Например, соседние клетки практически всех тканей могут «общаться» друг с другом через щелевые контакты, представляющие собой каналообразующие соединения, которые создают проходы, связывающие цитоплазму соседних клеток (см. статью Универсальна ли связь «в контакте» среди клеток животных?). Они позволяют неорганическим ионам и небольшим водорастворимым молекулам переходить из цитоплазмы одной клетки в другую.
Туннельные нанотрубки тоже представляют собой механизм межклеточной коммуникации, который встречается в самых разных типах клеток. Однако, в отличие от щелевых контактов, эти структуры могут напрямую соединять клетки даже на большом расстоянии (иногда даже более 100 мкм). То есть уникальность такого механизма коммуникации заключается в том, что он позволяет осуществлять прямую транспортировку различных белков и органелл, а также вирусов и бактерий между отдаленными клетками. Канал соединяет две клетки, обеспечивая непрерывность их цитоплазмы. Например, раковые клетки могут посредством нанотрубок соединяться с иммунными клетками и забирать из них митохондрии — специальные энергетические компоненты клеток. Это усиливает раковые клетки и истощает иммунные. Исследования in vitro и in vivo показывают, что туннельные микротрубки могут участвовать в самых разнообразных процессах, таких как дифференциация стволовых клеток, регенерация тканей, иммунный ответ и нейродегенеративные заболевания.

Одна нанотрубка может соединять одну клетку сразу с несколькими другими. Слева — раковая клетка (4T1) с помощью одной нанотрубки соединяется с двумя T-клетками (желтые стрелки). Длина масштабного отрезка — 10 мкм. В центре — увеличенное изображение, показывающее взаимодействие между нанотрубкой и T-клетками. Справа — желтые стрелки показывают отростки нанотрубки, сливающиеся с Т-клеткой. Изображение из статьи T. Saha et al., 2022. Intercellular nanotubes mediate mitochondrial trafficking between cancer and immune cells
Чтобы продемонстрировать туннельные нанотрубки, ученые использовали культуры нейронов и микроглии и передовую технологию визуализации. Они наблюдали, что накопление агрегатов альфа-синуклеина приводило к увеличению количества трубок, соединяющих нейроны и микроглию, а длина таких трубок обычно составляла 5–10 мкм. Интересно, что патологические белки переносились из нейронов в микроглию, но не наоборот. Кроме того, нейроны сами по себе не могли расщеплять белковые агрегаты, однако альфа-синуклеин, полученный из нейронов, деградировал в микроглии с течением времени.
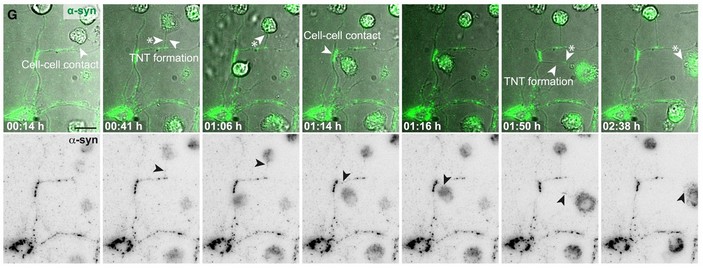
Перенос альфа-синуклеина из нейронов в микроглию через туннельные нанотрубки (кадры видео). На первом кадре показан контакт нейронального отростка с микроглией, затем — возникновение туннельной нанотрубки. С увеличением времени количество трубок увеличивалось. На нижней панели показан перенос альфа-синуклеина (черный). Длина масштабного отрезка — 20 мкм. Изображение из статьи H. Scheiblich et al., 2024. Microglia rescue neurons from aggregate-induced neuronal dysfunction and death through tunneling nanotubes
Альфа-синуклеин может вызывать дисфункцию митохондрий, которая приводит к дефициту энергии, повышенному окислительному стрессу, нарушению регуляции кальция и нарушению сигнальных путей, что способствует повреждению клеток и их смерти. Известно, что туннельные нанотрубки необходимы для транспортировки митохондрий. Оказалось, что микроглия может отдавать с их помощью здоровые митохондрии нейронам, нагруженным белковыми агрегатами, что значительно снижает окислительный стресс, восстанавливает жизненно важные функции и в конечном итоге спасает эти нервные клетки без ущерба для самой микроглии.
Что же происходит с туннельными нанотрубками при нейродегенеративных заболеваниях? Ученые проверили, влияют ли генетические мутации, связанные с этими заболеваниями, на формирование и функции нанотрубок. Мутации в гене обогащенной лейциновыми повторами киназы 2 (LRRK2) приводят к развитию болезни Паркинсона. Клетки микроглии, несущие такую мутацию, переносят меньше агрегатов альфа-синуклеина от нейронов, но при этом доставляют больше митохондрий к нейронам, однако это не приводит к снижению окислительного стресса. Ученые предположили, что митохондрии из мутантной микроглии обеспечивают меньшую метаболическую поддержку и защиту нейронов, чем митохондрии из микроглии, не подверженной мутациям.
Изображение из статьи H. Scheiblich et al., 2024. Microglia rescue neurons from aggregate-induced neuronal dysfunction and death through tunneling nanotubes.
Екатерина Ларионова
-
И что? Я тоже так умею, на даче: взял шланг, напялил один конец на кран, второй отнес к нужной грядке... И ничего сложного!
Что все так восхищаются этими какими-то микроглиями?
А я вот, ещё и на швейной машинке умею!
Как тебе такое, микроглия, а?
))
А если без шуток - так это абсолютное чудо по-моему. Естественным образом из ничего возникшее при том -
"Туннельные нанотрубки были открыты только 20 лет назад"
Вы категорически неправы. Межклеточные мостики, по которым возможен переход нуклеиновых кислот между клетками, были обнаружены ещё в 60-х годах в Москве в Институте экспериментальной и клинической онкологии группой Свет-Молдавского, о чём есть публикации не только в отечественных журналах и сборниках того времени, но и публикация в зарубежном авторитетном журнале Lancet за 1968 год, с доступным через интернет полным текстом с фотографиями межклеточных мостиков: https://sci-hub.ru/10.1016/s0140-6736(68)90290-0 , а ссылка в пабмеде: https://pubmed.ncbi.nlm.nih.gov/4171534/ У нас прекрасно помнили об этих работах группы Свет-Молдавского по межклеточным мостикам и периодически упоминали о них, например, Бабаева в своих работах по адоптивному переносу информации лимфоцитами. Иностранцы "переоткрыли" межклеточные мостики и назвали "туннельные нанотрубки", что Вы и повторяете, хотя приоритет однозначно за Свет-Молдавским.
Последние новости






















Пример образования туннельной нанотрубки на основе имеющихся выступов между клетками PC12. A–D — стадии образования нанотрубки. На изображении B белой стрелкой показан выступ, который, удлиняясь, контактирует с соседней клеткой (C), а на изображении D белая стрелка указывает на образовавшуюся туннельную нанотрубку. Длина масштабного отрезка — 20 мкм. Изображение из статьи A. Rustom et al., 2004. Nanotubular highways for intercellular organelle transport