Карманная лаборатория для новых лекарств
Алиса Розенфельд
«Природа» №10, 2019
Романтики с восхищением смотрят на звездное небо, ученые, разрабатывающие новые лекарства, черпают вдохновение в химическом пространстве, которое населяют миллиарды и миллиарды самых разных химических веществ. И подобно тому, как звезды объединяются в галактики, ученые группируют химические вещества в так называемые комбинаторные библиотеки. Когда приходит время для поиска нового лекарства, тысячи, а то и миллионы веществ из одной библиотеки сначала тестируют на клетках в надежде, что будет найден достойный кандидат для доклинических (на животных) испытаний, а затем и клинических (на людях). В предварительных экспериментах используются разные виды клеток — раковые, стволовые или, например, клетки почек. Чтобы клетки чувствовали себя хорошо, их помещают в питательную среду и растят в атмосфере углекислого газа и практически стопроцентной влажности в специальных инкубаторах.
В отличие от Александра Флеминга (1881–1955), открывшего пенициллин по счастливой случайности, современные исследователи пользуются в процессе создания новых лекарств достижениями робототехники и информатики. Молекулярное моделирование помогает отсеять совсем бесперспективные вещества еще до начала эксперимента, а роботы выполняют за ученых многие рутинные задачи. Новые лаборатории буквально напичканы компьютерами и лабораторными киборгами. Но какому ученому не хотелось бы иметь настолько маленькую лабораторию, чтобы она помещалась в карман, да еще и проводить по тысяче экспериментов за раз?
Прототип такой миниатюрной высокопроизводительной лаборатории сделали сотрудники Института токсикологии и генетики (Institute of Toxicology and Genetics, ITG), входящего в состав Технологического института Карлсруэ (Karlsruhe Institute of Technology, KIT). В Северном кампусе этого института раньше проводили регенерацию ядерного топлива, а сейчас у окошка с видом на захоронение 60 тыс. тонн мало- и среднерадиоактивных ядерных отходов живет моя кофейная чашка, ободряющая в суровые аспирантские будни. Я работаю в группе функциональных и «умных» материалов, которой руководит московский химик Павел Левкин1. Именно в этой группе придумали, как превратить обычную стеклянную пластинку (слайд) в целую лабораторию для исследования стволовых и обычных клеток, при этом находить новые лекарства.
Исследование стволовых клеток — полоса препятствий
Стволовые клетки — настоящие маги-оборотни. Они могут превращаться (дифференцироваться) в практически любую клетку нашего организма, например в клетку сердца или в нервную клетку. Эта способность называется плюрипотентностью. В то время как обычная клетка просто умирает от старости или повреждений, стволовые клетки могут самообновляться и размножаться. Именно плюрипотентность и самообновление отличает стволовые клетки от остальных клеток и делает их уникальным объектом для исследований. Недаром за создание первых индуцированных плюрипотентных стволовых клеток в 2012 г. была присуждена Нобелевская премия по физиологии или медицине2, а самая крупная в мире биомедицинская организация — Национальные институты здравоохранения США (National Institutes of Health, NIH) — щедро финансирует исследования, связанные со стволовыми клетками. Так, в 2018 г. было выделено более 1,8 млрд долларов, а в 2019 г. NIH планирует потратить более 1,9 млрд, т.е. примерно столько же, сколько тратится на изучение ишемической болезни сердца, рака молочной железы и атеросклероза вместе взятых3.
Сохранить характерные для стволовых клеток свойства (способность к самообновлению и генерации) в лабораторных условиях сложно, потому что пока неизвестны все факторы, которые влияют на превращение стволовых клеток в обычные [1]. Как только стволовая клетка дифференцировалась, она перестает быть стволовой. Получившиеся клетки можно использовать в регенеративной медицине и тканевой инженерии, но их уникальные качества, называемые в англоязычной литературе stemness (буквально — ‘стволовость’), уже утрачены.
Чтобы узнать, в каких условиях «стволовость» сохраняется дольше всего, ученые добавляют к стволовым клеткам всевозможные вещества и смотрят, сохранили ли клетки это свойство или превратились в другие клетки. Чтобы как можно быстрее получить точные данные, сотни таких экспериментов проводят одновременно. Такое серийное тестирование веществ из библиотек химических соединений называется высокопроизводительным скринингом (англ. high-throughput screening). С этой целью во многих лабораториях мира используют микротитрационные планшеты, которые представляют собой прямоугольные пластиковые плашки с большим количеством углублений, где и хранят стволовые клетки и куда потом добавляют тестируемые вещества. Количество таких микропробирок обычно не превышает 1536 — столько веществ или их комбинаций можно за раз опробовать на клетках. Чтобы не заполнять многие сотни микропробирок самостоятельно, ученые используют роботов, которые с помощью пипетки переносят нужное количество исследуемых веществ в соответствующее углубление планшета.
Однако эта работа очень кропотливая и занимает много времени даже у самого дорогого и современного робота. Кроме того, хотя углубления в планшете довольно малы (но не меньше 40 мкл, т.е. 40 миллионных долей литра), в каждом эксперименте расходуется большое количество дорогих стволовых клеток, не говоря уж о необходимости использования сложной и дорогостоящей робототехники. Это тормозит работу многих исследовательских лабораторий.
Спонтанные капли для выращивания клеток
Как же уменьшить количество используемых стволовых клеток и исключить из уравнения дорогого и медленного робота? Для этого перенесемся обратно в Германию. Представьте, что мы едем по скоростному немецкому автобану ко мне на работу в Северный кампус. С самого утра моросит дождь — типичная немецкая осень. К лобовому стеклу прилипают капли. В какой-то момент две маленькие капли обнимаются и начинают лениво стекать вниз, подминая под себя другие капли и становясь все больше и больше. Можно делать ставки, какая лужица быстрее доберется до дворников.
А теперь попробуем мысленно прокрутить этот процесс в обратную сторону. Берем лужицу (большую материнскую каплю) и тащим ее по стеклу, а она оставляет за собой след в виде одинаковых капель до тех пор, пока не закончится. Конечно, с обычным автомобильным стеклом такое не получится — лужица будет размазываться, менять свою форму, вытягиваться, но так и не станет рассаживать капли по нужным нам местам. Что же делать?
Павел Левкин и аспиранты (чьи кофейные чашки смотрели на ядерное захоронение задолго до моей) придумали такое покрытие для стекла, которое позволяет из одной большой материнской капли делать тысячи упорядоченных маленьких (до 3 нл — трех миллиардных долей литра!) капель одним движением руки [2, 3].
Это полимерное покрытие состоит из участков, задерживающих капли воды (гидрофильных регионов), и участков, которые воду отталкивают (гидрофобных регионов). Участки чередуются друг с другом, образуя нужный шаблон [4]. Таким образом, если мы тянем материнскую каплю через все покрытие, она оставляет маленькие дочерние капельки только на гидрофильных участках, в то время как гидрофобные участки ее отпугивают4.

Этот спонтанный процесс называется прерываемым каплеобразованием, а слайд с гидрофильно-гидрофобным полимерным покрытием — DMA-слайдом (от англ. Droplet Microarray Platform — ‘капельная микрочиповая платформа’).
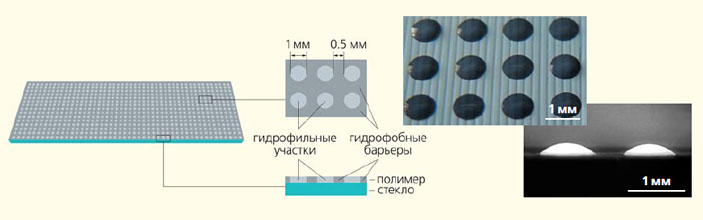
Схема и микрофотографии распределения гидрофильных и гидрофобных участков на DMA-слайде [4]
Зачем нам нужны эти капли? Биологи в нашей группе используют их взамен углублений в микротитрационных планшетах [2, 3]. Классически мы бы заполнили чашку Петри или микропланшеты питательной средой вместе с клетками и поместили их в инкубатор. Однако, чтобы заполнить углубления в планшетах, нужно большое количество клеток. Вместо этого мы набираем в пипетку немного питательной среды вместе с клетками, делаем материнскую каплю на DMA-слайде и катим ее через всю полимерную поверхность. В течение пары минут мы получаем до 4563 капель объемом в 3 нл каждая, и в каждой можно проводить отдельный эксперимент вместо того, чтобы для каждого отдельного эксперимента капать в углубления микротитрационного планшета или напрягать для этих целей робота. Таким образом можно сэкономить большое количество клеток и не привлекать дорогостоящее оборудование: DMA-слайд с 4563 гидрофильными участками в 15 тыс. раз экономнее, чем стандартные микротитрационные планшеты с 384 углублениями. Этот эффект достигается за счет радикального уменьшения объема используемой питательной среды с клетками. Другими словами, если изготовить DMA-слайд размером с микротитрационный планшет, то один DMA-слайд заменит около 75 планшетов.
Скрининг на раз-два
Теперь исследовать влияние различных веществ на сохранение или потерю стволовыми клетками своих уникальных качеств гораздо проще. Необходимо нанести на гидрофильные регионы DMA-слайда нужные вещества, а затем провести по слайду материнской каплей, содержащей стволовые клетки, которые затем распределятся по гидрофильным регионам. По тому, дифференцировались ли стволовые клетки после взаимодействия с веществами или нет, можно судить о сохранении «стволовости». Аспиранты в нашей группе также показали, что сам DMA-cлайд поддерживает «стволовость» клеток за счет особой шероховатой структуры полимера, выгодно отличаясь от гладких микротитрационных планшетов [1, 5].
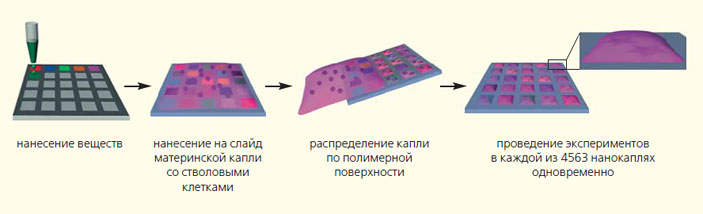
Схема эксперимента взаимодействия разных веществ и стволовых клеток [5]
Другие виды клеток (например, раковые клетки шейки матки, клетки почек человеческого эмбриона или клетки аденокарциномы) тоже можно культивировать на DMA-слайдах [3]. Таким образом можно сканировать огромные библиотеки веществ и определять их взаимодействие с разными видами клеток. Цель подобных экспериментов — выявление тенденций в жизнеспособности клеток в зависимости от химической структуры молекул, предварительно нанесенных на слайд. Чтобы определить, остались ли клетки живыми после контакта с веществом, или вещество оказалось для них токсичным, клетки необходимо окрасить. Классически для этого используют смесь йодистого пропидия и ацетометоксикальцеина. Ацетометоксикальцеин проникает через мембрану живых клеток и расщепляется ферментом эстеразой, образуя кальцеин. Благодаря зеленой флуоресценции (свечению) кальцеин можно увидеть под флуоресцентным микроскопом. Йодистый пропидий, напротив, не может проникнуть через мембрану живых клеток. Если клетка погибла, то ее мембрана разрушается, пропидий попадает внутрь мертвой клетки и внедряется в ее ДНК. Красная флуоресценция йодистого пропидия указывает на то, что клетка мертва.
Чтобы одновременно добавить красящие реагенты ко всем клеткам в каплях, используют второй DMA-cлайд, на который с помощью прерываемого каплеобразования мы наносим окрашивающую смесь [4]. Этот слайд потом совмещается со слайдом с клетками — мы в лаборатории называем этот процесс сэндвичингом (от англ. sandwich). Окрашенные таким образом клетки можно выявить на микрофотографиях. Так как добавление окрашивающей смеси происходит одновременно во все капли, использование двух DMA-слайдов позволяет окрашивать все клетки параллельно и таким образом экономить время. Расход окрашивающей смеси также значительно уменьшается по сравнению с микротитрационными планшетами.
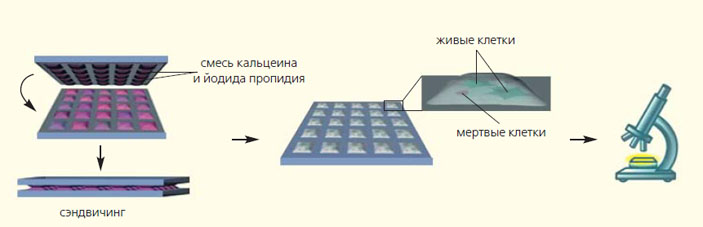
Процесс сэндвичинга — параллельного добавления красящих реагентов к клеткам [5]
Новые лекарства и точная диагностика
Реакция клеток на различные вещества очень важна в процессе создания новых лекарств. За счет низкой стоимости производства DMA-слайдов и тысячекратного уменьшения количества клеток и других расходных материалов эксперименты можно повторять большее число раз для более точной статистики. В крупных фармацевтических компаниях сканируют до 100 тыс. химических соединений в день [6], и новая технология может значительно ускорить появление новых лекарственных средств. Дочерняя компания нашей группы AquArray недавно выиграла грант от Федерального министерства экономики и технологии (Германия) и теперь занимается выведением DMA-технологии на рынок.
В будущем DMA-слайды можно будет использовать в персонализированной диагностике и терапии различных заболеваний, особенно онкологических. Практикующие врачи нередко сталкиваются с трудностями подбора химиотерапии для пациентов, так как разные опухоли индивидуально и иногда непредсказуемо реагируют на противораковые препараты. В этом случае выделенные при биопсии раковые клетки можно исследовать на DMA-слайде, на который нанесены химиотерапевтические препараты, и быстро определить, на какой из препаратов опухоль отреагирует наилучшим образом. В результате подбора правильной и эффективной терапии у пациента повысятся шансы на успех.
Кроме того, из злокачественных новообразований порой удается выделить лишь небольшое количество раковых стволовых клеток, которые могут вызвать метастазирование и возвращение болезни. Поскольку для исследования на DMA-слайде нужно совсем немного биоматериала и времени, то эта технология позволит быстро скорректировать курс лечения и сохранить жизнь многим раковым больным или повысить качество их жизни.
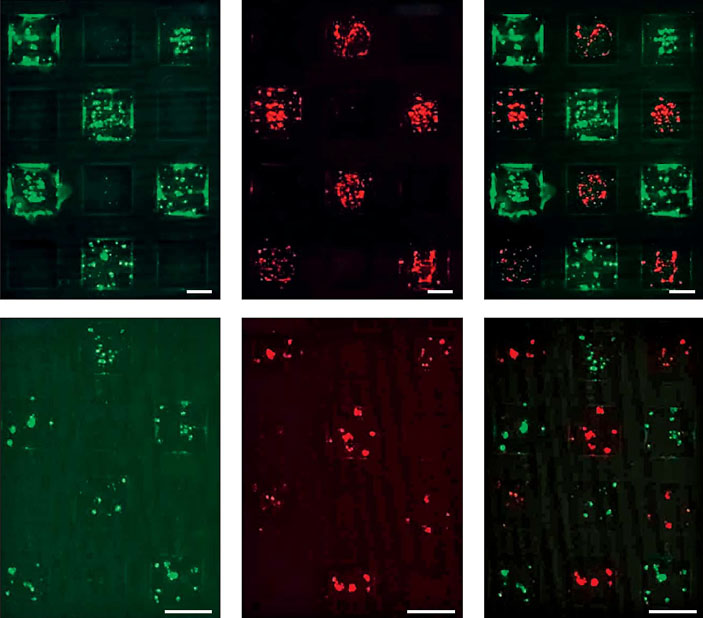
Микрофотографии DMA-слайдов с эмбриональными клетками почки человека (HEK293) [3]. Красным светятся клетки, которые производят белок RFP, зеленым — белок GFP. На одном DMA-слайде можно одновременно культивировать несколько типов клеток (каждой клетке — свой гидрофильный участок). Например, в шахматном порядке расположить GFP- и RFP-положительные клетки (справа). Благодаря гидрофобному барьеру между гидрофильными участками не происходит смешивания двух типов клеток, и каждый тип остается на своем участке. Размер масштабной линейки — 100 мкм, ячеек DMA-слайдов в верхнем ряду — 1000 мкм, в нижнем — 500 мкм
Кроме распечатывания уже готовых химических библиотек на гидрофильные участки в нашей группе ведутся активные разработки методов, позволяющих синтезировать новые химические вещества прямо на DMA-чипе. Каждый гидрофильный участок выступает как микроколба, и таких микроколб на одном чипе может быть несколько сотен. Гидрофобные барьеры, окружающие гидрофильные участки, не дают растворителю из одной реакции смешаться с растворителем из другой, разделяя реакции в пространстве, как если бы в лаборатории мы бы провели несколько реакций в разных колбах. При этом мы уже освоили два принципиально разных способа проведения реакций. В жидкофазном синтезе все реагенты находятся в жидкой фазе микрокапли. В твердофазном синтезе мы используем полимер, находящийся на стекле DMA-чипа, как твердую фазу.
Таким образом, на DMA-чипе сначала производится химический синтез, а затем после выделения и очистки веществ можно высеивать клетки и смотреть, как они взаимодействуют с свежесинтезированными веществами. За счет миниатюризации химического синтеза и биологического скрининга мы экономим большое количество реагентов, растворителей и клеточной питательной среды, а из-за объединения химического и биологического этапов на одном и том же чипе мы избавляемся от необходимости переноса химической библиотеки в плашки, как это сейчас традиционно делается в фармацевтической промышленности. Результаты этих исследований недавно опубликованы в Nature Communications и в Materials Today Bio [7, 8].
***
Почти сто лет назад счастливый случай подарил нам пенициллин, а сегодня открытие нового лекарства — динамичный, развивающийся, относительно управляемый, пусть и очень трудоемкий процесс. Миниатюризация и упрощение протоколов исследования не оставят его без изменений. Возможно, когда-то всю вселенную химических веществ удастся поместить на ладони.
Литература
1. Tronser T., Popova A. A., Levkin P. A. Miniaturized platform for high-throughput screening of stem cells // Current Opinion in Biotechnology. 2017; 46: 141–149. DOI: 10.1016/j.copbio.2017.03.005.
2. Popova A. A., Depew C., Permana K. M. et al. Evaluation of the droplet-microarray platform for high-throughput screening of suspension cells // SLAS Technology: Translating Life Sciences Innovation. 2017; 22(2): 163–175. DOI: 10.1177/2211068216677204.
3. Popova A. A., Demir K., Hartanto T. G. et al. Droplet-microarray on superhydrophobic—superhydrophilic patterns for high-throughput live cell screenings // RSC Adv. 2016; 6: 38263–38276. DOI: 10.1039/C6RA06011K.
4. Popova A. A., Schillo S. M., Demir K. et al. Droplet-Array (DA) sandwich chip: a versatile platform for high-throughput cell screening based on superhydrophobic-superhydrophilic micropatterning // Adv. Mater. 2015; 27(35): 5217–5222. DOI: 10.1002/adma.201502115.
5. Jaggy M., Zhang P., Greiner A. M. et al. Hierarchical micro-nano surface topography promotes long-term maintenance of undifferentiated mouse embryonic stem cells // Nano Lett. 2015; 15(10): 7146–7154. DOI: 10.1021/acs.nanolett.5b03359.
6. Smith A. Screening for drug discovery: the leading question // Nature. 2002; 418: 453–459. DOI: 10.1038/418453a.
7. Benz M., Molla M. R., Böser A., Rosenfeld A., Levkin P. A. Marrying chemistry with biology by combining on-chip solution-based combinatorial synthesis and cellular screening // Nature Communications. 2019; 10: 2879. DOI: 10.1038/s41467-019-10685-0.
8. Rosenfeld A., Brehm M., Welle A. et al. Solid-phase combinatorial synthesis using microarrays of microcompartments with light-induced on-chip cell screening // Materials Today Bio. 2019; 3: 100022. DOI: 10.1016/j.mtbio.2019.100022.
1 Levkin research group of biofunctional materials.
2 Подробнее см.: Шутова М. В., Киселев С. Л. Нобелевская премия по физиологии или медицине 2012 года — Д. Гёрдон, С. Яманака // Природа. 2013. № 1. С. 82–86.
3 Полный перечень биомедицинских проблем, которые финансирует NIH.
4 Об эффекте гидрофобности подробнее см.: Чугунов А. О., Полянский А. А., Ефремов Р. Г. Физическая водобоязнь // Природа. 2013. № 1. С. 24–34.


























Процесс создания капель с помощью пипетки [4]. Размер масштабной линейки — 2 мм